香芹酚对绵羊瘤胃体外养分降解率和发酵特性及产气量的影响
2022-04-18王子懿周瑞徐红伟臧荣鑫李耀东郑隆清马莹莹梁小燕袁龙
王子懿 周瑞 徐红伟 臧荣鑫 李耀东 郑隆清 马莹莹 梁小燕 袁龙



摘要:為了研究香芹酚对绵羊瘤胃体外养分降解率、发酵特性及体外产气量的影响,在瘤胃液中分别添加0、100、250、500、1 000 mg/L不同浓度的香芹酚,瘤胃发酵48 h后测定养分降解率、发酵参数及总产气量。结果表明,添加250 mg/L试验组的中性洗涤纤维降解率(NDFD)和酸性洗涤纤维降解率(ADFD)显著高于添加500 mg/L、1000 mg/L试验组和对照不添加香芹酚(P < 0.01)。添加250 mg/L试验组的干物质降解率(DMD)显著高于其他试验组(P < 0.01),而对照的DMD显著低于其他试验组(P < 0.01)。添加1000 mg/L试验组的pH显著高于其他组(P < 0.01)。添加250 mg/L试验组的乙酸浓度显著高于其他试验组(P < 0.01)、丙酸浓度显著高于其他试验组(P < 0.01)。香芹酚含量的增加均显著降低了丁酸的浓度(P < 0.01)。综上所述,在绵羊瘤胃体外培养液中加入香芹酚有助于增加饲草的营养降解量,调整瘤胃发酵作用特点,从而减少总产气量。体外条件下的香芹酚,加入总量不应超过250 mg/L。
关键词:香芹酚;养分分解率;体外发酵;发酵特性;发酵产气量
中图分类号:S816 文献标志码:A 文章编号:1001-1463(2022)03-0050-05
doi:10.3969/j.issn.1001-1463.2022.03.011
Effect of Carvacrol on Nutrients Degradation,Fermentation Characteristic, and Total Gas Production in Rumen of Sheep in Vitro
WANG Ziyi, ZHOU Rui, XU Hongwei, ZANG Rongxin, LI Yaodong, ZHENG Longqing, MA Yingying, LIANG Xiaoyan, YUAN Long
(College of Life Sciences and Engineering, Northwest Minzu University, Lanzhou Gansu 730030, China)
Abstract:The purpose of the experiment was to study the effects of carvacrol on nutrient degradation rate, fermentation characteristics and in vitro gas production in sheep rumen. This time, a single-factor completely randomized trial design was adopted, and rumen fluid was added with 0(control group), 100, 250, 500 and 1 000 mg/L, respectively. Nutrient degradation rate, fermentation parameters and total gas production were determined after rumen fermentation for 48 h. The results showed that the neutral detergent fiber degradation rate(NDFD) and acid detergent fiber degradation rate(ADFD) in 250 mg/L group were significantly higher than those of experiments in 500 mg/L and 1 000 mg/L group and control group(P < 0.01). Dry matter degradation rate (DMD) in 250 mg/L group was significantly higher than that of the other groups (P < 0.01), while the DMD of the control group was significantly lower than that of the other groups (P < 0.01). The pH value of 1 000 mg/L group was significantly higher than that of other groups(P < 0.01). The concentration of acetic acid in 250 mg/L group was significantly higher than that of other groups(P < 0.01), and the concentration of propionic acid was significantly higher than that of other groups(P < 0.01). The concentration of butyric acid was significantly decreased with the increase of carvacrol content(P < 0.01). In conclusion, the addition of carvacrol to the in vitro rumen culture medium of sheep can improve the nutrient degradation rate of the feed, adjust the rumen fermentation characteristics, and reduce the total gas production. Under in vitro conditions, the total amount of carvacrol added should not exceed 250 mg/L.
Key words:Carvacrol;Nutrient decomposition rate;Methane production;Fermentation characteristics;Fermentation gas production
香芹酚是一种可用作香精、卫生消毒剂的有机化合物[1 ]。香芹酚可在胃肠道内作用于上皮细胞,使其再生速度加快,病原体对肠道上皮细胞的感染减少,可抑制有害菌的生长,促进消化分泌物的生产[2 ]。另外,香芹酚还可以刺激血液循环,降低病原菌的数量,调节反刍动物瘤胃发酵,从而促进反刍动物盲肠营养成分消化,提高肠道吸收必需营养素的利用率,减轻动物的免疫防御压力[3 ]。其可以选择性地影响动物体内特定的瘤胃微生物,进而调节瘤胃代谢。在反刍动物饲粮中添加香芹酚可降低瘤胃内产气量排放,从而调控瘤胃的发酵[4 - 5 ]。我们研究了香芹酚不同添加浓度对绵羊瘤胃体外养分降解率和发酵特性的影响,以期通过试验确定香芹酚的最佳添加量,为反刍动物饲粮生产提供参考。
1 材料与方法
1.1 供体动物及饲养管理
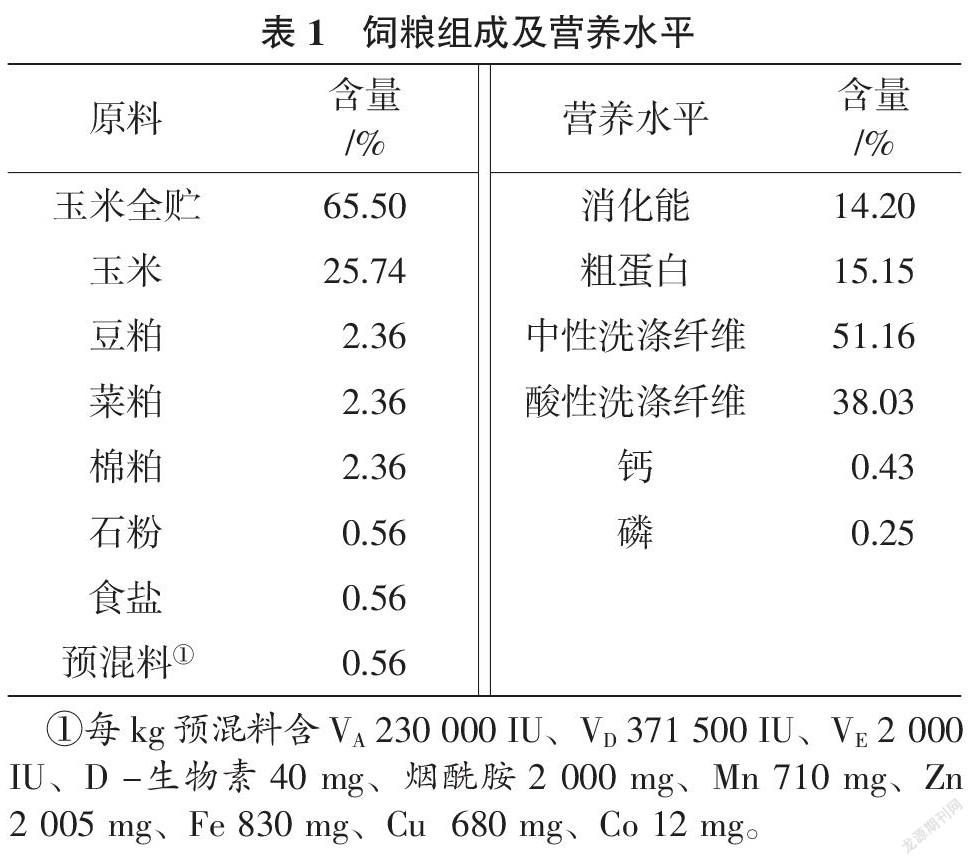
供体动物选择3只体重[(54.32±2.13) kg]、体况良好且装有永久性瘤胃瘘管的健康小尾寒羊作为瘤胃液供体羊。试验羊采用单栏喂养方法,饲粮根据国家肉羊饲养标准的推荐营养要求配制,具体饲粮组成和营养水平见表1。每日饲喂2次,自由饮水。待其适应生活环境后采集瘤胃液。
1.2 ;供试材料
供试香芹酚购自美国Ralco动物营养公司。
1.3 试验方法
1.3.1 试验设计 试验采取单因素随机设计,共分为5个试验组,每个试验组3个重复来减少试验的系统误差。即在250 mL的发酵瓶中分别添加5个不同浓度的香芹酚:不添加香芹酚组(对照组)、添加100 mg/L(试验组Ⅰ)、250 mg/L(试验组Ⅱ)、500 mg/L(试验组Ⅲ)和1 000 mg/L(试验组Ⅳ)。另设置3个重复的空白对照,即不添加发酵底物和香芹酚,仅用于发酵瓶中产气量的校正。
1.3.2 体外发酵与样品采集 供体羊的瘤胃内容物在早晨喂食2 h后通过瘤胃瘘管收集,过滤4层后,将瘤胃液灌入已经预热至40 ℃的保温瓶中,密封瓶盖后立即运回试验室。按照Mankn等方法制备人工瘤胃缓冲液,随后按一定比例将瘤胃液与其混合,放入40 ℃的水浴槽中,连续导入CO2,培养液颜色由粉色变至无色后即可使用[6 ]。准确称取1 g发酵底物,随后取出已预热的人造瘤胃缓冲液100 mL和过滤瘤胃液50 mL迅速添加至各发酵瓶内[7 ]。在发酵瓶持续充入CO2后立即盖上瓶塞,并将装有不同缓冲液的发酵瓶分别连接到气体产生装置的传感器上,随后放入40 ℃的恒温加热器中。体外发酵装置采用自主记录产气量的检测系统[8 ]。体外发酵所用的底物与供体动物饲喂的日粮基本一致[9 ]。在40 ℃下连续培养48 h后对培养液进行收集并分为2份,1份用于pH的测定,另1份保存于-20 ℃,用于挥发性脂肪酸浓度、总氮、氨态氮和尿素氮的测定[10 ]。
1.4 指标测定
1.4.1 饲粮养分测定 参照《饲料分析及饲养质量检测技术》测定底物和发酵产物的干物质、粗蛋白、酸性洗涤纤维和中性洗涤纤维含量[11 ]。计算干物质降解率(DMD)、酸性洗涤纤维降解率(ADFD)、中性洗涤纤维降解率(NDFD)[10 ]。
1.4.2 发酵参数及气体产量测定 利用pH计测定发酵液pH[12 ],使用苯酚-次氯酸钠比色法测定氨态氮(NH3-N)浓度,采用试剂盒配合全自动酶标仪测定微生物蛋白含量,采用氣相色谱仪测定挥发性脂肪酸含量[13 ]。气体测量系统发酵48 h后测定发酵瓶的压力。
1.5 数据统计与分析
试验数据库使用Excel软件建立、通过SPSS软件对数据进行处理 。
2 结果与分析
2.1 香芹酚对绵羊体外养分降解率的影响
由表2可知,随着香芹酚含量的逐渐增加,干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)和酸性洗涤纤维降解率(ADFD)呈先升高后降低趋势(P < 0.01)。DMD试验组Ⅱ的显著高于其他组(P < 0.01)。NDFD、ADFD试验组Ⅱ与试验组Ⅲ差异不显著,均显著高于对照组、试验组Ⅰ和试验组Ⅳ(P < 0.01)。
2.2 香芹酚对绵羊体外瘤胃发酵参数和总产气量的影响
由表3可知,香芹酚的添加量与pH呈正相关,试验组Ⅳ的pH显著高于其他试验组(P < 0.01)。与对照组相比,香芹酚含量的增加均使培养液氨态氮浓度显著降低(P < 0.01)。对照组、试验组Ⅲ的总挥发性脂肪酸(总VFA)浓度低于试验组Ⅰ、Ⅱ,高于试验组Ⅳ(P < 0.01)。试验组Ⅱ的乙酸、丙酸浓度均显著高于其他试验组(P <0.01)。香芹酚含量的增加使丁酸的浓度呈现下降的趋势(P < 0.01),对异丁酸浓度无显著影响(P > 0.05),对戊酸和异戊酸浓度影响不显著(P > 0.05)。对照组的乙酸/总挥发性脂肪酸比例低于试验组Ⅰ、Ⅱ、Ⅲ,高于试验组Ⅳ(P=0.01)。对照组的丙酸/总挥发性脂肪酸高于试验组Ⅰ、Ⅲ。对照组丁酸/总挥发性脂肪酸高于其他试验组(P > 0.05)。对照组异丁酸/总挥发性脂肪酸高于其他试验组(P > 0.05)。香芹酚含量对戊酸/总挥发性脂肪酸和异戊酸/总挥发性脂肪酸影响不显著(P > 0.05)。试验组Ⅰ、Ⅲ的乙酸/丙酸均高于其他试验组(P < 0.01)。从添加香芹酚含量的不同来判断,整体总产气量随着香芹酚含量的增加呈先减少后增加的趋势,试验组Ⅱ的总产气量最低(P < 0.01)。
3 结论与讨论
试验发现,香芹酚添加量为250 mg/L时乙酸和丙酸浓度最高,而总产气量最低。然而,随着香芹酚添加量的提高,乙酸和丙酸浓度降低,总产气量增加。在反刍动物的饲粮中添加250 mg/L香芹酚可提高干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)、酸性洗涤纤维降解率(ADFD),同时减少总产气量。综合上述结果认为,在绵羊瘤胃体外发酵条件下,香芹酚添加量不应高于250 mg/L。另外,当香芹酚添加量为100 g/L时,乙酸/ 总VFA,丙酸/总VFA以及丁酸/总VFA的比值最大,推测高浓度(大于100 g/L)香芹酚可能降低TVFA浓度,抑制瘤胃发酵。
瘤胃是绵羊最主要的消化器官之一[14 - 15 ]。瘤胃内体外降解速率反映了发酵系统中微生物对饲料的降解程度,还反映了动物对其消化和利用的难易程度[16 - 17 ]。金恩望等[4 ]的研究表明,当植物精油的添加量超过1.0 g/L将会抑制饲料底物的降解速率,但当小于1.0 g/L时则对微生物的分解速度并无显著影响。本研究表明,在加入250 g/L香芹酚时饲料养分的降解速率达到峰值,当香芹酚添加量超过250 g/L时饲料养分的降解速率则开始下降。分析其成因,可能是当香芹酚的加入量约为250 g/L时能够最大限度地刺激瘤胃微生物的活性,从而增强瘤胃的消化吸收机能,提高饲料养分降解率[18 - 19 ]。当添加量高于250 g/L时,则会对瘤胃发酵过程形成抑制作用,从而造成营养物质的降解速率减少。
瘤胃pH是衡量反刍动物瘤胃内环境稳态的重要指标[20 ]。Broderickga等[21 ] 的研究表明,培养液的pH与香芹酚的浓度水平呈正相关,其主要原因是受饲粮性质和反刍动物体内有机酸积累的影响[22 - 23 ]。本研究表明,培养液中添加香芹酚的可以显著提高pH含量,同时添加高水平的香芹酚会显著提高乙酸/丙酸比值。弱碱性唾液在反刍动物采食和反刍的过程中被大量分泌,可中和瘤胃中碳水化合物的发酵,产生大量的挥发性脂肪酸 [24 - 25 ]。香芹酚含量为250 g/L时总挥发性脂肪酸达到最大值。
NH3-N浓度是瘤胃内含氮物质的分解和瘤胃微生物对氨利用的综合反映[26 ]。研究发现,在体外培养液中添加高浓度香芹酚(高于750 g/L)可破坏瘤胃细胞膜的流动性,影响瘤胃的正常消化功能,从而影响瘤胃发酵[27]。试验表明,NH3-N的浓度随着香芹酚添加量的增大而降低,对照组中的NH3-N的浓度最高,分析其原因是香芹酚可以抑制瘤胃NH3的生成,从而增加了氮的利用率[28 ],NH3含量的减少意味着瘤胃蛋白分解速率的降低,或瘤胃微生物对 NH3-N利用率的提高[29 ]。总产气量是反映饲料可发酵水平和瘤胃微生物活动特性的首要指标 [30 - 31 ]。目前针对香芹酚与反刍动物发酵产气作用关系的研究较少,但有体外发酵试验可发现,绵羊瘤胃中乙酸和丙酸含量显著提高,这将有助于反刍动物对食物的消化和吸收[32 - 34 ]。
参考文献:
[1] 周 瑞,刘立山,吴建平,等. 牛至精油对绵羊瘤胃体外养分降解率、发酵特性及CH4产量的影响[J]. 草业学报,2019,28(11):168-176.
[2] 韦 胜,郝怀志,郎 侠,等. 牛至精油对绵羊生长性能及肌肉脂肪酸的影响[J]. 中国草食动物科学,2020,
40(2):23-29.
[3] 李袁飞,郝建祥,马艳艳,等. 体外瘤胃发酵法评定不同类型饲料的营养价值[J]. 动物营养学报,2013,
25(10):2403-2413.
[4] 金恩望,王加啟,卜登攀,等. 利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J]. 中国农业大学学报,2013,18(3):120-127.
[5] 乔升民,乔君毅,谭支良. 反刍动物瘤胃甲烷生成机制及调控措施研究进展[J]. 中国草食动物科学,2014,
34(1):44-48.
[6] 姚喜喜,吴建平,刘 婷,等. 全混合日粮中添加牛至精油对泌乳期荷斯坦奶牛生产性能和蹄病发生率的影响[J]. 草业科学,2016,33(2):299-304.
[7] 张文静,雷连成,魏静元,等. 植物精油对肉仔鸡生长、屠宰性能和免疫功能的影响[J]. 饲料工业,2016,
37(8):35-40.
[8] 梁建勇,李晓康,焦 婷,等. 牛至精油在畜禽生产中的研究进展[J]. 中国饲料,2017(9):2-25.
[9] 张 华,童津津,孙铭维,等. 植物提取物对反刍动物瘤胃发酵、生产性能及甲烷产量的调控作用及其机制[J]. 动物营养学报,2018,30(6):2027-2035.
[10] 张 然,郑 琛,闫晓刚,等. 牛至油对绵羊瘤胃发酵特性及饲粮营养物质瘤胃降解率的影响[J]. 动物营养学报,2018,30(10):4181-4189.
[11] 白乌日汗,海 洲,张春华,等. 植物精油及其活性成分对奶牛瘤胃发酵功能影响的研究[C]//中国畜牧兽医学会动物营养学分会. 第六次全国饲料营养学术研讨会论文集. 中国畜牧兽医学会动物营养学分会:中国畜牧兽医学会,2010.
[12] 徐方華. 牛至油及主要成分对瘤胃发酵特性和甲烷产量影响的研究[D]. 延吉:延边大学,2014.
[13] 张丽英. 饲料分析及饲料质量检测技术[M]. 第3版. 北京:中国农业大学出版社,2007.
[14] 郝正里,刘世民,孟宪政. 反刍动物营养学[M]. 兰州:甘肃民族出版社,2000.
[15] 周 怿,刁其玉. 反刍动物瘤胃甲烷气体生成的调控[J]. 草食家畜,2008(4):21-24.
[16] 谢仲权,牛树琦. 天然植物饲料添加剂生产技术与质量标准[M]. 北京:中国农业科技出版社,2004.
[17] 王桂秋. 营养水平对羔羊物质消化的影响及羔羊早期断奶时间的研究[D]. 北京:中国农业科学院,2005.
[18] 王雅倩,俞 路,闫寒寒. 瘤胃真菌对纤维降解的研究进展[J]. 饲料工业,2008,29(5):41-43.
[19] 陈 昊,刘 婷,吴建平,等. 牛至精油对新生犊牛生长发育和血液免疫的影响[J]. 草业科学,2017,
34(10):2141-2148.
[20] ROG?魪RIO M C,DE CASTRO E M,MARTINS E C,et al. Economic and financial analysis on die-casting pressing formulated by NRC(1985) and NRC(2007)[J]. Sanitation and Production of Tropical Animals,2012,45( 1 ):259-266.
[21]BRODERICKGA,KANGJH. Automatic simultaneous determination of ammonia and total amino acids in rumen fluid and in vitro culture medium[J]. Journal of Daily Science,1980,63(1):64-75.
[22] ZHOUZ,MENGKE,YUZ. The effect of methanogenic inhibitors on the number of methanogenic and methanogenic bacteria and cellulose-degrading bacteria in vitro rumen culture[J]. Applied and Environmental Microbiology,2011,77(8):2634-2639.
[23]XUEHF,MENGQX. Recent nutrition research proress of dietary neutral detergent fiber[J]. Zoology of China,2007,19(1):454-458.
[24] MCINTOSHF M,WILLIAMSP,LOSAR,et al. Effects of essential oil tumor microorganisms and their protein metabolism[J]. Application and Environmental Microbiology,2003,69(8):5011-5014.
[25] COBELLISG,TRABALZA MARNUCCIM,YUZ. Critical evaluation of essential oil condiments nutrition:views[J]. General Environmental Sciences,2016,
103(12):545-546.
[26] BHATTAR,JIANHUA. Using plant secondary metabolites Springer to reduce methane emissions. The impact of climate change on life stock:adaptation and mitigation[M]. India:Springer,2015.
[27] COBELLISG,PETROZZIA,FORTE C,et al. Evaluation of the effects of mitigation on methane and ammonia production by using Origanum vulgare L. and Rosmarinus officinalis L. essential oils on in vitro rumen fermentation systems[J]. Sustainability,2015,7(9):12856-12869.
[28] PATRAAK,YUZT. Effects of essential oils on methane production and fermentation by,and abundance and diversity of,rumen microbial populations[J]. Applied and Environmental Microbiology,2012,78(12):4271-4280.
[29] CHAVES A V,HE M L,YANG W Z,et al. Effects of essential oils on proteolytic,deaminative and methanogenic activities of mixed ruminal bacteria[J]. Canadian Journal of Animal Science,2008,88(1): 117-122.
[30] FLYTHE M D. The antimicrobial effects of hops (Humulus lupulus L.) on ruminal hyper ammonia-producing bacteria[J]. Letters in Applied Microbiology,2009, 48(6):712-717.
[31] CHAUDHARYPP,GOELN,BAKERRG,et al. Influence of essential oils supplementation on rumen fermentation profile and ruminal microbial population in vitro[J]. Journal of Science,2016,1(4):25-34.
[32] CIESLAKA,SZUMACHER-STRABEL M,STOCHMA L A,et al. Plant components with specific activities against rumen methanogens[J]. Animal,2013,7(Suppl.2):253-265.
[33]WANG C J,WANG S P,ZHOU H. Influences of flavomycin,ropadiar,and saponin on nutrient digestibility, rumen fermentation,and methane emission from sheep[J]. Animal Feed Science and Technology,2009,148:157-166.
[34] TILLEYJM A,TERRYRA. Two-stage technique for in vitro digestion of forage[J]. Grassand Forage Science, 2010,18(2): 104-111.
收稿日期:2022 - 01 - 19;修订日期:2022 - 02 - 06
基金项目:中央高校本科生科研创新项目(1012021XBMU21107);西北民族大学人才引进项目(Z20066);国家民委专项(31929210004);甘肃省青年科技基金计划(21JR1RA213)。
作者简介:王子懿(2001 — ),女,陕西安康人,本科在读,专业方向为反刍动物营养。Email:1209493221@qq.com。
通信作者:周 瑞(1991 — ),女,寧夏中卫人,讲师,博士,研究方向为反刍动物营养。Email:zhour1222@163.com。
