PEDV、TGEV、PDCoV 和GAR 多重RT-PCR检测方法的建立及应用
2022-04-14张丽荣姚明杰孔令保
张丽荣 ,冯 田 ,姚明杰,郭 萍 ,丁 珍 ,孔令保,王 婷
(1.江西农业大学,a.生物科学与工程学院;b.动物科学技术学院,南昌 330045;2.南昌动物病毒与基因工程重点实验室,南昌 330045;3.武汉科前生物股份有限公司,武汉 430206)
病毒性腹泻严重影响着养猪产业,造成巨大的经济损失。特别是2010 年以来由PEDV 变异株所致的仔猪腹泻及2014 年发现的致病性PDCoV,使中国养猪业面临新的威胁和挑战,是关注的热点和防控重点[1,2]。PEDV、TGEV、PDCoV 和 GAR 这 4 种病毒是常见典型的猪肠道病毒,均可引起仔猪呕吐、腹泻,最后严重脱水甚至死亡,其发病的临床症状相似,难以区分[3,4]。猪场普遍存在腹泻病毒的混合感染,并且呈交叉感染。传统方法造价较高、非特异性强、周期较长难以有效区分,不适合大规模的诊断鉴定。因此,建立能够快速同时检测致猪腹泻病毒性病原的方法在临床上对该病的防控具有重要意义。当前,国内外已有学者建立了一些病毒的多重RTPCR 鉴别检测方法。任玉鹏等[5]建立了 PEDV、TGEV、PDCoV 三重 RT-PCR 方法,但迄今未见同时检测并区分 PEDV、TGEV、PDCoV、GAR 多重 RTPCR 方法的报道。本试验建立了针对PEDV、TGEV、PDCoV 和GAR 4 种腹泻性病毒的多重RTPCR 检测方法,并且对该方法条件优化后,进行了特异性、敏感性和重复性分析。同时利用该方法检测了江西省部分地区养猪场送来的临床样本,验证该方法的可靠性,以期为兽医临床提供快速诊断和治疗的方法依据。
1 材料与方法
1.1 病毒
猪繁殖与呼吸综合征病毒(PRRSV)、乙型脑炎病毒(JEV)、口蹄疫病毒(FMDV)、猪 δ 冠状病毒(PDCoV)由江西农业大学南昌动物病毒与基因工程重点实验室保存。非洲猪瘟病毒(ASFV)为自制灭活疫苗。猪传染性胃肠炎-猪流行性腹泻-猪轮状病毒三联弱毒冻干活疫苗购自哈尔滨维科生物技术公司。
1.2 引物设计及合成
利用Primer Premier 5.0 分析软件,根据Gene-Bank 中登录的 PEDV(登录号 MK841495.1)N基因、TGEV(登录号 KT696544.1)N基因、PDCoV(登录号MN942260.1)N基因和 GAR(登录号 JX498961.1)VP7基因序列设计 4 对引物(表 1),分别扩增 693、557、495 和355 bp 的目的基因片段;引物由北京擎科生物技术有限公司合成。

表1 多重RT-PCR 引物信息
1.3 病料处理及病毒核酸提取
用PBS 缓冲液将粪便样品稀释10 倍,在涡旋仪上振荡混匀 10 min 后,7 770 r/min 离心 5 min,取上清液用于核酸提取;猪小肠样品放于EBSS 缓冲液中(10%)振荡悬浮,7 770 r/min 离心5 min,取上清用于核酸提取。参照RNA isolater Total RNA Extraction Reagent提取试剂盒说明书提取病毒总RNA,并利用反转录试剂盒制备反转录cDNA,-80 ℃保存备用。
2 结果与分析
2.1 单项RT-PCR 退火温度的确定
采用不同的退火温度进行PCR 扩增(50.8、51.8、53.2、55.0、56.5 ℃),25 μL 扩增体系中加入模板 2 μL,上下游引物各 1 μL。如图 1 所示,PEDV 和TGEV 在5 个退火温度下均能扩增出较亮条带,PDCoV 和GAR 在不同退火温度下扩增效率不一,条带亮度不一。最终确定的退火温度为51.8 ℃。

图1 PEDV、TGEV、PDCoV 和GAR 单项RT-PCR 退火温度的确定
2.2 多重RT-PCR 反应条件的确定
在单一RT-PCR 测试5 个退火温度的基础上,加入4 种病毒混合cDNA 模板2 μL,每种病毒上下游引物各1 μL 进行PCR 扩增,结果显示,与单项PCR 扩增结果一致,在退火温度51.8 ℃时扩增效果好,同时在53.2 ℃也可得到较好扩增效果(图2A)。为确定反应体系中引物使用量,在筛选出的2 个退火温度(51.8 和53.2 ℃)条件下,4 个病毒的引物上下游各加入0.25、0.50、1.00 μL 进行反应。经方阵试验确定多重RT-PCR 反应最佳体系为2 × RapidTaqMaster Mix 12.5 μL、上 下 游 引 物 各 0.25 μL(10 μmol/L)、模板 2 μL、加灭菌 ddH2O 25 μL。当退火温度为51.8 ℃(图2B),多重PCR 扩增效果最好。RT-PCR 反应程序:95 ℃ 3 min,95 ℃ 15 s,51.8 ℃15 s,72 ℃ 20 s,35 个循环;72 ℃延伸 5 min。
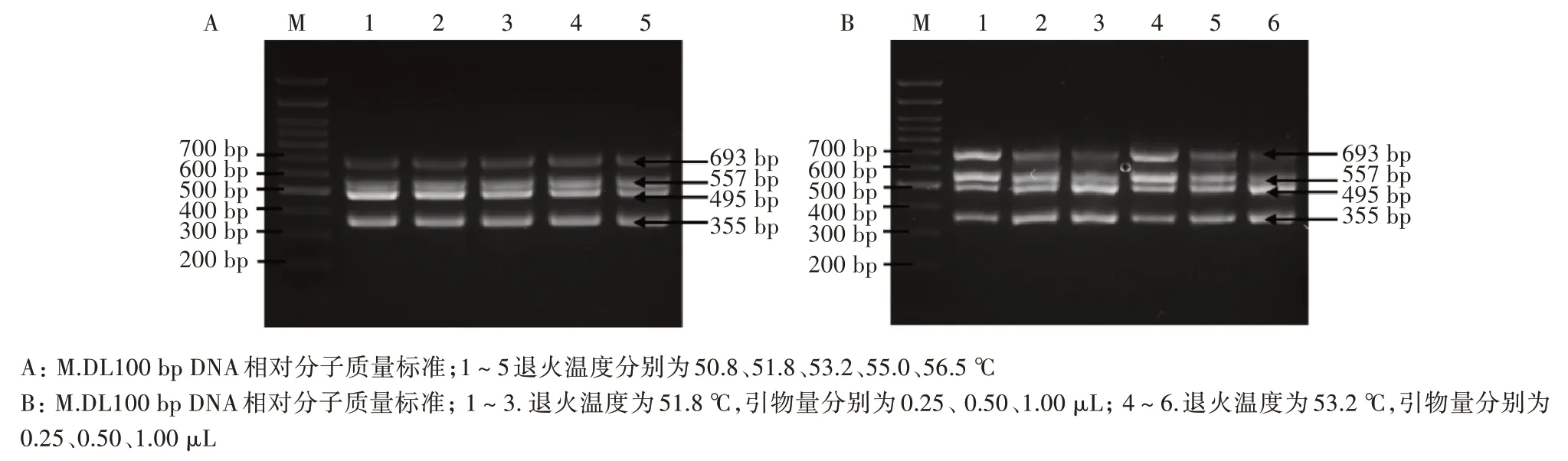
图2 多重RT-PCR 退火温度及引物浓度的确定
2.3 多重RT-PCR 敏感性试验结果
构建4 种病毒目的片段的重组质粒。根据质粒拷贝数(拷贝/μL)=[6.02×1023×质粒浓度(ng/μL)×109]/(660×质粒碱基数),换算为拷贝数。通过换算,PEDV、TGEV、PDCoV 和GAR 质粒拷贝数分别为8.7×1010、9.8×1010、1.25×1010、1.21×1010拷贝/μL。按照最佳反应条件和体系,将上述质粒10 倍倍比稀释液混合后作为模板进行扩增。结果(图3)显示,本试验建立的多重RT-PCR 方法检测PEDV、TGEV、PDCoV 和GAR 4 种病毒的最低检出量分别为8.7、9.8、1 250 和 12.1 拷贝/μL。

图3 多重RT-PCR 敏感性试验结果
2.4 多重RT-PCR 特异性试验结果
采用优化后的多重RT-PCR 反应条件对PEDV、TGEV、PDCoV 和 GAR 混合模板,以及 4 种病毒单一模板进行扩增,同时以常见猪病毒PRRSV、JEV、FMDV、ASFV 的 cDNA 为模板,以及 HCV 的 cDNA 和水为模板设为对照进行PCR 扩增。结果如图4 所示,PRRSV、JEV、FMDV、ASFV 和 HCV 模板扩增后均未见到扩增产物,只有PEDV、TGEV、PDCoV 和GAR 扩增出了相应的目的条带。

图4 多重RT-PCR 特异性试验结果
2.5 多重RT-PCR 重复性试验结果
以PEDV、TGEV、PDCoV 和GAR 混合模板,以及3 种病毒不同组合混合模板、2 种病毒不同组合混合模板、单一病毒模板进行PCR 重复检测,结果(图5)显示,不同组合模板均能扩增得到与预期大小相符的目的条带,表明建立的多重RT-PCR方法重复性好。

图5 多重RT-PCR 重复性试验结果
2.6 临床样品检测结果
利用建立的多重RT-PCR 以及单一RT-PCR 方法对采自江西某地猪场的30 份临床样品进行检测,图6 显示部分临床样本的检测结果,其中包括5 份小肠样本和6 份粪便样本。有2 份小肠样本和2 份粪便样本检测到PEDV。30 份样本中PEDV、TGEV 和GAR 的阳性检出率为66.7%、3.3%、6.7%(表2)。多重检测与单一检测符合率为100%。表明本研究建立的多重RT-PCR 方法准确率较高,可以应用于临床样品的检测。

图6 部分临床样品多重RT-PCR 检测结果
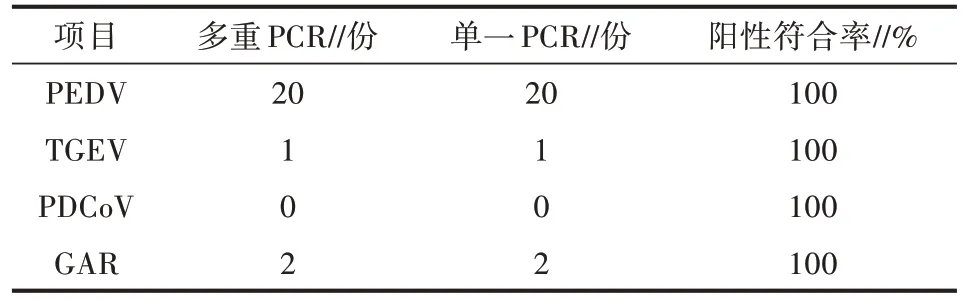
表2 30 份多重RT-PCR 与单一RT-PCR 检测结果比较
3 小结与讨论
病毒性疾病给养猪业带来了严峻的挑战,对于病毒核酸的检测主要是利用PCR 或者RT-PCR 方法。设计引物时,除了保证引物中的G+C 含量和Tm值符合常规PCR 的要求外,还要求多条引物的G+C含量尽量保持一致。引物设计完成后,要在同种病毒的不同毒株之间进行同源性比对,保守性评估,另外还需与其他病毒进行比对以确定设计的引物是否具有良好的特异性[6,7]。逄凤娇等[8]建立的 RT-PCR方法对PDCoV 重组质粒标准品的最低检测限为4.05×103拷贝/μL;而本研究中PEDV 最低检出量为8.7 拷贝/μL。利用建立的多重RT-PCR 方法对来自江西某地猪场的30 份临床样本进行检测,通过与单一PCR 方法以及商品化ELISA 试剂盒检测方法比较,发现检测符合率很高。
本研究建立的多重RT-PCR 方法特异性较强、敏感性较高且检测快速便捷,可对PEDV、TGEV、PDCoV 和GAR 4 种致猪腹泻病毒进行鉴别检测,对猪场流行病学调查及相应疾病防控具有重要实践意义,可应用于临床大规模检测。
