鲢鱼背肌组织蛋白酶L的初步分离及蛋白层析纯化方法
2022-04-12焦熙栋闫博文孟令璐曹洪伟黄建联赵建新范大明
王 谦,焦熙栋,闫博文,孟令璐,曹洪伟,黄建联,赵建新,张 灏,陈 卫,范大明
(1 江南大学食品科学与技术国家重点实验室 江苏无锡 214122 2 农业农村部冷冻与调理水产品加工重点实验室 福建厦门 361022 3 江南大学食品学院 江苏无锡 214122 4 福建省冷冻调理水产品加工重点实验室 福建厦门 361022 5 福建安井食品股份有限公司 福建厦门 361022)
中国淡水鲢鱼资源丰富,以鲢鱼肌肉为原料加工的鱼糜制品因高蛋白和低脂肪等特点而消费前景看好。在鱼糜加工过程中大多出现凝胶劣化现象,鱼肉被内源性蛋白酶降解,导致鱼糜凝胶强度低、口感差等问题[1],其中淡水鱼糜制品的凝胶劣化现象相较于海水鱼更为严重[2]。大多数研究认为肌纤维结合性蛋白酶是鱼糜凝胶劣化现象的主要诱因,因为其与蛋白结合紧密,在鱼糜加工过程中不易去除[3]。其中,组织蛋白酶L(EC 3.4.22.15)因水洗后残留活性高、热稳定性强、抗冻性强和具有广泛的底物特异性等特征而备受关注[4-6]。目前研究大多通过分子克隆手段获得组织蛋白酶L,此方法难度较大,尤其是异源蛋白的表达受多种因素影响,从而间接影响酶的活性和结构[7]。市售组织蛋白酶L 大多来源于哺乳动物,而鱼类与哺乳动物组织蛋白酶L 的同源性较差,白鲢组织蛋白酶L 的基因片段尚未被鉴定,针对鲢鱼组织蛋白酶L 的分子克隆研究极少。有必要对白鲢的内源性组织蛋白酶L 进行分离纯化,为研究抑制鱼糜凝胶劣化方法提供依据。
由于组织蛋白酶L 含量较少且其和肌肉结合紧密性强,现有的纯化方法大多采用阴离子交换层析、分子筛层析、阳离子交换层析和染料亲和层析组合的多步层析法来保证其纯度,然而此法步骤繁杂,耗时长且回收率低[8]。本文在现有组织蛋白酶L 分离纯化方法的基础上,优化酸处理、盐析和透析等分离步骤,建立弱阴离子交换和分子筛两步层析法,作为一种分离纯化鲢鱼组织蛋白酶L 的新型方法。
1 材料与方法
1.1 材料与试剂
活白鲢(每条1 500~2 000 g),购买于附近超市,击晕宰杀后装冰速运至实验室待用;蛋白纯化层析柱 HiTrap SP HP、HiTrap Q HP、HiTrap DEAE FF (1.6 cm×2.5 cm) 和HiLoad16/600 Superdex 75 pg(1.6 cm×60 cm)Cytiva(思拓凡),原通用电气医疗生命科学事业部;荧光合成底物ZPhe-Arg-MCA 和7-氨基-4-甲基香豆素(AMC),美国sigma-aldrich 西格玛奥德里奇公司;Bradford蛋白测定试剂盒,上海碧云天有限公司;快速银染试剂盒,上海生工生物工程股份有限公司;三氯乙酸、乙酸、乙醇、十二烷基磺酸钠、氯化钠、醋酸钠、氢氧化钠、磷酸氢二钠、磷酸二氢钠等其它试剂均为国产分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
真空斩拌乳化混合多功能一体机,德国Stephan 公司;AKTA pure 蛋白层析系统,瑞典通用电气医疗集团(GE Healthcare);F-7000 荧光光谱仪,日本日立(Hitachi)公司;高速冷冻离心机,美国Beckman Coulter 公司;79480-3 冷冻干燥机,美国CONCO 公司;蛋白电泳系统,美国Bio-Rad 公司。
1.3 试验方法
1.3.1 粗酶的分离 宰杀后的新鲜白鲢取其背部肌肉放入真空斩拌锅低速斩拌至碎肉状,加入4倍体积4 ℃预冷的25 mmol/L 乙酸钠缓冲液(含5 mmol/L L-Cys、0.3 mmol/L PMSF,pH 5.0) 于4 ℃匀浆20 min 后12 000×g 离心20 min 取上清液,上清液用四层纱布过滤后即为粗酶分离液。
1.3.2 酸处理 用1 mol/L 盐酸分别调整粗酶分离液的pH 值至3.0 和4.0,于30 ℃分别反应5,10,15,20,25,30 min 后用1 mol/L 氢氧化钠回调pH 值至5.8~6.0,立即12 000×g 离心20 min 取上清液测酶活,此上清液即为酸化级分。
1.3.3 硫酸铵盐析 对酸化级分用40%~90%的硫酸铵分级沉淀,充分盐析后12 000×g 离心20 min,分别收集沉淀和上清液,测其蛋白浓度和酶活。收集到的沉淀部分即为硫酸铵级分。
1.3.4 透析超滤浓缩 对硫酸铵级分用含有5 mmol/L L-Cys,pH 值为6.0 的20 mmol/L 的磷酸盐缓冲液溶解,选用分子质量分别为3 500,7 000,14 000 u 的透析膜于4 ℃下透析24 h。透析级分通过超滤浓缩即为浓缩粗酶液。
1.3.5 离子交换层析 将浓缩粗酶液用0.45 μm微孔滤膜过滤后分别上样到HiTrap DEAE FF(1.6 cm×2.5 cm)、HiTrap Q HP (1.6 cm×2.5 cm)、HiTrap SP HP(1.6 cm×2.5 cm)离子交换柱,流动相A 分别为20 mmol/L 的磷酸盐缓冲液 (含5 mmol/L L-Cys,pH 值为6.0,7.0)、50 mmol/L 的乙酸盐缓冲液(含5 mmol/L L-Cys,pH 值为4.5),以0~1 mol/L 氯化钠梯度洗脱,收集活性峰后透析、超滤浓缩,即为离子交换级分。流速1 mL/min,每管收集4 mL。
1.3.6 HiLoad16/600 Superdex 75 pg 凝胶过滤层析 将离子交换级分上样于HiLoad16/600 Superdex 75 pg (1.6 cm×60 cm) 凝胶柱,用含0.2 mol/L 氯化钠的20 mmol/L 的磷酸盐缓冲液 (含5 mmol/L L-Cys,pH 值为6.0)平衡和洗脱,流速为1 mL/min,收集活性峰,每管4 mL,透析超滤浓缩冻干存于-80 ℃备用。
1.3.7 组织蛋白酶L 活力测定 参照Yamashita等[9]的方法,将组织蛋白酶L 的特异性底物ZPhe-Arg-MCA 浓度配制成0.1 mol/L,将含有20 mmol/L 新制备的半胱氨酸的0.5 mL 4 mmol/L EDTA-0.4 mol/L 乙酸钠缓冲液(pH 5.5)加入到0.9 mL 样品中。混合溶液在25 ℃下预热,同时快速加入0.5 mL 0.1 mmol/L 合成底物开始反应。在25 ℃下反应30 min 后,通过添加3.0 mL 0.1 mol/L三氯乙酸0.1 mol/L 乙酸缓冲液(pH 4.5)终止反应。在激发波长370 nm 和发射波长460 nm 处测量了反应体系中AMC 的荧光值。采用标准AMC样品作为标准曲线。在25 ℃下,按照1 个酶活单位为释放1 nmol AMC 计算组织蛋白酶L 的活性。
1.3.8 蛋白质浓度测定 参考考马斯亮蓝法,采用去垢剂兼容型Bradford 蛋白定量试剂盒,以牛血清蛋白为标准品。样品组每根离心管加入100 μL 样品稀释液,迅速加入1 mL Bradford 工作液混匀,室温15~30 ℃反应10 min 后在分光光度计上测595 nm 处吸收值。
1.3.9 蛋白质聚丙烯酰胺凝胶电泳-银染法 采用聚丙烯酰胺凝胶电泳法制备样品凝胶,电泳完成后采用银染法监测凝胶中低丰度蛋白质[10]。
1.4 数据处理
试验中随机抽取样本,每组样品至少平行测定3 次。试验数据均用平均值±标准误差表示。测定样品的平均值进行显著性分析(P<0.05)。图表用OriginPro 2017 软件绘制。
2 结果与讨论
2.1 初步分离条件的优化
目前已有较多研究从多种生物的肌肉或者内脏中分离纯化出组织蛋白酶L,包括从鲤鱼背部白肌[11]、耗牛肉[12]、牛胰脏[6]、鱿鱼肝脏[13]等,主要采用硫酸铵盐析和蛋白柱层析等多种蛋白纯化方法相结合的手段。为了除去杂蛋白,提高酶的比活,本研究在初步提取阶段对酸化、盐析、透析3 个步骤进行条件优化。
2.1.1 酸处理条件的优化 因为组织蛋白酶L 具有较高的热稳定性和酸稳定性,通常会对粗酶液进行先酸化保温后回调pH 值的酸处理手段来提高回收率[15]。不同的酸处理条件下粗酶液中组织蛋白酶L 的活性变化如图1所示,粗酶液经过pH 3.0,40 ℃热处理10 min 后,其中组织蛋白酶L 比活增加最多,是粗酶液的37 倍,故选取pH 3.0,40 ℃热处理10 min 后回调至pH 6.0 作为酸处理最优条件。

图1 不同酸处理条件对组织蛋白酶L 活性的影响Fig.1 Effect of acid condition on cathepsin L activity
2.1.2 盐析条件的优化 硫酸铵盐析法可以从大量粗酶液中浓缩和部分纯化蛋白质,还可以除去脂类等杂质[14]。粗酶液的盐析曲线如图2所示,可以看出随着硫酸铵饱和度的增加,组织蛋白酶L在30%~40%的蛋白沉淀中比活相对较少,只有1 U/mg 左右,而在55%的硫酸铵中开始大量沉降,当硫酸铵饱和度达到55%,70%,80%,90%时,比活分别达到2.40,2.63,2.08,1.91 U/mg,因此选用55%~90%的硫酸铵饱和度可以最大限度回收目的蛋白。

图2 组织蛋白酶L 的盐析曲线Fig.2 Salting out curve of cathepsin L
2.1.3 透析条件的优化 对用3 种透析袋分离得到的不同分子质量的组分进行组织蛋白酶L 活性测定,测定结果见表1。由表1可知,通过7 000 u透析袋透析得到的组分中组织蛋白酶L 的比活最高,通过14 000 u 透析袋的组分比活最低,表明粗酶液在7 000~14 000 u 分子质量范围内存有活性的组织蛋白酶L 中间体。这与前人的报道[16-17]一致,组织蛋白酶L 的分子质量在30~45 ku 范围内,但在机体内组织蛋白酶L 存在多种形式,包括酶-内源抑制剂形式、无活性且低活性的前体形式和有活性的成熟单体形式,同时在酸化处理过程中会形成各种分子质量形式的活性中间体和小分子质量的成熟体,所以实际得到的产物是组织蛋白酶L 各种活性形式的混合物。因此为了最大限度回收具有活性的组织蛋白酶L,本法选取7 000 u 的透析袋进行粗分离。

表1 不同分子质量透析袋对组织蛋白酶L 活性的影响Table 1 Effects of molecular weight of dialysis bags on cathepsin L activity
2.2 蛋白纯化条件的优化
2.2.1 离子交换层析柱的选择 Liu 等[18]采用离子交换层析、分子筛层析、阳离子交换层析和亲和层析四步纯化出鲢鱼背肌中的组织蛋白酶L;Hu等[19]采用一步离子交换色谱法从鲤鱼背肌中纯化得到组织蛋白酶L;Cui 等[6]和Ogata 等[20]的纯化结果表明强阳离子交换可以大幅提高组织蛋白酶L的比活,表明阳离子交换柱对组织蛋白酶L 具有很好的分离效果。为了选取适合的蛋白纯化层析柱,试验中采用强阳离子(HiTrap SP HP)、强阴离子 (HiTrap Q HP) 和弱阴离子 (HiTrap DEAE FF)3 种离子交换柱对粗酶液中的组织蛋白酶L进行分离,通过组织蛋白酶L 比活来筛选合适的离子交换柱,结果如图3所示。
粗酶液经弱阴离子柱交换层析(图3a)后,在40~80 mL 的洗脱体积范围内得到最高活力为236 U/L 的组织蛋白酶L 活性部分;经强阴离子柱交换层析(图3b)后,在15~30 mL 的洗脱体积范围内得到最高活力为181 U/L 的组织蛋白酶L 活性部分;而经强阳离子柱交换层析(图3c)后,仅在50~60 mL 的洗脱体积范围内得到最高活力为113 U/L 的组织蛋白酶L 活性部分。阴离子柱分离得到的蛋白峰分离度更好,分辨率更高,且目的蛋白峰紫外强度在16 mAU 左右,而阳离子柱分离得到的蛋白峰数量多且粘连,其目的蛋白峰紫外强度在2 mAU 左右,说明阴离子交换柱能有效吸附鲢鱼组织蛋白酶L,且有效分离杂蛋白。此结果与前人的研究结果类似[8,18-19,21]。
对比图3a 和图3b,可以看出经弱阴离子柱分离得到的目的蛋白峰宽更大,且其洗脱得到的活性蛋白溶液中组织蛋白酶L 活力更高,是强阴离子柱的1.3 倍。该结果可能是因为强阴离子柱的适用pH 值范围在2~12,弱阴离子柱的适用pH值在2~9,故对于酸性蛋白酶(结果见图8)的组织蛋白酶L 分离,弱阴离子柱的分辨率要高于强阴离子。因此根据试验结果选取弱阴离子柱(Hi-Trap DEAE FF)作为组织蛋白酶L 分离纯化的离子柱。
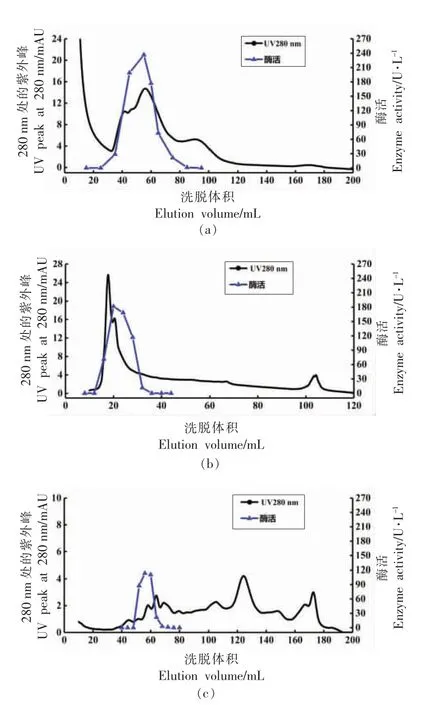
图3 采用不用离子交换层析柱——HiTrap DEAE FF(a)、HiTrap Q HP(b)、HiTrap SP HP(c)对组织蛋白酶L 纯化效果影响Fig.3 Effect of ion exchange chromatography column on purification of cathepsin L HiTrap DEAE FF (a),HiTrap Q HP (b),HiTrap SP HP (c)
2.2.2 流动相A 的pH 值选择 离子交换层析的基本反应过程是填料与待分离物质以及缓冲液中离子间的交换,所以在离子交换层析中平衡缓冲液和洗脱缓冲液的离子强度和pH 值的选择对于分离效果有很大的影响。平衡缓冲液的离子强度和pH 值的选择首先要保证待分离蛋白的稳定,并尽量使目的蛋白和杂质与离子交换填料的结合有较大的差别,使目的蛋白与离子交换填料有稳定的结合,而尽量使杂质与离子交换填料结合不稳定,因此选择合适的平衡缓冲液就可以去除大量的杂蛋白[22]。大部分研究选取20 mmol/L、pH 6.0 磷酸盐缓冲液作为平衡缓冲液,也有选取20 mmol/L、pH 7.5 的Tris-HCl 缓冲液作为弱阴离子柱的平衡缓冲液[13]。由于本试验选取的弱阴离子柱填料有所改进,为了确定其最佳平衡缓冲液pH 值,分别选取pH 6.0 和pH 7.0 的20 mmol/L 磷酸盐缓冲液对组织蛋白酶L 分离,蛋白层析曲线结果如图4所示。通过对比可以看出在pH 6.0 条件下此弱阴离子柱对组织蛋白酶L 的分离度更好,且其最高酶活(236 U/L)是pH 7.0 条件下(180 U/L)的1.31 倍。pH 6.0 条件下在280 nm处检测到的目的蛋白峰强度为4~15 mAU,比pH 7.0 条件下的2~7 mAU 高,故选取20 mmol/L、pH 6.0 磷酸盐缓冲液作为此弱阴离子柱的平衡缓冲液。该结果可能是因为pH 6.0 更接近组织蛋白酶L 的等电点[7,23],目的蛋白在其等电点处更容易保留。虽然根据等电点原理,目的蛋白在pH 7.0 的离子化程度更大,更容易被洗脱,然而试验结果在pH 7.0 时不好的原因可能是体系的离子强度大导致磷酸根和样品会竞争填料上的弱碱性阴离子基团,从而导致洗脱后目的蛋白峰面积较小。

图4 采用不用pH 值平衡缓冲液——pH 6.0(a)、pH 7.0(b)对组织蛋白酶L 纯化效果影响Fig.4 Effect of different pH balance buffer on the purification of cathepsin L pH 6.0 (a),pH 7.0 (b)
2.2.3 分子筛层析 为了进一步纯化组织蛋白酶L,将经弱阴离子柱交换后的活性部分收集浓缩加到平衡好的Superdex 75 pg 分子筛层析柱,所得层析洗脱曲线如图5所示,可以看出在40~50 mL洗脱体积处有蛋白组分Ⅰ和组分Ⅱ,在50~70 mL洗脱体积处有一组紫外信号较弱的蛋白组分Ⅲ,在100~120 mL 洗脱体积处有紫外信号较强的蛋白组分Ⅳ,通过酶活测定表明蛋白组分Ⅲ为组织蛋白酶L,同时也表明分子筛层析柱能够将组织蛋白酶L 与其它杂蛋白进一步分离。

图5 组织蛋白酶L 的Superdex 75 pg 分子筛层析洗脱曲线Fig.5 Superdex 75 pg molecular sieve elution curve of cathepsin L
2.3 组织蛋白酶L 初步分离及纯化方法的评价
2.3.1 SDS-PAGE 电泳法鉴定纯度 将具有组织蛋白酶L 活性的洗脱部分收集浓缩后通过SDSPAGE 电泳银染色法鉴定其纯度,结果如图6所示。泳道2 显示粗酶液通过弱阴离子交换层析后大分子质量杂蛋白已经得到有效去除,但仍有部分杂蛋白保留。泳道3 显示通过分子筛层析柱的组织蛋白酶L 活性部分在45 ku 处出现单一条带,表明上述两步组合层析法可获得电泳纯的组织蛋白酶L。其它研究从鲤鱼中获得的组织蛋白酶L 分子质量为36 ku[19],从蓝园鲹中纯化的组织蛋白酶L 分子质量为30 ku[21],Li 等[8]证明鲢鱼的组织蛋白酶L 前体的分子质量为78 ku,而组织蛋白酶L 之间分子质量的差异可以归因于使用的鱼类种类和试验条件的不同。由于本研究中纯化的组织蛋白酶L 分子质量为45 ku,低于组织蛋白酶L 前体的分子质量(78 ku),故推测本研究中纯化的组织蛋白酶L 为成熟形态。

图6 鲢鱼背肌组织蛋白酶L 的SDS-PAGE 分析Fig.6 SDS-PAGE analysis of cathepsin L in silver carp dorsal muscle
2.3.2 粗分离及纯化结果表征 粗分离各步及层析过程中组织蛋白酶L 的比活和纯化倍数结果见表2,经过两步层析法最终纯化倍数为487 倍,从1 000 g 鲢鱼肌肉中分离纯化的组织蛋白酶L 约22 mg。结果显示粗分离步骤的纯化效率一般,经弱阴离子交换层析后纯化倍数相较于粗酶液提高了近3 倍,分子筛层析一步的纯化倍数相比阴离子层析提高不显著,说明阴离子交换柱已去除大部分杂蛋白。Hu 等[19]采用一步离子交换色谱法从1 000 g 鱼中纯化出4.35 mg 组织蛋白酶L,纯化倍数为18 倍。Li 等[8]采用离子交换、凝胶过滤和亲和层析四步法从1 000 g 鱼肉中纯化出0.32 mg 组织蛋白酶L,纯化倍数为2 130 倍。不同的纯化结果与鱼的种类有关[24],此外使用的层析步骤越多,其纯化倍数越高,回收率越低。综上所述,本试验中采用的弱阴离子交换和分子筛两步层析法纯化倍数和回收率均较高且简单省时。

表2 鲢鱼背肌组织蛋白酶L 纯化结果表Table 2 Purification result of cathepsin L from silver carp dorsal muscle
2.4 组织蛋白酶L 的基本酶学性质
2.4.1 最适反应温度和热稳定性 由图7可知,随着反应温度增加,白鲢组织蛋白酶L 的活性先增加后急剧下降,其最适反应温度为55 ℃,与大部分研究报道的45~55 ℃结果吻合[11,13,25]。且组织蛋白酶L 的热稳定性随温度升高急剧下降,在50℃保温1 h 时活性仍保留50%以上,而78 ℃下保温1 h 后几乎无活性,该结果表明组织蛋白酶L有一定的耐热性。
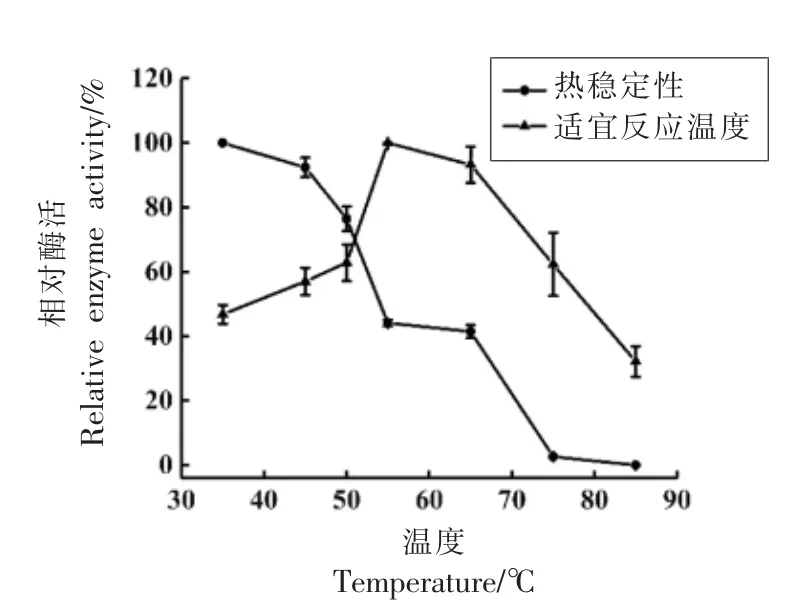
图7 组织蛋白酶L 的温度-相对酶活曲线Fig.7 Temperature-relative enzyme activity curve of cathepsin L
2.4.2 最适反应pH 值和pH 值稳定性 由图8可知,鲢鱼组织蛋白酶L 的最适反应pH 值为5~5.5。酸性条件下其活性有所保持,其中pH 3.0 时仍然保持了45%的活性。碱性条件下此酶的活性急剧下降,在pH 7.0 时仍有20%左右的活性,在pH 8.0 时几乎失活,表明此酶是偏酸性蛋白酶。
2.4.3 底物专一性和反应动力学常数 经测定,白鲢的组织蛋白酶L 对其专一性荧光底物ZPhe-Arg-MCA 有较强的水解活性,对组织蛋白酶B 和组织蛋白酶H 的专一性荧光底物几乎没有水解活性,由其反应动力学曲线(图9)和米氏方程双倒数曲线(图10)可知其最大反应初速度达到130 U/mg,Km值为49 μmol/L。

图9 组织蛋白酶L 水解Z-Phe-Arg-MCA 的反应动力学曲线Fig.9 Kinetic curves of the hydrolysis of Z-Phe-Arg-MCA by cathepsin L

图10 组织蛋白酶L 水解Z-Phe-Arg-MCA 的双倒数曲线Fig.10 Double reciprocal curve of hydrolyzing Z-Phe-Arg-MCA by cathepsin L
3 结论
本研究对白鲢中组织蛋白酶L 的粗分离和纯化方法进行了优化,重点研究了初步提取过程中硫酸铵饱和度、酸处理条件和透析袋分子质量对粗酶液中组织蛋白酶L 活性的影响,以及纯化过程中不同类型离子交换层析柱和离子交换平衡缓冲液pH 值对蛋白层析纯化结果的影响。结果表明,盐析最佳硫酸铵饱和度范围是55%~90%、酸处理最优条件为pH 3.0,40 ℃热处理10 min 后回调至pH 6.0、透析袋最佳分子质量为7 000 u,以上试验条件可以最大限度回收目的蛋白。采用弱阴离子交换和分子筛两步层析法,选取20 mmol/L、pH 6.0 磷酸盐缓冲液作为弱阴离子柱的平衡缓冲液可得到45 ku 电泳纯组织蛋白酶,其纯化倍数为487,回收率为22 mg/1 000 g。两步层析法较一步离子交换层析法纯化倍数更高,较四步组合层析法回收率更高且简单省时。本法的建立为探究鱼糜凝胶劣化现象的有效抑制方法奠定了良好的基础。
