抑制嗜水气单胞菌乳酸菌的筛选、鉴定及抑菌作用
2022-04-11江宇航辛维岗徐美余杨瑞思张棋麟林连兵
江宇航, 辛维岗, 徐美余, 杨瑞思, 张棋麟*, 林连兵*
(1.昆明理工大学 生命科学与技术学院,云南 昆明 650500;2.云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500)
嗜水气单胞菌(Aeromonashydrophila)广泛分布于淡水、海洋和河口等水生环境中,是我国最为广泛流行的一种典型人-畜-水生动物共患病原菌[1-2]。当淡水鱼类感染嗜水气单胞菌后易出现暴发性出血病,主要表现为头部、腹部等部位充血,无食欲,漂浮于水面上等现象,致死率极高[2]。然而我国目前针对鱼类养殖过程中防治嗜水气单胞菌引发的病害仍主要以抗生素和化学药物等进行防控[3],虽然在短期内能够取得一定的疗效,但长期使用会造成药物残留和耐药性细菌形成等问题,使防治嗜水气单胞菌引发的相关疾病变得更加困难[3-4]。此外,目前农业农村部在《兽用抗菌药使用减量化行动试点工作方案(2018-2021年)》中也明确指出,2020年7月1日起,全面退出抗生素在饲料端的使用[5]。因此,急需找到一种有效替代抗生素应用于防治嗜水气单胞菌引发的鱼类疾病。乳酸菌属(Lactobacillus)细菌在食品生产、畜牧和鱼类养殖等领域应用广泛,具有安全、可靠、性能优良等特点[6-7]。近年来,随着对乳酸菌属细菌的深入研究,诸多学者发现部分乳酸菌属细菌能够产生对一种或多种致病性细菌表现良好的抗菌活性物质[8-9]。例如,李宏伟等[9]筛选到的植物乳杆菌(Lactobacillusplantarum)L2和短乳杆菌(Lactobacillusbrevis)L4,均对猪霍乱沙门氏菌(Salmonellacholeraesuis)表现出良好的抑菌效果,并能够广谱抑制大肠埃希菌(Escherichiacoli)、无乳链球菌(Streptococcusagalactiae)等多种致病性细菌。同时,乳酸菌属的部分细菌产生的抗菌活性物质具有安全、高效、无残留、无耐药性等特点,表现出良好的替抗潜力[7,9]。然而,目前虽已挖掘得到了部分抑制致病性细菌的乳酸菌属细菌资源,但针对抑制鱼类重要病原菌嗜水气单胞菌的乳酸菌属细菌资源较为匮乏,特别是来源于鱼类肠道中的拮抗嗜水气单胞菌乳酸菌资源[1-2]。因此,本研究从尼罗罗非鱼(Oreochromisniloticus)肠道中挖掘、鉴定抑制嗜水气单胞菌的乳酸菌菌种,测定其抑菌活性,热、酸碱稳定性及扫描电镜观察抑制后的嗜水气单胞菌显微形态变化,为鱼类肠道乳酸菌应用于防治鱼类疾病提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 乳酸菌(Lactobacillus)分离自健康尼罗罗非鱼(Oreochromisniloticus)(由云南省高校饲用抗生素替代技术工程研究中心实验养殖基地饲喂提供)肠道;嗜水气单胞菌(Aeromonashydrophila)分离自非正常死亡尼罗罗非鱼肠道,该菌株由云南省高校饲用抗生素替代技术工程研究中心提供。
1.1.2 培养基 MRS培养基、LB培养基。
1.1.3 试剂与仪器 盐酸、氢氧化钠、胃蛋白酶、胰蛋白酶、蛋白酶 K和过氧化氢酶,购自上海源叶生物科技有限公司;0.22 μm滤膜、细菌基因组DNA提取试剂盒、PCR试剂和引物,购自生工生物工程(上海)股份有限公司。低温离心机(CF16RXII,Eppendorf公司);体式显微镜(SZ61,奥林巴斯股份有限公司);落地式超净工作台(SW-CJ-2F,上海苏坤实业有限公司);恒温培养箱(MIRH163P,三洋电器股份有限公司); pH计(PHSJ-3F,上海仪电科学仪器股份有限公司);高分辨冷场发射扫描电子显微镜(SM8010,日立(Hitachi)有限公司)。
1.2 方法
1.2.1 尼罗罗非鱼肠道乳酸菌的分离和纯化 取健康成年尼罗罗非鱼5条,解剖镜下收集肠道,置于装有500 μL无菌水(ddH2O)的 1.5 mL已灭菌EP管中,研磨棒研磨匀浆,ddH2O补至 1.0 mL。然后用ddH2O梯度稀释至10-3、10-5、10-7,取各梯度稀释液100 μL涂布于含5%(质量分数)CaCO3的MRS固体培养基上,37 ℃恒温培养24 h后[10],挑取具有透明溶钙圈的单菌落,在含5%的CaCO3MRS固体培养基上划线纯化。将产生溶钙圈的单菌落进行革兰染色,初步确定呈阳性的菌株为乳酸菌[9],编号并保存于4 ℃冰箱备用。
1.2.2 抑制嗜水气单胞菌的乳酸菌筛选 利用牛津杯双层平板法筛选对嗜水气单胞菌具有抑制作用的乳酸菌。以LB 固体培养基和100 μL嗜水气单胞菌(107cfu/mL)与4 mL LB半固体培养基混合液配制成LB双层平板。待其凝固后,用无菌镊子夹取无菌牛津杯(直径8 mm)置于双层平板上。向上述牛津杯中加入经过12 000 r/min离心10 min收集得到的上清液,并通过0.22 μm滤膜过滤后的200 μL乳酸菌无细胞培养液,于4 ℃ 冰箱中静置4~6 h,使其充分扩散后,37 ℃ 恒温培养12 h,观察记录抑菌圈直径[6,9]。以灭活后的乳酸菌无细胞培养液作为对照,实验重复3次。
1.2.3 抑制嗜水气单胞菌的乳酸菌鉴定 抑制嗜水气单胞菌的乳酸菌鉴定,严格按照细菌基因组DNA提取试剂盒的操作步骤进行。将获得的细菌基因组DNA作为模板,选择两条通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和 1492R (5′-TACGGYTACCTTGTTACGACTT-3′)对16S rRNA基因序列进行PCR扩增。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 50 s,30个循环;72 ℃ 10 min[9]。PCR 扩增产物经1.5%的琼脂糖电泳检测后,送至生工生物工程(上海)股份有限公司进行Sanger测序。测序结果提交至GenBank数据库,采用BLAST在线服务器与细菌数据库进行比对后,选取得分最高、序列一致性在99%以上的已知细菌种类确定为目标物种。
1.2.4 抑制嗜水气单胞菌的抑菌成分确定 将抑菌活性最佳菌株的无细胞培养液,按以下处理进行抑制嗜水气单胞菌的抑菌成分确定。①有机酸的排除:用乳酸调节MRS液体培养基至与无细胞培养液pH相同的液体作为实验组;②过氧化氢的排除:用乳酸调节乳酸菌无细胞培养液pH至7.0,加入终浓度为0.5 mg/mL的过氧化氢酶,37 ℃恒温水浴处理2 h后,作为实验组;③蛋白酶敏感性测定:分别向乳酸菌无细胞培养液中加入终浓度为1 mg/mL的不同蛋白酶溶液(胃蛋白酶、胰蛋白酶和蛋白酶K), 37 ℃恒温水浴 2 h后,80 ℃恒温水浴2 min使酶变性失活,作为实验组。以上试验均利用牛津杯双层平板法检测抑菌活性,均以无处理的乳酸菌无细胞培养液作为对照,实验重复3次。
1.2.5 抑制嗜水气单胞菌的抑菌作用分析 ①将抑菌活性最佳菌株的无细胞培养液按以下处理进行热、酸碱稳定性测定:37、60、80、100 ℃恒温水浴30 min,自然冷却至室温;以1 mol/L的HCl或NaOH溶液调节pH 为 2.0、4.0、6.0、8.0、10.0、12.0,37 ℃恒温水浴2 h 后,调回pH至6.5[10]。采用牛津杯双层平板法检测抑菌活性,以无处理的乳酸菌无细胞培养液作为对照,实验重复3次。②扫描电子显微镜(SEM)观察:将嗜水气单胞菌活化至对数期(107cfu/mL),取2 mL 3 500 r/min,4 ℃条件下离心5 min收集菌体,PBS缓冲液(pH 7.4)洗脱3次。实验组中加入100 μL乳酸菌无细胞培养液,对照组加入灭活后的乳酸菌无细胞培养液,分别于37 ℃反应1 h后,3 500 r/min离心5 min收集菌体,PBS 缓冲液(pH 7.4)洗脱3次。2 mL 2.5%的戊二醛固定样品6 h后,3 500 r/min离心10 min,收集菌体,PBS 缓冲液(pH 7.4)洗脱3次。再用1 mL 30%、50%、60%、70%、80%、90%的乙醇以及无水乙醇按次序分别梯度脱水1次,每次脱水20 min。将脱水后的菌体均匀涂布到10 mm×10 mm硅片上(反光面),自然干燥 24 h;最后,将含有菌体的硅片用双面胶固定到样品台上,按顺序放入离子溅射金仪器中250 s后取出,进行SEM观察[6-7]。
1.2.6 数据处理与分析 每个实验独立重复3 次,以平均值±标准差(SD)方式呈现。采用Microsoft Excel 2010及IBM SPSS 22.0软件对数据进行整理分析。采用Student′s t test进行数据对间显著性检验。
2 结果与分析
2.1 乳酸菌的分离和纯化
通过含有5%的碳酸钙MRS培养基筛选尼罗罗非鱼肠道乳酸菌,共获得12个具有明显溶钙圈的单菌落。进一步于MRS固体培养基平板上纯化后,得到生长旺盛、具有溶钙圈明显的乳白色、革兰阳性菌株,分别编号为菌株LX1~LX12。
2.2 具有抑制嗜水气单胞菌作用的乳酸菌筛选与鉴定
通过牛津杯法双层平板法检测尼罗罗非鱼肠道内筛选得到的12株备选菌株抑菌能力,结果显示,菌株LX3、LX7、LX8的无细胞培养液对嗜水气单胞菌具有明显的抑菌效果,抑菌圈直径依次为(25.25±0.23)(抑菌活性最佳)、(23.85±0.12)、(18.26±0.36) mm,均与对照(8.02±0.03) mm相比存在显著差异(P<0.05)(表1)。此外,将3株乳酸菌的16S rRNA基因序列提交到NCBI,选取相似性在99%以上的已知细菌种类比对发现,菌株LX3和LX7为植物乳杆菌,菌株LX8为唾液乳杆菌(表1)。

表1 抑制嗜水气单胞菌乳酸菌的分子鉴定及抑菌活性
2.3 抑制嗜水气单胞菌的抑菌成分分析
与乳酸菌无细胞培养液相同pH的乳酸和过氧化氢酶处理后的乳酸菌无细胞培养液分别进行抑制嗜水气单胞菌试验。结果显示,相同pH的乳酸与对照结果相似(P>0.05),未出现明显的抑菌效果,初步排除有机酸的干扰;经过氧化氢酶处理后的抑菌圈直径与对照相比,也未发生显著减小(P>0.05),初步排除了过氧化氢的干扰(表2)。此外,经蛋白酶 K、胰蛋白酶和胃蛋白酶等蛋白酶分别处理后,发现其抑菌圈直径均显著减小(P<0.05)(表2)。

表2 抑制嗜水气单胞菌的抑菌成分分析
2.4 抑制嗜水气单胞菌的酸碱、热稳定性分析
将菌株LX3的无细胞培养液经不同温度和pH处理后,分别对嗜水气单胞菌进行抑菌试验(图1)。结果显示,随着pH的增加抑菌圈直径逐渐减小,pH 8.0~12.0时,抑菌圈直径减小最为明显,由(19.58±0.21) mm减小至(13.87±0.12) mm,但与对照相比仍存在显著差异(P<0.05)(图1A)。同时,菌株LX3的抑菌物质活性受温度的影响,随着温度升高抑菌圈直径逐渐减小,80~100 ℃高温段减小最为明显,由(21.49±0.28) mm减小至(16.65±0.26) mm,但与对照相比也存在显著差异(P<0.05)(图1B)。
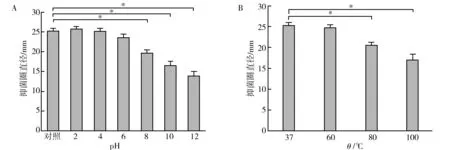
图1 抑制嗜水气单胞菌的酸碱(A)、热(B)稳定性Fig.1 Acid base (A) and heat (B) stability of inhibiting Aeromonas hydrophila*表示该组数据与对照组间存在显著差异(P<0.05)* There is a significant difference between the group data and the control group (P<0.05)
2.5 SEM观察嗜水气单胞菌细胞形态变化
利用菌株LX3的无细胞培养液处理嗜水气单胞菌1 h后,在SEM下观察菌体细胞形态变化(图2)。观察对照组发现,嗜水气单胞菌菌体细胞呈均匀的短杆状,表面光滑,边缘整齐,轮廓清晰,细胞结构完整丰满,为典型嗜水气单胞菌细胞形态(图2A)。观察实验组发现,处理后的嗜水气单胞菌,菌体细胞的内容物有明显溶出,菌体表面凹凸不平、褶皱明显,且大部分菌体细胞出现明显破裂(图2B)。
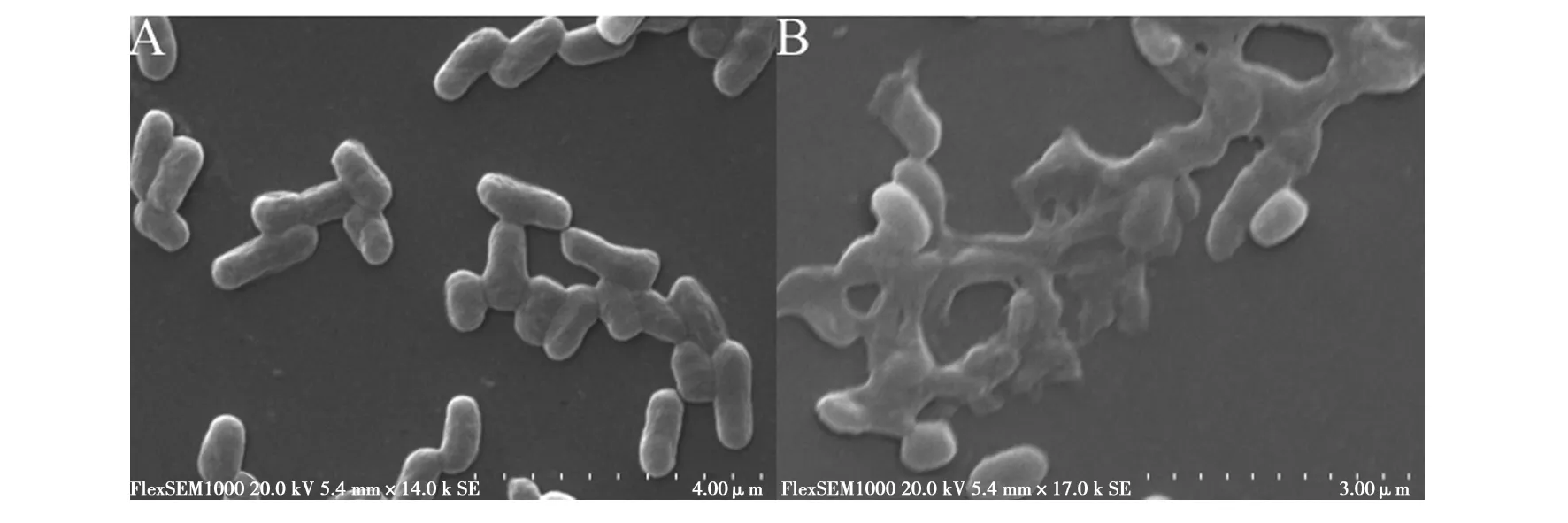
图2 SEM观察嗜水气单胞菌的显微形态变化
3 讨 论
乳酸菌作为重要的益生性菌,在食品健康、饲料工业及预防动物疾病等方面应用广泛[8,11]。本研究通过分离尼罗罗非鱼肠道内的乳酸菌,筛选获得了3株具有明显抑制嗜水气单胞菌的乳酸菌菌株,经过16S rRNA分子鉴定后发现3株乳酸菌菌株分别为植物乳杆菌(LX3、LX7)和唾液乳杆菌(LX8),这与以往研究中从其他鱼类肠道中分离获得的产抑菌活性乳酸菌菌种资源具有相似性[12-13]。值得注意的是,筛选获得的3株乳酸菌均对嗜水气单胞菌显示出了良好的抑菌活性,特别是菌株LX3的抑菌活性可达到(25.25±0.23) mm,远高于目前从发酵蔬菜[14]和腌渍蔬菜[15]等来源获得的乳酸菌对嗜水气单胞菌的抑菌活性的1.2~2倍。研究结果进一步证实了鱼类肠道中存在着具有高活性抑制嗜水气单胞菌的乳酸菌。此外,为进一步明确菌株LX3产生的抑菌活性物质,本研究在排除有机酸和过氧化氢干扰的基础上,将菌株LX3的无细胞培养液经过多种蛋白酶处理后,发现抑菌活性均出现不同程度的下降,表明由菌株LX3产生的抑菌活性物质对一种或多种供试蛋白酶敏感,为一类类蛋白物质[16]。乳酸菌产生的抑菌活性成分复杂,对于其确切的成分需要进一步采用质谱鉴定及SDS-PAGE蛋白胶等方法进一步确认。
乳酸菌抑菌活性物质作为抗生素替代品应用于饲料工业、畜牧和鱼类养殖过程中,其热、酸碱稳定性及抑菌机制等也是值得考虑的问题[17-18]。本研究将嗜水气单胞菌活性最佳菌株LX3的抑菌活性物质进行酸碱耐受性和热稳定性测试,结果发现,抑菌活性受碱和高温的影响,随着温度和pH的不断上升抑菌活性逐渐降低,这一结果与其他研究中乳酸菌的抑菌活性物质受到酸碱和高温影响的结果相似,这主要与乳酸菌产生的抑菌活性物质具有类蛋白性质有关[21-22]。尽管本研究中分离得到的菌株LX3产生的抑菌活性物质受到了碱和高温的影响,但相同处理条件下的残留抑菌活性与以往研究相比[14-15],显示出了较好的热稳定性和酸碱耐受能力。此外,为进一步明确乳酸菌抑菌活性物质如何有效抑制或杀灭嗜水气单胞菌,本研究通过SEM观察抑菌活性物质处理后的嗜水气单胞菌细胞形态变化,发现嗜水气单胞菌的菌体细胞破裂、细胞的内溶物溶出,表明乳酸菌产生的抑菌活性物质促使嗜水气单胞菌菌体发生了裂解、导致其细胞死亡[16,22]。因此,本研究结果证实了尼罗罗非鱼肠道中筛选得到的乳酸菌能够有效抑制和杀灭嗜水气单胞菌,具有良好的防治嗜水气单胞菌的应用潜力。
目前,畜牧和鱼类养殖正朝着无抗化养殖的方向发展。本研究筛选到的多株能够有效抑制嗜水气单胞菌的乳酸菌,尤其是菌株LX3显示出了良好的抑菌活性和抑菌特性,能够有效破坏嗜水气单胞菌的细胞结构使其发生裂解死亡。但在实际生产应用时,乳酸菌等潜在益生菌资源的安全性及益生性评价是必不可少的,而本研究旨在筛选具有抑制嗜水气单胞菌的乳酸菌菌株,并进行体外抑菌作用评估,以获得具有良好抑菌特性的乳酸菌菌种资源。因此,未来为了更好地将尼罗罗非鱼肠道乳酸菌应用于畜牧和鱼类养殖中,还将对筛选获得的高抑菌活性菌株进行安全性和益生性评价,为降低嗜水气单胞菌引起的食物中毒风险和畜牧及鱼类无抗化养殖等方面提供有价值的益生性乳酸菌菌种。此外,未来还将对获得的抑制嗜水气单胞菌乳酸菌资源展开相关致病菌攻毒试验治疗研究,以更好地将乳酸菌菌种资源实际应用于预防和治疗嗜水气单胞菌相关的鱼类疾病。