集体细胞迁移的研究模型和分子机制研究
2022-04-11雷风云万萍
雷风云 万萍

摘要 集体细胞迁移在大多数生物体的发育过程中起着关键作用。要实现高效且协调的迁移行为,细胞需要整体的细胞骨架调控来产生整体极化的牵引力。研究表明,胞外引导信号的浓度梯度或细胞与胞外基质的相互作用参与诱导极性的产生和起始迁移。集体迁移的细胞间存在相互作用,且这种细胞间的交流对于协调迁移至关重要。基于此,综述不同模式生物发育过程中的集体细胞迁移研究模型和分子机制,以期为相关研究提供借鉴。
关键词 集体细胞迁移;细胞骨架;信号;诱导;协调
中图分类号 Q 2 文献标识码 A 文章编号 0517-6611(2022)06-0012-04
doi:10.3969/j.issn.0517-6611.2022.06.003
开放科学(资源服务)标识码(OSID):
Study on Research Models and Molecular Mechanisms of Collective Cell Migration
LEI Feng-yun,WAN Ping
(College of Life Science,Jiangxi Science and Technology Normal University,Nanchang,Jiangxi 330013)
Abstract Collective cell migration plays a key role during the development of most organisms. To display a coordinated migratory behavior and move more efficiently than cells migrated separately, collectively migrating cells need polarized force and cytoskeletal organization. Studies indicate that external signals, including gradients of signaling molecules and interactions with extra cellular matrix (ECM), induce F-actin polarity and start the migration. Cellular interplay occurs during collective cell migration, and such intercellular communication is essential to coordinated migration. Based on this, the research models and molecular mechanisms of collective cell migration in the development of different model organisms are reviewed in order to provide reference for related research.
Key words Collective cell migration;Cytoskeletal organization;Signals;Induce;Coordinate
基金项目 国家自然科学基金项目(31660330);江西科技师范大学博士启动基金项目。
作者简介 雷风云(1998—),女,河南周口人,硕士,从事细胞迁移研究。*通信作者,讲师,博士,硕士生导师,从事细胞迁移研究。
收稿日期 2021-10-14
集体细胞迁移(collective cell migration)是指多个细胞黏附在一起成为细胞簇或细胞层进行协同性迁移,这在发育、生理和疾病中非常普遍,例如乳腺上皮层分叉(branching morphogenesis)、血管新生(vascular sprouting)、肿瘤细胞聚成一股入侵周边组织等都涉及这一迁移[1-2]。集体细胞迁移是相互依存的细胞共同迁移,而不是简单地集合单细胞迁移,选择集体细胞迁移,其主要原因是因为集体细胞迁移可以:允许移动细胞携带其他不移动的细胞类型;允许迁移细胞相互影响,从而形成适当的细胞分布和组织;重塑组织的结构,同时保持它的完整和连续等。
单细胞迁移已经有了广泛的研究,其机制相对清楚。单细胞迁移过程可以简单描述如下:细胞迁移前端由肌动蛋白(actin)聚合形成片伪足或丝状伪足,细胞需要黏附和牵引在基底上,由整联蛋白(integrin)形成的黏着斑或与细胞外基质(extra cellular matrix,ECM)的其他作用支持。如果基底是其他细胞,那么细胞黏附分子(cell adhesion)將支持黏附和牵引。最后,细胞需要动力拉动细胞体向前和后端缩进,通常由肌动蛋白和肌球蛋白(myosin)支持向前和缩进。由此可见,单细胞迁移需在细胞前后极性形成的基础上完成[3]。Rho家族小GTP酶参与单细胞迁移前后端极性的建立,在迁移前端,Cdc42和Rac(Ras-related C3 botulinum toxin substrate)促使细胞加速肌动蛋白聚合形成片伪足或丝状伪足;在迁移后端,Rho促进细胞的缩进[4]。集体细胞迁移过程也需要形成前后极性,与单细胞迁移不同的是其形成的是整体的前后极性,而非单个细胞[5]。集体迁移的细胞之间存在相互作用,达到协同迁移的目的。集体细胞迁移在大多数生物体的发育过程中起着关键作用,参与成体的伤口愈合、组织再生和癌症扩散等过程。要实现高效且协调的迁移行为,细胞需要整体的细胞骨架调控来产生整体极化牵引力。该研究在介绍集体细胞迁移的经典研究模型的基础上,介绍集体细胞迁移的形成机制,以期为相关研究提供借鉴。
1 集体细胞迁移的研究模型
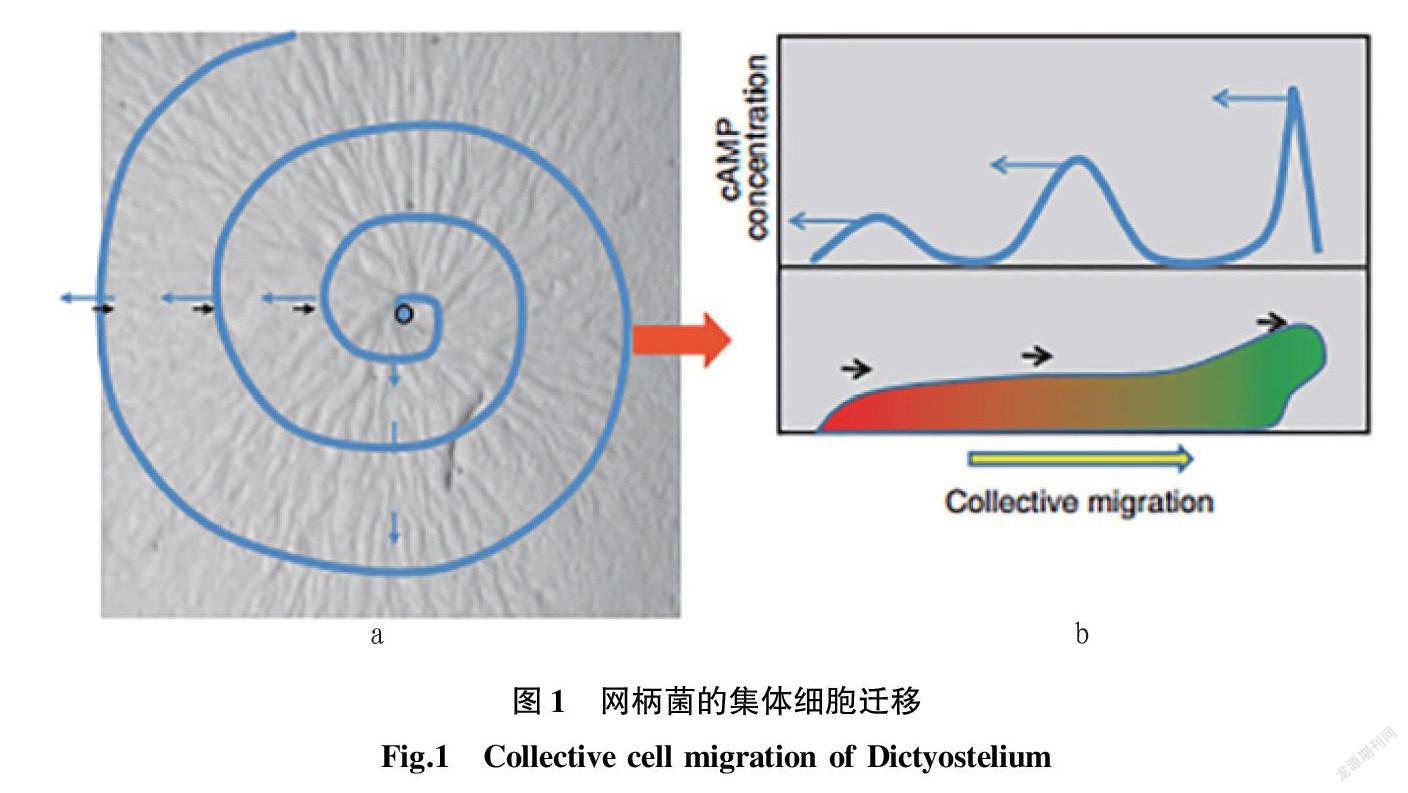
1.1 网柄菌( Dictyostelium )的迁移 网柄菌是很好的研究细胞极化和趋化运动的模式生物,属于简单的真核微生物,同时也会进行非常有趣的集体细胞迁移(图1)[6]。
网柄菌的集体细胞迁移受环腺苷酸小分子(cAMP)波控制。由图1a可知,在饥饿状态下,信号中心的细胞分泌cAMP呈螺旋波状扩散(蓝色线),细胞沿cAMP梯度移动(黑色箭头)并在信号中心发生聚集。由图1b可知,在蛞蝓状态下,前区的细胞负责周期性分泌cAMP信号(绿色表示信号最活跃区)并向后梯度传递(蓝色箭头),细胞则向前迁移(黑色箭头)。
网柄菌生活在含丰富有机物的土壤中。通常,网柄菌呈现阿米巴原虫的外形和生活方式。只有当营养供给耗尽时,成百上千的网柄菌就向周围发送信号——cAMP,收到信号的细胞也向其周围发送同样的信号,在一片互相收发的信号背景中,自发形成一个聚集中心。大量网柄菌聚集后,形成一个多细胞的集群进行迁移。当迁移到合适的环境时,多细胞集群变成子实体并形成孢子。网柄菌多细胞阶段的迁移与高等动物中的集体细胞迁移非常相似,细胞既紧密相连又动态变化地朝着引导信号协同迁移[7-9]。
网柄菌的协同迁移由cAMP波调控。当网柄菌处于饥饿状态时,cAMP波由信号中心发出并主要以螺旋波的形式向外扩散。细胞沿着cAMP的浓度梯度移动并最终聚集在信号中心。在蛞蝓移动阶段,前顶端细胞周期性地产生cAMP信号,分散在蛞蝓全身的前端类似细胞同时接力产生cAMP信号,这样从蛞蝓的前端到后端产生cAMP信号的周期波,从而促使蛞蝓移动[8]。cAMP对单个细胞的刺激导致细胞内产生三磷酸磷脂酰肌醇(PIP3),它是聚集期趋化和cAMP传递的关键信号分子[10-11]。PI3K和PTEN分别催化PIP3的产生和降解,可在质膜上沿cAMP生成PIP3富集区梯度。此外,PIP3还调节腺苷酸环化酶的胞浆调节因子CRAC,CRAC是cAMP接力所必需的[12]。
1.2 果蝇边界细胞迁移
近20年来,果蝇卵巢里的边界细胞在细胞迁移领域被公认为是一个很好的研究集体迁移的模式系统(图2)[13-14]。果蝇的卵巢主要由卵室(egg chamber)排列成的卵巢管(ovariole)构成。每个卵室有1个卵母细胞(oocyte)、15个滋卵细胞(nurse cells)以及外围包裹着的滤泡细胞上皮层(follicle epithelium)。边界细胞是由6~10个滤泡细胞组成的一簇细胞,形成于卵室的最前端滤泡细胞上皮层。
果蝇的卵室模型由滤泡细胞上皮层包裹着1个卵母细胞和15个滋养细胞组成。其中极细胞(紫色)和边界细胞(绿色)在第八期发生特化(图2a),极细胞和边界细胞在第九期脱离滤泡细胞层并发生迁移(图2b),边界细胞簇在第十期到达卵母细胞边缘(图2c)。
在卵子发生的第九期初,边界细胞开始从它们所在的上皮层分离,侵入滋卵细胞组织,并且在其中持续向卵室后端进行协同迁移,到第十期初,这一簇细胞总共向后迁移约150 μm,到达滋卵细胞和卵母细胞的边界处,最后参与形成精子入卵口,因此被命名为边界细胞(border cell)。边界细胞在组织中的迁移运动利用卵子分泌的PVF1(PDGF-and VEGF-related factor 1)和EGF(epithelial growth factor)等生长因子的浓度梯度作为引导信号[15-16]。边界细胞来源于上皮细胞,启动迁移的过程属于上皮细胞间质转型(epithelial-mesenchymal transition,EMT)。在迁移过程中,边界细胞也保持着上皮细胞的特性,具有顶端-基底端极性(apical-basal polarity)。目前认为,边界细胞簇主要依赖其表面钙黏蛋白(E-cadherin)与滋卵细胞表面的E-cadherin建立起细胞黏着后,才能延伸片伪足并迁移[17]。
1.3 斑马鱼侧线原基迁移
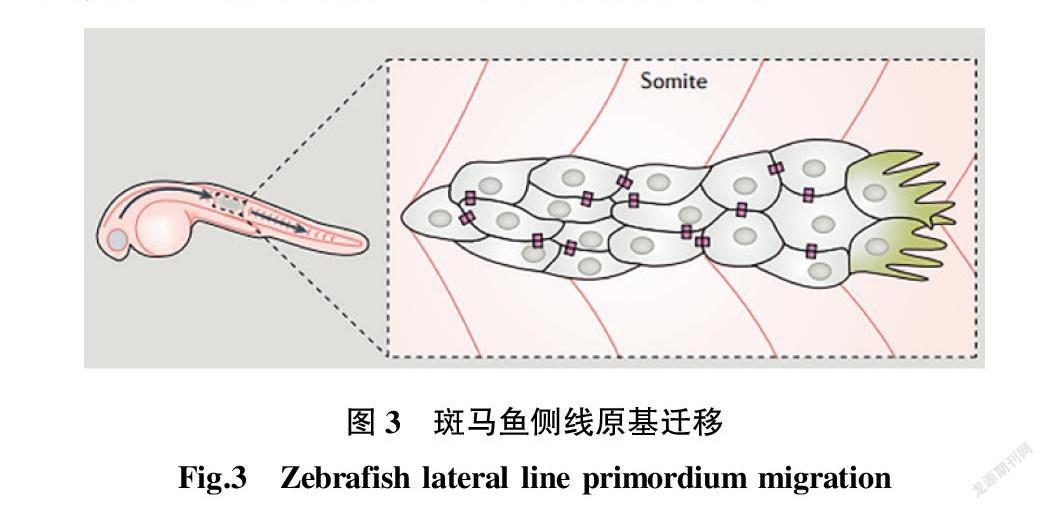
侧线是鱼特有的感觉器官。斑马鱼侧线的发育需要经历约100个上皮类似细胞在胚胎的肌肉组织上定向迁移(图3)[18],这些细胞被称为侧线原基(lateral line primordium,LLP)。
由图3可知,斑马鱼侧线的原基是由100多个细胞组成的致密上皮细胞簇,细胞簇在趋化因子SDF-1梯度引导下定向迁移,从胚胎的头部迁移到尾部。
在超过2 d的迁移过程中,LLP有规律地每间隔一段距离形成一个感觉神经丘[19]。LLP由斑马鱼胚胎水平膈肌(horizontal myoseptum)中的细胞分泌的趋化因子SDF-1(stromal-derived factor 1)引导迁移。LLP前端的细胞需要表达SDF-1受体CXCR4(CXC chemokine Receptor 4)来接收趋化因子的诱导[20]。这些细胞向趋化信号SDF1的方向延伸突起,进而启动迁移。研究表明,LLP细胞还表达另一个SDF1受体CXCR7,这个受体主要在后端细胞表达。除去CXCR7也会阻止迁移,表明CXCR7与CXCR4一起调控LLP迁移[21]。两个信号通路调控CXCR4和CXCR7在LLP中的表达,Wnt信号在LLP前端起作用,而FGF(fibroblast growth factor)信号在后端起作用。Wnt信号抑制CXCR7在前端表达,而FGF信号抑制CXCR4在后端表达[22]。
1.4 肿瘤的侵袭转移
在癌转移过程中,癌细胞需要从一个组织扩散到另一个组织。扩散细胞常成片、成股、成团或者成网状迁移,这些都属于集体细胞迁移[23]。这种协同转移在上皮癌中尤其普遍,例如乳腺癌、鳞状细胞癌和结肠癌的癌细胞基本上都是通过集体细胞迁移形式转移扩散[24]。很多癌细胞在体外试验中也表现出集体细胞迁移,例如横纹肌肉瘤、口腔鳞状细胞癌、大肠癌、黑素瘤和乳腺癌[25]。对病人和小鼠模型的组织检测,也都观察到了癌细胞的集体细胞迁移[26]。然而,虽然集体细胞迁移在许多癌症中很普遍,但是由于癌症是一个缓慢发展的长期过程,不容易对癌细胞的迁移进行直接观察,因此,癌集体细胞迁移的分子机制没有正常生理过程中的集體细胞迁移研究得清楚。
除此之外,哺乳动物的血管分生、果蝇的气管分生、爪蟾的神经嵴发育和体外的伤口愈合试验等均是很好的研究集体细胞迁移的模型[27]。
2 集体细胞迁移前后极性的形成
2.1 引导信号的诱导
在体内,集体细胞迁移通常由趋化因子或者生长因子诱导,例如血管内皮生长因子(VEGFs)可以驱动血管内皮细胞的集体迁移,碱性成纤维细胞生长因子(bFGF)也有助于血管内皮集体细胞迁移[28]。在集体细胞迁移中,位于细胞簇迁移方向前端的细胞被称为领导细胞(leader cell)。领导细胞在感受环境中的可溶性因子进而促使整个细胞簇的趋化运动方面起关键作用。这些细胞接收外界的引导信号,并且指示整个细胞簇的迁移方向和速度。被领导细胞指挥迁移的其他细胞被称为追随细胞(follow cell)。成为领导细胞还是追随细胞由细胞在细胞簇中的位置决定。由于位置原因,领导细胞可以接收到更强的外界引导信号,进而向前形成伪足启动迁移。在领导细胞后方,追随细胞因为团在一起不能向前形成伪足。在斑马鱼侧线原基迁移中,在领导细胞中表达趋化因子受体CXCR4,就可以接收趋化因子SDF-1的信号,进而驱动集体细胞迁移[16]。
引导信号主要通过两种方式促进集体细胞迁移。第一,形成前端伪足。大部分可溶性因子通过磷酸肌醇途径激活Cdc42和Rac,进而促进肌动蛋白聚合形成伪足[29]。但是在斑马鱼侧线原基中,SDF-1与CXCR4结合后,通过异三聚体G蛋白亚基Gβ1,促使肌动蛋白聚合形成伪足[30]。第二,通过信号通路调控基因表达,从而加强领导细胞的特性。在果蝇气管细胞中,FGF促进MAPK的激活,进而上调自己的受体。FGF受体(FGFR)的增加会上调领导细胞中的Delta1,Delta1作用于追随细胞膜上的Notch而抑制这些细胞中的FGFR-MAPK信号通路,从而加强领导细胞的特性[31]。在果蝇边界细胞迁移中,细胞簇接收引导信号后,位于前端的领导细胞较后端的追随细胞激活更强的RTK(receptor tyrosine kinase)信号通路。该信号通路通过Rac增强Rab11和exocyst介导的囊泡运输,使更多的RTK受体被运输至前端,正反馈地加强RTK信号通路,从而更利于形成前后极性[32]。
2.2 细胞与ECM的相互作用
细胞与ECM相互作用产生迁移极性主要是通过整联蛋白。体外的伤口愈合试验证明,在伤口边缘细胞会与ECM形成新的作用,这些作用会激活整联蛋白介导的信号通路,进而引起细胞骨架重排、细胞结构的改变和形态的极化,使细胞具有领导细胞的特征[33]。参与集体细胞迁移的整联蛋白二聚体种类由细胞类型和细胞基底决定,内皮细胞、表皮细胞和星型胶质细胞都是用β1整联蛋白二聚体。整联蛋白参与和ECM的相互作用后,通过接头蛋白(cortactin、paxilin、talin、vinculin)、鸟嘌呤转移酶(GEFs)及胞内激酶(FAK和SRC)激活Cdc42和Rac。 Cdc42和Rac活化后,促使diaphanous 2(DIA2)和IRSp53(insulin receptor Tyr Kinase substrate p53)连接Rac至肌动蛋白成核因子(actin nucleator)WAVE 和 VASP一类蛋白,使前端细胞膜附近肌动蛋白细胞骨架聚合,为形成伪足提供推动力[34]。Cdc42和Rac也会促进微管网络和胞内囊泡运输的极化,从而增加细胞前端的细胞膜面积和细胞膜受体,这种胞内极化再由于正反馈作用进一步形成稳定的极化[35]。
另外,引导信号通路和整联蛋白信号通路间存在重要的关联。 VEGF和bFGF通过调控整联蛋白表达或者FAK磷酸化影响整联蛋白信号通路[36]。由于集体迁移需要细胞黏附于ECM,所以引导信号与整联蛋白的相互作用非常重要。在网柄菌向cAMP的运动中,在涂有聚乙二醇的表面,细胞不能和基底相互作用也就不能移动[37]。相反地,整联蛋白信号通常可以加强生长因子受体活性[38]。在胰腺癌细胞中表达整联蛋白α6β4会通过促进肝生长因子(HGF)激活Rac1,从而增加肿瘤的扩散和转移[39]。
3 集体细胞迁移的细胞间相互作用
集体细胞迁移是多个细胞的协同迁移,需要细胞间相互作用来传递信号和机械力,从而做到集体迁移。两个细胞间如果紧密连接,将机械地偶联在一起,如果运动也将协同地运动。细胞间黏连由黏合连接蛋白介导,包括钙黏蛋白(cadherins)、免疫球蛋白家族成员和整联蛋白。这些蛋白直接或间接调控肌动蛋白细胞骨架,因此既能提供有力的机械支撑又能调控动态的运动。很多协同迁移的细胞来源于上皮细胞,因此保留了钙黏蛋白连接,例如黏合连接(adherens junction)[40]。细胞间的钙黏蛋白连接可以快速重塑,从而允许细胞簇中的细胞改变位置。在上皮形成、细胞基底接触和血管生成中,细胞分别是通过E-cadherin、N-cadherin和VE-cadherin介导黏着连接,且偶联肌动蛋白细胞骨架。在形态发生和癌症模型中,均有发现缺失E-cadherin会使细胞黏连减弱,从而导致细胞脱离和产生单细胞迁移[41]。
除了细胞黏连,细胞还能通过信号传递影响彼此。信号传递不一定需要直接的细胞接触,分泌型分子也可以有效地整体组织细胞的协同性,例如cAMP诱导的网柄菌迁移[5],FGF和WNT调控斑马鱼侧线原基的极化都不要求直接的细胞接触[18]。
细胞间除了团结还有竞争。有时,领导细胞的领导地位会受到挑战,例如,在果蝇气管分生过程中,领导细胞保持不变[42];而果蝇的边界细胞迁移过程中,常常更换领导细胞[43]。领导地位的更换需要通过细胞间不断的相互作用得以实现,在以果蝇边界细胞迁移为模型的研究中有不少发现。研究表明,Rac的活性在边界细胞簇中具有明显的前后极性,且在单个边界细胞中激活Rac可以诱导其具有领导细胞特征。在边界细胞簇中,领导细胞旁边的追随细胞会限制Rac只在领导细胞中活化[44-45]。有研究发现,Rab11和Moesin参与限制追随细胞中Rac的活化,虽然机制还不清楚,但基本上认同这需要细胞間的相互作用[46]。
4 展望
集體细胞迁移最终需要细胞调控肌动蛋白细胞骨架的解聚来产生迁移的动力。这种肌动蛋白细胞骨架的调控具有超细胞的协同性,例如前端的片伪足形成于一些细胞,后端收缩也涉及一些细胞,均不局限于单个细胞。虽然这种超细胞的肌动蛋白细胞骨架调控需要外界信号和细胞簇内细胞黏连分子的联合作用,但是具体产生机制并不清楚。因此,目前关于集体细胞迁移机制的研究主要聚焦于附近细胞或者周边ECM产生的外界信号整合成多细胞的协同迁移机制。随着活体显微成像技术(live imaging)的发展,一些原认为静止的组织被观察到具有动态变化。学者们预计该变化会涉及集体细胞迁移,因而对集体细胞迁移进行更多地观察研究,将为了解集体细胞迁移的分子机制提供途径。虽然不同的集体细胞迁移具有自己的特点和调控分子,但是肯定存在通用的机械理论,揭示集体细胞迁移中通用的机械理论有助于人们更多地了解一些发育、生理和疾病过程的分子机制。
参考文献
[1] LINTZ M,MUOZ A,REINHART-KING C A.The mechanics of single cell and collective migration of tumor cells[J].J Biomech Eng,2017,139(2):210051-210059.
[2] NORDEN C,LECAUDEY V.Collective cell migration:General themes and new paradigms[J].Curr Opin Genet Dev,2019,57:54-60.
[3] DE PASCALIS C,ETIENNE-MANNEVILLE S.Single and collective cell migration:The mechanics of adhesions[J].Mol Biol Cell,2017,28(14):1833-1846.
[4] POLLARD T D,COOPER J A.Actin,a central player in cell shape and movement[J].Science,2009,326(5957):1208-1212.
[5] JOSSIN Y.Molecular mechanisms of cell polarity in a range of model systems and in migrating neurons[J/OL].Mol Cell Neurosci,2020,106[2021-05-25].https://doi.org/10.1016/j.mcn.2020.103503.
[6] WEIJER C J.Collective cell migration in development[J].J Cell Sci,2009,122(Pt18):3215-3223.
[7] GREGOR T,FUJIMOTO K,MASAKI N,et al.The onset of collective behavior in social amoebae[J].Science,2010,328(5981):1021-1025.
[8] HASHIMURA H,MORIMOTO Y V,YASUI M,et al.Collective cell migration of Dictyostelium without cAMP oscillations at multicellular stages[J].Commun Biol,2019,2:1-15.
[9] FUJIMORI T,NAKAJIMA A,SHIMADA N,et al.Tissue self-organization based on collective cell migration by contact activation of locomotion and chemotaxis[J].Proc Natl Acad Sci USA,2019,116(10):4291-4296.
[10] DEVREOTES P N,BHATTACHARYA S,EDWARDS M,et al.Excitable signal transduction networks in directed cell migration[J].Annu Rev Cell Dev Biol,2017,33:103-125.
[11] PAL D S,LI X G,BANERJEE T,et al.The excitable signal transduction networks:Movers and shapers of eukaryotic cell migration[J].Int J Dev Biol,2019,63(8/9/10):407-416.
[12] COMER F I,LIPPINCOTT C K,MASBAD J J,et al.The PI3K-mediated activation of CRAC independently regulates adenylyl cyclase activation and chemotaxis[J].Curr Biol,2005,15(2):134-139.
[13] MONTELL D J.Border-cell migration:The race is on[J].Nat Rev Mol Cell Biol,2003,4(1):13-24.
[14] PEERCY B E,STARZ-GAIANO M.Clustered cell migration:Modeling the model system of Drosophila border cells[J].Semin Cell Dev Biol,2020,100:167-176.
[15] JANSSENS K,SUNG H H,RRTH P.Direct detection of guidance receptor activity during border cell migration[J].Proc Natl Acad Sci USA,2010,107(16):7323-7328.
[16] INAKI M,VISHNU S,CLIFFE A,et al.Effective guidance of collective migration based on differences in cell states[J].Proc Natl Acad Sci USA,2012,109(6):2027-2032.
[17] CAI D F,CHEN S C,PRASAD M,et al.Mechanical feedback through E-cadherin promotes direction sensing during collective cell migration[J].Cell,2014,157(5):1146-1159.
[18] MAYOR R,ETIENNE-MANNEVILLE S.The front and rear of collective cell migration[J].Nat Rev Mol Cell Biol,2016,17(2):97-109.
[19] OLSON H M,NECHIPORUK A V.Using zebrafish to study collective cell migration in development and disease[J].Front Cell Dev Biol,2018,6:1-15.
[20] WANG Y X,HAN Y C,XU P F,et al.prpf4 is essential for cell survival and posterior lateral line primordium migration in zebrafish[J].J Genet Genomics,2018,45(8):443-453.
[21] VALENTIN G,HAAS P,GILMOUR D.The chemokine SDF1a coordinates tissue migration through the spatially restricted activation of Cxcr7 and Cxcr4b[J].Curr Biol,2007,17(12):1026-1031.
[22] DALLE NOGARE D,CHITNIS A B.A framework for understanding morphogenesis and migration of the zebrafish posterior Lateral Line primordium[J].Mech Dev,2017,148:69-78.
[23] CHEUNG K J,EWALD A J.A collective route to metastasis:Seeding by tumor cell clusters[J].Science,2016,352(6282):167-169.
[24] LIU R C,SONG K N,HU Z J,et al.Diversity of collective migration patterns of invasive breast cancer cells emerging during microtrack invasion[J].Phys Rev E,2019,99:1-11.
[25] SANZ-DE-SANTA-MAR A I,CELADA L,CHIARA M D.The leader position of mesenchymal cells expressing N-cadherin in the collective migration of epithelial cancer[J].Cells,2020,9(3):1-18.
[26] BRONSERT P,ENDERLE-AMMOUR K,BADER M,et al.Cancer cell invasion and EMT marker expression:A three-dimensional study of the human cancer-host interface[J].J Pathol,2014,234(3):410-422.
[27] HAYASHI S,KONDO T.Development and function of the Drosophila tracheal system[J].Genetics,2018,209(2):367-380.
[28] LAMALICE L,LE BOEUF F,HUOT J.Endothelial cell migration during angiogenesis[J].Circ Res,2007,100(6):782-794.
[29] WU C Y,LIN M W,WU D C,et al.The role of phosphoinositide-regulated actin reorganization in chemotaxis and cell migration[J].Br J Pharmacol,2014,171(24):5541-5554.
[30] XU H,YE D,BEHRA M,et al.Gβ controls collective cell migration by regulating the protrusive activity of leader cells in the posterior lateral line primordium[J].Dev Biol,2014,385(2):316-327.
[31] BAGHDADI M B,FIRMINO J,SONI K,et al.Notch-induced miR-708 antagonizes satellite cell migration and maintains quiescence[J].Cell Stem Cell,2018,23(6):859-868.
[32] ZHU Z W,CHAI Y P,HU H F,et al.Spatial confinement of receptor activity by tyrosine phosphatase during directional cell migration[J].Proc Natl Acad Sci USA,2020,117(25):14270-14279.
[33] JANIK M E,LITYNSKA A,VEREECKEN P.Cell migration-the role of integrin glycosylation[J].Biochim Biophys Acta,2010,1800(6):545-555.
[34] ETIENNE-MANNEVILLE S,HALL A.Integrin-mediated activation of Cdc42 controls cell polarity in migrating astrocytes through PKCzeta[J].Cell,2001,106(4):489-498.
[35]KRAUSE M,GAUTREAU A.Steering cell migration:Lamellipodium dynamics and the regulation of directional persistence[J].Nat Rev Mol Cell Biol,2014,15(9):577-590.
[36] BYZOVA T V,GOLDMAN C K,PAMPORI N,et al.A mechanism for modulation of cellular responses to VEGF:Activation of the integrins[J].Mol Cell,2000,6(4):851-860.
[37] SOARES M A,TEIXEIRA F C O B,FONTES M,et al.Heparan sulfate proteoglycans may promote or inhibit cancer progression by interacting with integrins and affecting cell migration[J].Biomed Res Int,2015,2015:1-8.
[38] WANG C L,CHOWDHURY S,DRISCOLL M,et al.The interplay of cell-cell and cell-substrate adhesion in collective cell migration[J].J R Soc Interface,2014,11(100):1-10.
[39] CRUZ-MONSERRATE Z,OCONNOR K L.Integrin alpha 6 beta 4 promotes migration,invasion through Tiam1 upregulation,and subsequent Rac activation[J].Neoplasia,2008,10(5):408-417.
[40] LIN L Q,ZENG X W.Numerical investigation of the role of intercellular interactions on collective epithelial cell migration[J].Biomech Model Mechanobiol,2018,17(2):439-448.
[41] NIESSEN C M.Tight junctions/adherens junctions:Basic structure and function[J].J Invest Dermatol,2007,127(11):2525-2532.
[42] LEBRETON G,CASANOVA J.Ligand-binding and constitutive FGF receptors in single Drosophila tracheal cells:Implications for the role of FGF in collective migration[J].Dev Dyn,2016,245(3):372-378.
[43] LEBRETON G,CASANOVA J.Specification of leading and trailing cell features during collective migration in the Drosophila trachea[J].J Cell Sci,2014,127(Pt2):465-474.
[44] DAI W,MONTELL D J.Live imaging of border cell migration in Drosophila [J].Methods Mol Biol,2016,1407:153-168.
[45] WANG X B,HE L,WU Y I,et al.Light-mediated activation reveals a key role for Rac in collective guidance of cell movement in vivo [J].Nat Cell Biol,2010,12(6):591-597.
[46] RAMEL D,WANG X B,LAFLAMME C,et al.Rab11 regulates cell-cell communication during collective cell movements[J].Nat Cell Biol,2013,15(3):317-324.
