基于外壳蛋白基因的湖南烟草黄瓜花叶病毒遗传多样性分析
2022-04-04龚玉娟滕凯肖志鹏蔡海林周向平肖艳松刘天波唐前君
龚玉娟 滕凯 肖志鹏 蔡海林 周向平 肖艳松 刘天波 唐前君







摘要 为探明湖南烟草上发生的黄瓜花叶病毒Cucumber mosaic virus (CMV)的遗传多样性及分子进化特征,对来自湖南烟区的303份疑似感染病毒的烟草样品进行检测,分析CMV系统发育、遗传变异和群体结构等特征。结果表明:部分分离物的外壳蛋白(coat protein, CP)基因与NCBI上登录的CMV分离物的一致性为86.34%~98.42%;系统发育分析发现湖南烟草CMV分离物属ⅠB组,不同组间的分离物地理特征不明显,无重组现象,进化的主要驱动力是负选择;组间遗传变异比较明显,基因交流频率较低,受到遗传漂变影响,遗传多样性高,群体趋于扩张。研究结果为烟草抗CMV育种提供了理论依据,对病害防治具有重要意义。
关键词 烟草; 黄瓜花叶病毒; CP基因; 遗传多样性; 分子进化
中图分类号: S435.72
文献标识码: A
DOI: 10.16688/j.zwbh.2021061
Abstract In order to investigate the genetic diversity and molecular evolution of Cucumber mosaic virus (CMV) on tobacco in Hunan province, 303 suspected diseased samples from tobacco-growing areas in Hunan were detected, and the phylogeny, genetic variation and population structure of CMV were analyzed. The coat protein (CP) genes of some samples were cloned and compared with CMV isolates registered on NCBI. The results showed that the sequence of CP from Hunan isolates shared identity of 86.34%-98.42% with isolate from NCBI. Phylogenetic analysis showed that CMV isolates from Hunan tobacco plants belonged toⅠB group. The geographical characteristics of these isolates were not distinct among different populations, and there was no recombination phenomenon. The main driving force for evolution was negative selection. The genetic variation among groups was obvious; the frequency of gene flow was low; the genetic diversity was high, and the population tended to expand. These results provide a theoretical basis for breeding tobacco for disease resistance to CMV and are of great significance for disease control.
Key words tobacco; Cucumber mosaic virus; CP gene; genetic diversity; molecular evolution
黄瓜花叶病毒Cucumber mosaic virus (CMV)是严重危害植物的病毒之一,其侵染烟草引发的病毒病在烟草上普遍发生,严重威胁我国烟叶生产[12]。培育抗病毒品种被认为是最有效的方法之一[3],但因CMV受寄主和地域影响而变异较频繁,抗病品种抗性易减弱或丧失,使抗病育种难度加大。通过生物信息学技术和方法分析CMV不同分离物的遗传变异和分子进化,对抗CMV的品种选育和病害精准防控有重要意义。
CMV株系众多,寄主范围广泛,存在较显著的遗传多样性[4]。CMV基因组有3条正义单链的RNA分子,编码复制酶1a、2a、2b、移动蛋白(movement protein, MP)、外壳蛋白(coat protein, CP)[5]共5个蛋白。CMV CP基因序列保守性较高,常被应用于病毒遗传多样性研究[6]。
根据症状、寄主范围、致病性、抗原性、蚜传特性以及核苷酸序列同源性的差异,CMV株系被分为亚组 Ⅰ和亚组 Ⅱ,在亚组 Ⅰ内根据CMV RNA3的5′端和非编码区序列的比对结果,亚组Ⅰ进一步分为ⅠA和ⅠB[7]。
宋丽云[8]、刘勇等[9]鉴定分析了我国云南、湖南和福建等地CMV分离物,发现云南和湖南烟草CMV以亚组Ⅰ为主,存在较明显的遗传多样性。
赵雪君等[10]报道四川CMV分离物属亚组ⅠB。
随着产区调整、种植品种和耕作制度等变化,湖南烟草CMV群体变化和分子变异情况尚不清楚。因此,利用CMV CP基因序列开展群体遗传多样性和分子進化分析,探明CMV的遗传变异机制很有必要。本研究对湖南烟草中的CMV分离物CP基因进行RT-PCR扩增和测序,分析CMV分离物的遗传多样性和分子进化特征,以期为CMV株系鉴定和进化机制研究提供参考,为CMV的抗病育种和防治提供理论依据。
1 材料与方法
1.1 试验材料
样品采集:2017年-2018年从湖南郴州、永州、长沙等5个烟区采集表型为花叶、皱缩、畸形及脉坏死等症状的烟草叶片样品303份,样品经液氮速冻后于-80℃冰箱中保存备用。
主要试剂:RNA提取试剂盒(EasyPure Plant RNA Kit),购自TransGen Biotech公司;cDNA合成试剂盒、Taq DNA聚合酶、dNTPs购自北京全式金生物有限公司;其他常规试剂为国产分析纯,购自中国医药集团有限公司。
1.2 烟草总RNA的提取及检测
取烟草叶片样品1 g,使用RNA提取试剂盒提取总RNA,具体方法参照试剂盒说明书。以提取的总RNA为模板,反转录合成cDNA。用于RT-PCR扩增的引物[11]序列为CMVF: 5′-CGGATGCTAACTTTAGAGTCTTGT-3′和CMVR: 5′-GAATGCGTTGGTGCTCGAT-3′,由生工生物工程(上海)股份有限公司合成,目标片段长度约650 bp。PCR反应参照Liu等[12]的方法,反应体系(25 μL):10×buffer 2.5 μL,rTaq DNA聚合酶0.3 μL,10 mmol/L dNTPs 0.5 μL,10 μmol/L引物各0.5 μL,1 μmol/L模板DNA 0.5 μL,灭菌ddH2O补足至25 μL。扩增条件:95℃变性30 s,56℃退火50 s,72℃延伸110 s,30个循环;72℃延伸10 min。PCR扩增产物送生工生物工程(上海)股份有限公司测序,计算检出率。
1.3 重组分析
将获得的湖南烟草CMV分离物CP基因序列进行整理,先利用RDP 4.0[13]软件包中的MAXCHI、RDP、CHIMAERA等软件检测可能存在的重组位点,然后利用Simplot软件验证这些重组位点存在的可能性[14]。如检测结果P<1.0×10-6,则表明CMV分离物存在重组的可能;如P>1.0×10-6,则表明CMV分离物不存在重组[15]。
1.4 系统发育分析
将测序获得的阳性样品序列采用DNAMAN进行同源性比对。参照比对结果选取采自湖南不同地区、差异相对较大的11个样品,同时从NCBI上下载32个来源不同国家或地区的CMV分离物 CP基因序列进行系统发育分析,采用MEGA 5.0中的Clustal W软件进行序列比对,样品编号或登录号和来源地区或报道国家见表1。采用最大似然法构建系统进化树(自展值1 000),以与CMV同属的花生矮化病毒病Peanut stunt virus (PSV) 作为外群。依据Kimura two-parameter和DayhoffPAM 250 matrix计算分析核苷酸和氨基酸相似性[16]。
1.5 遗传差异和基因交流
利用DnaSP 5.0软件计算群体间遗传差异与基因交流频率。统计KS、Z和Snn 3个参数,Snn指近邻统计(nearest-neighbor statistic),计算两个或两个以上的地区样品近邻序列在相同地域的地理学空间上出现的频率;
Ks和Z是指以序列为基础的数据统计分析[17],
Ks由不同序列的数量所决定,Z是秩统计量(rank statistic)。如果Z和 KS统计值很小,P<0.05(两个亚群之间没有遗传分化),则拒绝无遗传差异的假说[18]。利用DnaSP 5.0 软件计算Fst和Nm,依据Fst和Nm大小评估基因交流情况,Fst是指群体间遗传差异的构成,表示群体间等位基因频率的标准差异;Nm是指有效大小的单个群体数量以及它们之间的迁移率。如果Fst的绝对值大于0.33,说明基因交流不频繁,反之,则交流频繁[19];如果Nm大于1则说明基因漂变在群体间很容易发生;如果Nm小于1,则说明群体发生遗传差异的主要原因是基因交流[20]。
1.6 选择压力分析
选择压力评价采用MEGA 5.0 中Pamilo-Bianchi-Li法,分别计算非同义突变(dN)和同义突变(dS)的值,利用dN/dS值预测各个基因所承受的选择压力[21]。若dN/dS=1则说明该组分离物处于中性选择;若dN/dS<1则说明该组分离物处于负选择压力作用下;若dN/dS>1则说明该组分离物处于正向选择作用下。
1.7 突变位点和保守区域分析
利用DnaSP 5.0 软件分析CMV CP基因突变位点和保守区域。
1.8 群体结构分析
群体结构利用核苷酸多样性与单体型多样性评价,采用DnaSP 5.0计算核苷酸多样性与单体型多样性的差异值[22]。核苷酸多样性差异值以0.005为临界值,单体型多样性差异值以0.5为临界值,二者的值越大,表示群体的多样性程度越高。
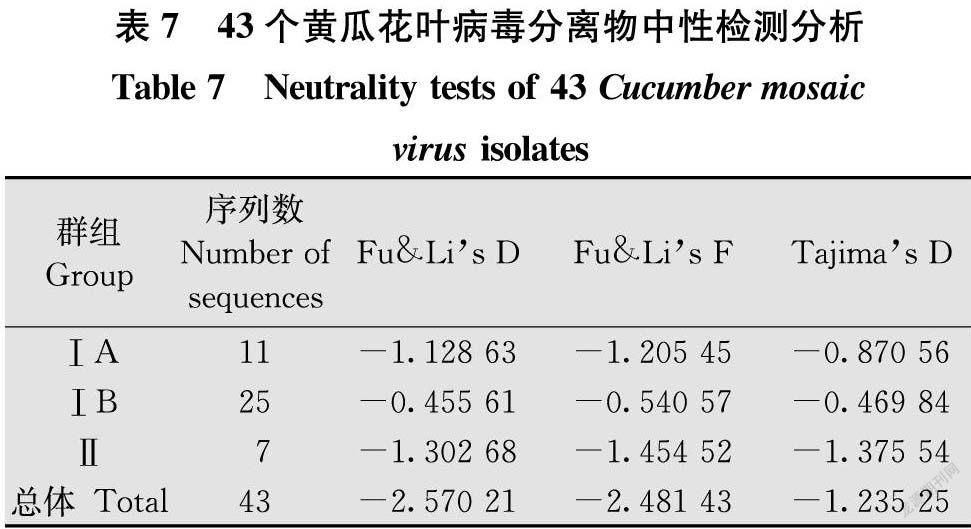
1.9 中性检验分析
中性检验分析基于Fu & Li’s D、Fu & Li’s F和Tajima’s D值评价,若上述3个参数均小于零,说明该群体多样性较低,群体存在选择压力或呈扩张趋势;若
这3个参数值大于零,说明群体数量趋于减少,群体处于收缩态势[23]。
2 结果与分析
2.1 湖南烟区CMV检测
对303份有花叶、皱缩、叶缘上卷等症状的烟草样品进行PCR扩增,有192份样品得到大小约为650 bp的片段(圖1),条带大小符合预期,阳性检出率63.37%(表2)。对PCR产物(CP基因)进行测序,并与NCBI上登录的CMV分离物CP基因序列进行比对,结果显示湖南烟区CMV分离物与NCBI上登录的CMV分离物(登录号KU976486、EF424776、HQ844075等)的一致性为86.34%~98.42%。
2.2 重组分析
对得到的CMV分离物CP基因序列进行重组分析,结果表明,P>1.0×10-6,CMV分离物CP基因无重组现象或重组现象不明显。利用Simplot进一步确认,结果显示不存在明显重组事件。
2.3 系统发育分析
同源性比对显示,192份阳性样品序列一致性为93.35%。选取 11个湖南不同地区CMV分离物与32个已报道的不同国家或地区的CMV分离物 CP基因序列构建系统发育树(图2),结果发现CMV不同分离物形成ⅠA、ⅠB和Ⅱ3个组,ⅠA 组以亚洲(中国、日本、韩国)分离物为主,少部分为美国、匈牙利和西班牙分离物,ⅠB组以中国(湖南)分离物为主,其他为意大利、西班牙、印度尼西亚和菲律宾分离物,Ⅱ组主要为日本、南非、澳大利亚和美国分离物,不同组间的分离物地理特征不明显。湖南CMV分离物属于亚组ⅠB,不同地区的分离物在系统发育树中聚集分布,来自长沙宁乡(CS-NX)、湘西龙山(XX-LS)、郴州永兴(CZ-YX)的3个分离物稍微分散,其他地区分离物地理特征不明显,遗传距离较近,一致性较高,核苷酸序列的一致性为93.8%~96.6%,氨基酸的一致性为95.9%~96.9%。
2.4 遗传差异和基因交流
系统发育分析将43个CMV分离物分成ⅠA、ⅠB和Ⅱ 3个组,对这3个组进行遗传差异分析,结果显示不同组间的KS和Z值较小,P值也较小,接近于0,远小于0.001,表明CMV在不同组间的遗传差异比较明显(表3)。基因交流分析结果显示,CMV不同组间的Fst值均大于0.33,表明CMV在不同组间基因交流频率不高。CMV不同组间Nm均小于1,表明群体可能受到遗传漂变影响。
2.5 选择压力分析
利用dN和dS预测不同群组分离物非同义突变率和同义突变率,分别计算dN和dS值,估量CP基因序列的选择压程度(表4)。结果显示dN值小于dS值,dN/dS均小于1,表明CMV不同群体受负选择压力较强,负选择可能是CMV进化的主要驱动力。
2.6 突变位点和保守区域分析
突变位点分析发现,CMV CP基因有可变位点260个,单突变位点128个,其中2个变异型位点119个,3个变异型位点9个。保守区域分析发现(表5),CMV CP基因保守区域共有3个,保守性为0.54,表明 CMV CP基因突变率很低,比较保守。
2.7 群体结构分析
群体结构分析结果表明(表6),ⅠA、ⅠB和Ⅱ 3个组的核苷酸多样性差异值分别为0.021 55、0.055 47和0.013 96,差异值均大于0.005,其中ⅠA和ⅠB组的核苷酸多样性差异值均大于组Ⅱ,表明ⅠA和ⅠB组遗传多样性高于组Ⅱ。3个组的单体型多样性差异值接近,均大于0.5,接近1,表现出较高的单体型多样性。总体来看,核苷酸多样性总体差异值为0.110 32(大于0.005),单体型多样性差异值为0.998(大于0.5),说明3个组总体具有较高的核苷酸多样性和单体型多样性。
2.8 中性检测分析
中性检测结果显示,3个组CP基因序列的Fu & Li’s D、Fu & Li’s F和Tajima’s D 3个参数检验值均小于0(表7),总体值也均为负值,表明 CMV群体处于扩张趋势,群体在不斷扩张。
3 讨论
CMV寄主范围广、地域适应性强,在与寄主植物互作过程中,相互协同进化,易发生变异。开展CMV群体遗传多样性研究,探明CMV的分子进化特征,对科学精准防控CMV意义重大。
据报道我国CMV分离物多为亚组Ⅰ(ⅠA、ⅠB),而亚组Ⅱ较少发现[24]。如宋丽云[8]对全国32个CMV分离物进行鉴定分析发现有18个属于亚组Ⅰ。刘勇等[9]鉴定发现湖南烟区CMV株系主要为亚组Ⅰ,占比94.1%,但未细分出ⅠA和ⅠB。本研究对湖南烟草上CMV分离物的CP基因进行了序列分析并构建了系统发育树,结果表明湖南CMV分离物均属于亚组ⅠB,与刘勇、宋丽云等的研究结果一致。刘勇等[9]在云南和贵州烟草发现了少量的病毒样品属亚组Ⅱ,但本研究未发现湖南烟草上有亚组Ⅱ分离物,这可能与烟草品种差异或采样的点还不全面有关。CMV的发生、进化和变异与不同寄主、地理位置、生长环境等因素有关,而且不同CMV亚组可能与其致病性强弱有关[25],样品阳性检出率是否能够反映CMV实际发生率,这些问题还有待进一步探究。另外,本研究仅基于CP基因进行系统分析,也有可能存在误判,还需基于不同功能基因进一步分析。鉴于我国烟草上主要以CMV亚组ⅠB株系为主,故烟草CMV的抗病育种与防治应以亚组ⅠB株系为主要靶标,研究结果为烟草CMV的抗病品种选育提供了理论依据和支撑。
病毒丰富的遗传多样性主要来自基因重组、突变、基因流、遗传漂变和自然选择等因素长期相互作用[26]。推动病毒不断进化的主要动力是基因重组[27],它增强病毒适应新寄主和新环境的能力,进而扩大病毒的寄主范围[28]。重组分析发现湖南烟草CMV CP基因无重组现象或重组现象不明显,推测可能因为CMV不存在重组,以致烟草上CMV的发生一直比较稳定。遗传漂变对病毒群体突变的频率有重要作用,CMV存在ⅠA和ⅠB两个相对独立的群体,遗传变异显著,ⅠA和ⅠB之间的基因交流频率较低。中国烟草CMV Ⅰ A主要与东亚的日本、韩国分离物亲缘关系较近,相互交流频率高,而Ⅰ B主要与东南亚的菲律宾、印度尼西亚交流较频繁,与属于亚组Ⅱ的欧洲、美国分离物之间交流频率较低。推测中国烟草CMV起源有可能与烟草传入中国的路径相似,烟草携带CMV由日本和菲律宾南北两条路径传入中国沿海,再传入中国内地[29],在现代烟草种植过程中,中国内地不同地区间携带CMV的烟草种子交流频繁,导致CMV群体间同时存在遗传差异和基因交流。
突变是驱动CMV进化的主要作用力之一[30]。选择压力和突变分析表明负选择是CMV进化的主要驱动力,CMV CP基因序列变异较少,
遗传结构相对比较稳定,这与赵雪君等[10]的研究结果相一致。遗传多样性参数(核苷酸多样性和单体型多样性)分析结果表明CMV群体遗传多样性较高,群组ⅠA和ⅠB遗传多样性高于Ⅱ,表明两个群体相对稳定且长期演化,但群体之间呈现一定程度的分化,
整体处于扩张趋势。群体内这种高遗传多样性的形成是一个长期过程,推测可能由于中国烟草种植区之间的种苗调运频率较高,且CMV为重要的蚜传病毒,经蚜虫传播导致不同地区和寄主间的CMV交流频繁,易发生突变和自然选择,从而造成不同群体的遗传多样性较高。
4 结论
对来自湖南烟草CMV 的CP基因进行了RT-PCR和测序,分析了湖南烟草CMV遗传多样性及分子进化机制,结果表明湖南烟草CMV属亚组ⅠB,群体间地理相关性不明显,无明显重组现象,遗传变异明显,基因交流频率低,遗传多样性较高,负选择是驱动进化的主要作用力,种群处于扩张趋势。本研究开展了CMV系统进化和遗传多样性分析,揭示了CMV分子变异进化特征,为CMV的抗病品种选育和病害精准防治提供了理论依据和科学指导。
參考文献
[1] 朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002.
[2] 王凤龙,周义和,任广伟. 中国烟草病害图鉴[M].北京:中国农业出版社,2019.
[3] 王凤龙. 烟草病毒病综合防治技术[J].烟草科技, 2002(4): 4345.
[4] SCHOLTHOF K B, ADKINS S, CZOSNEK H, et al. Top 10 plant viruses in molecular plant pathology. Molecular Plant Pathology, 2011,12(9):938954.
[5] HELLWALD K H, PALUKAITIS P. Nucleotide sequence and infectivity of Cucumber mosaic cucumovirus (strain K) RNA2 involved in breakage of replicase-mediated resistance in tobacco [J]. Journal of General Virology, 1994, 75(8):2121–2125.
[6] ROOSSINCK M J, ZHANG L, HELLWALD K H. Rearrangements in the 5′nontranslated region and phylogenetic analyses of Cucumber mosaic virus RNA 3 indicate radial evolution of three subgroups [J]. Journal of Virology, 1999, 73(8):67526758.
[7] SAFAEIZADEH M, SAIDI A, PALUKAITIS P, et al. Molecular characterization of Cucumber mosaic virus isolates infecting tomato in Hamedan and Tehran provinces of Iran [J]. Acta Virologica, 2015, 59(2): 174178.
[8] 宋丽云. 我国烟草TMV和CMV种群结构遗传分析[D]. 北京: 中国农业科学院, 2012.
[9] 刘勇, 莫笑晗, 余清, 等. 云南·福建·湖南烟区烟草花叶病主要病毒种类检测及黄瓜花叶病毒亚组鉴定[J]. 植物病理学报, 2006, 36(4): 310313.
[10]赵雪君, 刘世超, 李斌, 等. 四川烟区CMV和PVY株系分化研究[J]. 西南大学学报(自然科学版), 2017, 39(3): 816.
[11]杨金广, 张帅, 申莉莉, 等. 烟草中TMV、CMV和PVY多重RT-PCR检测体系的建立与应用[J].中国烟草学报, 2010,16(4): 8388.
[12]LIU Yuanyuan, YU Shanlin, LAN Yufei, et al. Molecular variability of five Cucumber mosaic virus isolates from China [J]. Acta Virologica, 2009, 53(2):8997.
[13]MARTIN D P. RDP4: Detection and analysis of recombination patterns in virus genomes [J/OL]. Virus Evolution, 2015, 1(1): vev003. DOI: 10.1093/ve/vev003.
[14]匡云波, 叶炜, 李金辉, 等. 太子参蚕豆萎蔫病毒2号CP基因的遗传多样性及分子进化分析[J]. 植物病理学报, 2017, 47(4): 470478.
[15]TAN Zhongyang, WADA Y, CHEN Jishuang, et al. Inter- and intralineage recombinants are common in natural populations of Turnip mosaic virus [J]. Journal of General Virology, 2004, 85(Pt9): 26832696.
[16]DAYHOFF M O, BARKER W C, HUNT L T, et al. Establishing homologies in protein sequences [J]. Methods in Enzymology,1983, 91: 524545.
[17]HUDSON R R. A new statistic for detecting genetic differentiation [J]. Genetics,2000, 155: 20112014.
[18]贺振,李文凤,李世访.云南蔗区甘蔗线条花叶病毒分离物NIa基因形成新簇[J].微生物学报,2016,56(11):18021810.
[19]刘嘉裕, 戴良英, 刘勇, 等. 长沙地区南瓜的小西葫芦黄花葉病毒检测及其分子进化分析[J]. 湖南农业大学学报(自然科学版), 2017, 43(3): 274281.
[20]TOMITAKA Y, OHSHIMA K. A phylogeographical study of the Turnip mosaic virus population in East Asia reveals an ‘emergent’ lineage in Japan [J]. Molecular Ecology, 2006, 15(14): 44374457.
[21]POSADA D. jModelTest: phylogenetic model averaging [J]. Molecular Biology and Evolution, 2008, 25(7): 12531256.
[22]贺振, 李文凤, 张志想, 等. 甘蔗线条花叶病毒HC-Pro基因的分子变异分析[J]. 植物保护, 2017, 43(2): 2936.
[23]FU Y X, LI W H. Statistical tests of neutrality of mutations [J]. Genetics, 1993, 133(3): 693709.
[24]徐平东, 周仲驹, 林奇英, 等. 黄瓜花叶病毒亚组Ⅰ和Ⅱ分离物外壳蛋白基因的序列分析与比较[J]. 病毒学报, 1999, 15(2): 165171.
[25]覃瑞, 程旺元. 黄瓜花叶病毒研究进展[J]. 中南民族大学学报(自然科学版), 2004, 23(2): 3338.
[26]宋震,刘科宏,杨方云,唐科志,李中安,周常勇.柑橘碎叶病毒外壳蛋白基因的克隆和序列分析[J].中国农业科学,2009,42(10):37413748.
[27]陈玉珍, 谭新球, 朱春晖, 等. 我国部分地区常见农作物上黄瓜花叶病毒分离物核酸多样性分析[J]. 植物保护学报, 2016, 43(3): 427433.
[28]WOROBEY M, HOLMES E C. Evolutionary aspects of recombination in RNA viruses [J]. Journal of General Virology, 1999, 80(10): 25352543.
[29]刘天波, 周志成, 彭曙光, 等. 基于全基因组编码区序列的烟草花叶病毒分子进化分析[J]. 植物保护, 2017, 43(5): 8792.
[30]GARCAARENAL F, FRAILE A, MALPICA J M. Variability and genetic structure of plant virus populations [J]. Annual Review of Phytopathology, 2001, 39(1):157186.
(责任编辑:杨明丽)
