基于MAPK/ERK 信号通路探讨冷冻消融对肺癌小鼠的作用机制
2022-04-02林事成刘殿娜周相男庄垚雪梁天宇王潇凡胡凯文孙静宜李泉旺
林事成,刘殿娜,周相男,庄垚雪,梁天宇,王潇凡,胡凯文,孙静宜,李泉旺
(1.北京中医药大学,北京 100029;2.北京中医药大学东方医院肿瘤科,北京 100078)
根据2020 年全球最新癌症负担数据统计,肺癌是死亡率最高的恶性肿瘤,2020 年死亡人数高达180 万,远超其他恶性肿瘤[1]。手术切除作为早期肺癌首选方法,然而肺癌起病隐匿,大多肺癌发现时已属晚期,失去手术机会。近年来冷冻消融作为新兴靶向治疗手段,在包括肺癌在内的多种肿瘤中被证实疗效显著。冷冻消融治疗中发现除了物理直接杀伤肿瘤作用,还能降低肿瘤侵袭力,降低肿瘤转移及复发率,激活抗肿瘤免疫,但对其具体作用机制及分子水平的变化,尚缺乏进一步的研究。丝裂原活化蛋白激酶(MAPK)是表皮生长因子受体(EGFR)的重要下游,表皮生长因子受体接收细胞外生长、增殖信号通过MAPK/ERK 信号通路传递到细胞核,从而导致细胞生长、生存、修复与增殖[2]。研究表明肾癌、肝癌、肺癌等多种恶性肿瘤中MAPK/ERK 信号异常激活[3-5]。本研究通过建立Lewis 肺腺癌小鼠皮下移植瘤模型探讨冷冻消融对MAPK/ERK 信号通路的影响。
1 材料与方法
1.1 实验动物及细胞
雄性C57BL/6 小鼠10 只,6~8 周龄,体质量(20±2)g,购自北京斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010,本实验中所有的实验动物被饲养于北京中医药大学东方医院实验动物中心,SPF 级饲养环境,动物实验经北京中医药大学东方医院实验动物伦理委员会批准进行,批号为202020。小鼠肺癌Lewis 细胞株,购自江苏凯基生物技术股份有限公司。
1.2 主要实验材料及设备
DMEM 高糖培养基购自Hyclone 公司;胎牛血清购自默克公司;胰蛋白酶及青链霉素混合液购自GIBCO 公司;RIPA(强)裂解液购自碧云天公司;BCA 蛋白定量试剂盒购自江苏凯基生物技术股份有限公司;Reveraid First Strand cDNA Synthesis Kit试剂盒购自赛默飞公司;SYBR qPCR SuperMix Plus 试剂盒购自Novoprotein 公司;NucleoZol RNA提取试剂购自基因公司;KRAS、RAF1、ERK1/2、P-ERK1/2 多克隆抗体均购自Proteintech 公司,P-RAF1、P-MEK1 均购自Abcam 公司,MEK1 多克隆抗体购自Santa Cruz 公司,山羊抗兔(鼠)IgG 二抗均购自Proteintech 公司;氩氦刀冷冻治疗系统及1.2 mm 冷冻刀头(美国Endocare 公司);荧光定量PCR 仪(美国ABI 7300),小型垂直电泳转印系统(美国BIO-RAD 公司1658033)。
1.3 细胞培养及动物模型的建立
Lewis 细胞用含10% 胎牛血清、1% 双抗的DMEM 高糖培养基,置于37℃,5%CO2的培养箱中培养,每2 天换液一次,细胞贴壁面积达70%时进行传代培养。
小鼠适应性喂养1 周后,取对数生长期Lewis细胞,胰酶消化,重悬,以每只小鼠0.2 mL 细胞悬液含2×106个细胞接种于小鼠右腿内侧皮下,1 周后游标卡尺测量肿瘤直径10 mm×10 mm,开始实验。
1.4 小鼠冷冻方案及分组
将造模成功的小鼠随机分为假手术组和冷冻消融组,每组各5 只,手术时将冷冻消融组小鼠麻醉,固定,备皮,消毒,切开皮肤,暴露肿瘤,1.2 mm冷冻刀头插入肿瘤中央。采用双循环冷冻方法:利用释放氩气将刀头温度迅速降低至-120℃冷冻10 s,随后释放氦气复温至15℃,重复上述冷冻消融循环1 次。假手术组小鼠麻醉固定后,切开皮肤,暴露肿瘤,直接缝合。两组小鼠麻醉复苏后继续喂养小鼠,于14 d 后同时处死小鼠,取材,尽量完整剥离肿瘤组织。
1.5 Western blot 检测肿瘤组织中MAPK/ERK 通路相关蛋白表达情况
取50 mg 剥离的小鼠肿瘤组织,将组织剪碎放入玻璃匀浆器中,加入RIPA 裂解液500 μL,反复研磨充分裂解组织蛋白,离心取上清液获取总蛋白,采用BCA 蛋白浓度测定法检测样本蛋白含量,并将所有样本总蛋白浓度调为3 μg/μL。样本蛋白经100 ℃8 min 高温煮沸变性,进行SDS-PAGE 电泳,取30 μg 样本上样,100 V 恒压电泳至条带到底部,100 mA 恒流电转100 min,取下转好的PVDF 膜加入TBST 润洗5 min×3 次,10%脱脂奶粉封闭1 h结合PVDF 膜上无关蛋白反应位点,TBST 润洗5 min×3 次,分别加入兔(鼠)多克隆蛋白一抗工作液KRAS(1∶5 000)、RAF1(1∶3 000)、MEK1(1∶200)、ERK1/2(1∶3 000)、P-RAF1(1∶3 000)、P-MEK1(1∶3 000)、P-ERK1/2(1∶3 000)、GAPDH(1∶50 000)室温孵育1.5 h,TBST 润洗5 min×3 次,加入山羊抗兔(鼠)二抗(1∶10 000)室温孵育1 h,TBST 润洗5 min×3 次,使用超敏ECL 发光液孵育PVDF 膜,调整曝光条件进行显影,保存图片,采用Imagel J 软件分析条带灰度值。
1.6 qRt-PCR 法检测肿瘤组织中KRas 基因表达情况
根据制造商说明书,取50 mg 肿瘤组织加入NucleoZol RNA 提取试剂500 μL,用玻璃匀浆器充分研磨,加入200 μL 无菌无酶水,涡旋15 s 后室温静置5 min,12 000g离心15 min,取上层清液于另一离心管中,加入500 μL 异丙醇,室温静置10 min,12 000g离心10 min,弃上清液,此时RNA 沉于管底,加入500 μL 75%乙醇8 000g离心3 min 洗涤RNA,用移液器吸除上层乙醇,再次加入75% 乙醇,干燥管中RNA,加入50 μL 无菌无酶水溶解提取到的RNA。紫外分光光度计测定OD260/OD280,计算各组总RNA 浓度,参照产品说明书使用引物Oligo(dT)18 primer进行反转录合成第一链cDNA,反应时间为:42°C 60 min,70°C 5 min。使用SYBR Green作为荧光染料,以β-actinmRNA作为内参,KRas引物上游:5′-TGTGGACGAATATGATCCAACA-3′,下游:5′-GCAAATACACAAAGAAAGCCCT-3′;β-actin引物上游:5′-CTACCTCATGAAGATCCTGACC-3′,下游5′-CACAGCTTCTCTTTGATGTCAC-3′。使用ABI 7300 qRt-PCR 系统检测相关mRNA的表达,反应程序为:95 ℃1 min,95 ℃20 s,60 ℃1 min,共40 个循环,最后一步60°C 时记录荧光信号,依程序设定溶解曲线,按照2-ΔΔCt计算KRasmRNA 的相对表达量。
1.7 统计学处理
统计数据选用SPSS 20.0,图形构建选用Graphpad Prism8.0,正态分布计量资料以均数±标准差(±s)表示,正态分布且方差齐的两组样本采用两独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 冷冻消融对MAPK/ERK 通路相关蛋白的调控
Western blot 结果显示,与假手术组相比,冷冻消融组KRAS 蛋白表达降低(P<0.05),非磷酸化蛋白RAF1、MEK1、ERK1/2 表达无统计学差异,磷酸化蛋白P-RAF1、P-MEK1、P-ERK1/2 表达均受到抑制(P<0.05)。见图1、表1。
表1 两组小鼠肿瘤中MAPK/ERK 通路相关分子蛋白表达水平比较(n=5,±s)Tab 1 Comparison of MAPK / ERK pathway related protein expression in tumor of mice between two groups(n=5,±s)

表1 两组小鼠肿瘤中MAPK/ERK 通路相关分子蛋白表达水平比较(n=5,±s)Tab 1 Comparison of MAPK / ERK pathway related protein expression in tumor of mice between two groups(n=5,±s)
注:与假手术组比较,*P<0.05。
指标KRAS/GAPDH P-RAF1/RAF1 P-MEK1/MEK1 P-ERK1/2 / ERK1/2假手术组0.866±0.060 1.475±0.211 2.437±0.286 1.106±0.082冷冻消融组0.471±0.233 0.931±0.132 1.485±0.678 0.733±0.171 t 2.842*4.884*2.896*4.412*

图1 两组小鼠肿瘤组织中MAPK/ERK 通路相关蛋白相对表达量Fig 1 Relative expression of MAPK /ERK pathway related proteins in tumor tissues of mice in two groups
2.2 冷冻消融对KRas mRNA 表达的影响
qRt-PCR 结果表明,与假手术组小鼠相比,小鼠肺腺癌组织经冷冻消融后肿瘤组织中KRasmRNA 表达降低(1.000±0.073vs.0.645±0.053)(t=6.825,P<0.05)。见图2。
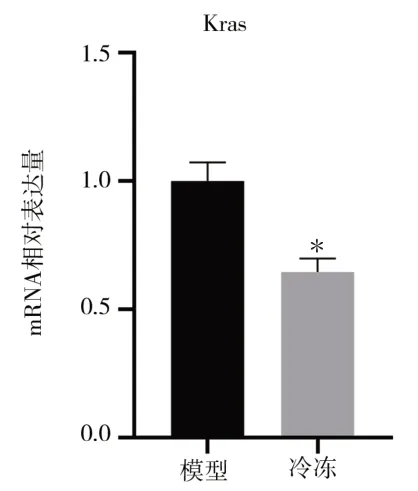
图2 两组小鼠肿瘤组织中KRas mRNA 的表达情况Fig 2 Expression of KRas mRNA in tumor tissue of mice in two groups
3 讨论
肺癌目前仍然位居我国恶性肿瘤发病率及死亡率之首[6]。对于大部分失去手术切除机会的晚期患者,冷冻消融治疗具有副作用小、局部微创、安全有效的特点,可以较好地控制肺癌的病情进展,提高患者的生活质量,减轻病痛,延长生存期。冷冻消融技术通常是利用氩气或液氮等媒介迅速在病灶形成-140 ℃~-160 ℃的冰球,在肿瘤细胞内外快速形成冰晶,逐渐复温至30 ℃过程中冰晶消融,使肿瘤细胞破裂及细胞内蛋白质理化变性,引起肿瘤组织的机械性损伤[7]。近年来人们研究发现肿瘤细胞坏死产物会抑制残余肿瘤的进展,并可能影响到远处转移瘤[8-10],冷冻消融对肿瘤的作用除了直接机械性损伤,可能涉及到更复杂的分子机制。本研究通过动物实验,探究冷冻消融对肿瘤经典信号通路MAPK/ERK 的影响,以期在临床上对冷冻消融与分子靶向药物的联合治疗有所指导。
肺癌的发生、发展和转移是多阶段、多步骤的过程,在肿瘤进展的每个阶段,细胞信号传导通路的异常激活都起着重要作用[11]。目前针对肺癌研究较多的通路有MAPK 通路、PI3K/AKT 通路、DLL4-Notch1 通路、TGFβ/Smad 通路等,其中MAPK 信号通路是细胞内信号传导的主要途径,在肺癌的病情进展中扮演重要角色。MAPK 通路有4种主要的分支路线:ERK、JNK、p38/MAPK 和ERK5。其中,MAPK/ERK 主要参与调控细胞生长、分化、凋亡、迁移,上游信号是著名的Ras 及Raf蛋白,Ras基因是一种原癌基因,是发现最早并且突变率最高的人类癌基因之一。KRas基因突变是肺癌中最常见的基因突变之一,约32%的非小细胞肺癌存在KRas 突变[12]。该信号通路主要是Ras 在细胞外信号刺激下,与三磷酸鸟苷结合而激活,从而使Raf 蛋白磷酸化活化,由Raf 再激活Mek,Mek 经磷酸化最终激活Erk,只有p-Erk 才具有活性,p-Erk通过转位进入细胞核,激活多种转录因子和激酶,借此完成将细胞外刺激信号传至细胞内过程,引起一系列细胞反应,从而调控细胞增殖、分化、凋亡、转移等。
本研究结果表明,对Lewis 肺癌荷瘤小鼠冷冻消融与假手术组相比,冷冻消融可以直接抑制KRas基因的转录,减少了KRAS 蛋白的表达,进而引起下游RAF1、MEK1 蛋白磷酸化激活过程的抑制,最终抑制了ERK1/2 磷酸化表达的进程,可能会引起肿瘤细胞增殖、分化、凋亡、转移过程的抑制。
正常情况下KRas表达受上游EGFR 受体传递胞外信息,肺癌中较常见的KRas基因突变,使KRas在无EGFR 外源信号刺激下仍处于激活状态,且不可控,持续的激活状态将导致肿瘤的无序增殖。因而KRas 基因突变影响了EGFR-TKI 靶向治疗的疗效,而本次实验结果提示冷冻消融除了具有直接机械杀伤肿瘤细胞的作用,还可以抑制KRas基因的表达,抑制MAPK/ERK 信号通路的活化。KRas基因突变患者在接受冷冻消融后联合EGFR-TKI 靶向用药可能有更好的疗效。
综上所述,冷冻消融可以通过下调KRas基因的表达,负向调控MAPK/ERK 信号通路,可能与冷冻消融抑制肿瘤生长、转移相关。由于MAPK/ERK 信号通路作为表皮生长因子受体(EGFR)的重要下游通路,冷冻消融与EGFR 靶向药物联合治疗可能会产生增敏效果,进一步提高疗效,而这需要我们进一步研究探索。
作者贡献度说明:
林事成:实验方案的设计,小鼠喂养,小鼠冷冻消融手术主刀,进行各项指标检测,文章撰写;刘殿娜:完善实验方案,指导小鼠冷冻消融实验的进行,指导相关检测实验;周相男:协助完成各项指标检测,检查修改论文;庄垚雪:协助小鼠冷冻实验,小鼠取材,协助提总蛋白,提总RNA,WB 检测,PCR 检测;梁天宇:协助小鼠冷冻实验,小鼠取材,协助WB检测;王潇凡:协助小鼠冷冻实验,小鼠取材,协助PCR 检测;胡凯文:课题设计及校审;孙静宜:购买实验耗材,协助完成WB 和PCR 检测,整理数据;李泉旺:课题负责人,提供文章整体思路,完善实验方案,修改论文。
所有作者声明没有利益冲突。
