免疫检查点抑制剂在小细胞肺癌中的应用进展
2022-04-01吴伟
吴伟
【摘要】 小细胞肺癌(small cell lung cancer,SCLC)是肺癌中恶性程度较高的一种亚型,其临床预后较差。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)阿特珠单抗(Atezolizumab)联合化疗能够显著提高SCLC患者的总体生存率(overall survival,OS),已被批准用于广泛期SCLC的一线治疗。与非小细胞肺癌相较而言,免疫治疗目前在小细胞肺癌中的应用价值仍较局限。因此,本文就SCLC的免疫微环境,ICIs在SCLC中的临床试验和疗效预测标志物以及最新的免疫联合治疗试验做简要综述,以期为临床SCLC免疫治疗的诊疗方案提供新的思路。
【关键词】 小细胞肺癌 免疫检查点抑制剂 预测标志物 免疫治疗
Application Progress of Immune Checkpoint Inhibitors in Small Cell Lung Cancer/WU Wei. //Medical Innovation of China, 2022, 19(04): -188
[Abstract] Small cell lung cancer (SCLC) is a subtype of lung cancer with high malignancy and poor prognosis. Immune checkpoint inhibitors (ICIs) Atezolizumab combined with chemotherapy can significantly improve the overall survival of SCLC patients, and has been approved for the first-line treatment of extensive-stage SCLC patients. The clinical value of immunotherapy is still limited in SCLC comparing with non-small cell lung cancer. Therefore, this paper briefly reviewed the immune microenvironment of SCLC, clinical trials and efficacy prediction markers of ICIs in SCLC, and the latest immunotherapy trials, in order to provide new ideas for clinical diagnosis and treatment of SCLC immunotherapy.
[Key words] Small cell lung cancer Immune checkpoint inhibitors biomarkers Immunotherapy
First-author’s address: Affiliated Cixi People’s Hospital, Wenzhou Medical University, Cixi 315300, China
doi:10.3969/j.issn.1674-4985.2022.04.043
肺癌的發病率居全球第二,且是首要的癌症相关死因[1]。小细胞肺癌(small cell lung cancer,SCLC)是肺癌中恶性程度较高的一种亚型,约14%的肺癌组织学类型为小细胞肺癌[2]。小细胞肺癌的生长速度较快,早期便出现广泛的远处转移,按照病灶累及范围将小细胞肺癌分为局限期(limited-stage,LS-SCLC)和广泛期(extensive-stage,ES-SCLC),约三分之二的小细胞肺癌在诊断时已处于广泛期。以铂类为基础的化疗仍是小细胞肺癌的一线标准治疗,治疗反应率约为65%。但易复发的特性导致小细胞肺癌的预后极差,2年总体生存率(overall survival,OS)不足5%。美国食品与药品管理局(food and drug administration,FDA)已批准程序细胞死亡受体1(programmed cell death ligand 1,PD-L1)抗体阿特珠单抗(Atezolizumab)联合卡铂和依托泊苷作为小细胞肺癌的一线治疗;批准程序细胞死亡1(programmed cell death 1,PD-1)抗体单抗纳武利尤单抗(Nivolumab)和帕博利珠单抗(Pembrolizumab)单药作为小细胞肺癌的三线治疗。免疫治疗因此打破了近30年来小细胞肺癌治疗领域的僵局,为小细胞肺癌患者带来了新的希望。因此,本文主要对SCLC的免疫微环境、ICIs治疗对SCLC的疗效预测标志物以及正在进行的ICIs相关临床试验等进行综述,以期帮助临床小细胞肺癌的免疫治疗决策。
1 免疫微环境在小细胞肺癌中的应用
肿瘤的免疫微环境主要指肿瘤及周围组织中与肿瘤细胞相互作用的免疫细胞及免疫细胞分泌的细胞因子。即使在同一组织学类型的肿瘤中,不同进程及不同分期的肿瘤免疫微环境具有明显差异,并影响肿瘤的治疗效果和预后。由于小细胞肺癌组织难以获得,目前关于小细胞肺癌免疫微环境的大样本研究相对有限。
多项回顾性研究表明,SCLC的肿瘤免疫微环境与预后密切相关。SCLC肿瘤免疫微环境中存在肿瘤浸润巨噬细胞(tumor-infiltrating macrophages,TIM)、淋巴细胞(tumor-infiltrating lymphocytes,TILs)的患者预后相对较好[3-4]。抑制性FOXP3+调节T细胞(regulatory T cells)浸润的LS-SCLC患者的临床预后相对较好[HR=0.37,95%CI(0.17,0.81),P=0.013][4]。另外,SCLC脑转移灶中CD45RO+记忆T细胞(memory T cells)的浸润可延长SCLC的中位OS(11个月vs 5个月,P=0.007)。表现为神经副肿瘤综合征(neurological paraneoplastic syndromes,PNS)的SCLC较内分泌型或无神经副肿瘤综合征的SCLC患者含有更高比例的T细胞浸润(P=0.033)和更久的无病进展生存期(progression-free survival,PFS)和OS时间[5]。
另外,研究表明肿瘤的突变负荷(tumor mutation burden,TMB)与免疫治疗反应率存在一定关联。小细胞肺癌的TMB在所有实体瘤中处于中高水平,化疗可导致肿瘤组织暴露更多的肿瘤相关抗原,刺激更多的T细胞启动、活化为细胞毒性T细胞(cytotoxic T cell),产生抗肿瘤效应[6-7]。相关的临床试验也同样表明,免疫治疗联合化疗的治疗方案可使更多的SCLC患者获益,并且目前已经成为小细胞肺癌的一线治疗方案。
然而,为进一步将免疫微环境与小细胞肺癌的疗效及预后的关系应用于临床,有必要将小细胞肺癌的免疫微环境与临床特点结合分析,对小细胞肺癌进行免疫分型,根据不同的免疫分型进行前瞻性临床试验设计,获得可靠的临床试验数据,更方便指导临床应用。
2 ICIs在SCLC中的应用
ICIs包括抗CTLA-4抗体伊匹单抗(Ipilimumab)、抗PD-1抗体帕博利珠单抗和纳武利尤单抗以及抗PD-L1抗体阿特珠单抗和度法鲁单抗(Durvalumab)。ICIs已在多种癌症类型中表现出显著且持久的抗肿瘤效应,FDA已批准ICIs在多种血液和实体恶性肿瘤中使用。
2.1 一线治疗 目前ICIs单药、双药及联合化疗等治疗方案在非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线及后线治疗中均占有一席之地,而ICIs在SCLC中的临床应用和研究均较缓慢。由于SCLC恶性程度较高,在一线治疗中如不使用化疗药物,具有导致病情进展的巨大风险。因此,相关的大部分临床试验均为联合用药,极少为单用ICIs。另外,化疗可增加肿瘤抗原的暴露水平,因此理论上ICIs联合化疗可提高SCLC患者的治疗反应率。目前已有三组Ⅲ期临床试验报道了各自的ICIs联合一线化疗的试验结果。
一项Ⅱ期临床试验结果显示接受伊匹单抗联合化疗的患者较接受化疗的患者而言,其免疫相关PFS得到一定程度的延长[8]。其随后的Ⅲ期临床试验却未进一步展示免疫治疗在SCLC中的优势:两组的中位OS和客观缓解率(objective response rate,ORR)均无显著差异,伊匹单抗联合化疗组的PFS较单纯化疗组延长[4.6个月vs 4.4个月;HR=0.85,95%CI(0.75,0.97),P=0.016],但并不明显[9]。该实验的结果显示伊匹单抗在ES-SCLC患者中的应用较局限,并不能显著改善ES-SCLC患者的预后,而增加了潜在的免疫治疗相关的不良反应(immune-related adverse events,irAEs)。
尽管开局不尽如人意,仍有多项临床试验继续开展,并获得了良好的初期结果。IMPower 133临床试验报道了阿特珠单抗联合化疗的治疗方案较但单用化疗显著改善了ES-SCLC患者的中位OS[12.3个月vs 10.3个月;HR=0.70,95%CI(0.54,0.91),P=0.007]和中位PFS[5.2个月vs 4.3个月;HR=0.77,95%CI(0.62,0.96),P=0.02),但两组的ORR无统计学差异[6]。此外,该研究在2019年ESMO大会发布的最新数据更加突出了阿特珠单抗联合化疗对OS的延长作用:阿特珠单抗联合化疗组的18个月OS达到了34%,而单纯化疗组仅为21%。该结果表明阿特珠单抗虽然并不增加治疗反应率,但显著延长了ES-SCLC患者的总体生存率,这对恶性程度极高,进展迅速的ES-SCLC患者来说无疑是一次重大突破。另一项CASPIAN试验则研究了度法鲁单抗联合化疗对未接受任何化疗的ES-SCLC患者的疗效[10]。与IMPower 133研究结果相似:度法鲁单抗组的中位OS较单纯化疗组显著延长[13.0个月vs 10.3个月;HR=0.73,95%CI(0.59,0.91),P=0.004 7),ORR较单纯化疗组有所提高(分别为79.5%和70.3%)。这两项试验结果显示两者对OS的差异影响较为一致,生存数据结果基本一致,表明化疗联合靶向ICIs能使更多的ES-SCLC患者获益。基于这两项临床试验,美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南已将阿特珠单抗/度法鲁单抗联合化疗方案作为ES-SCLC患者的一线选择,并获得FDA批准。
另外,在副作用及不良事件方面,在IMPower 133或CASPIAN研究中,没有观察到化疗联合ICIs组的PNS或其他3级、4级不良事件显著增加。其他治疗相关不良事件和治疗终止的发生率和类型与非小细胞肺癌的化疗联合ICIs的结果基本一致,显示阿特珠单抗/度伐鲁单抗联合化疗方案在延长OS的同时,不额外增加毒副作用风险,相对安全。
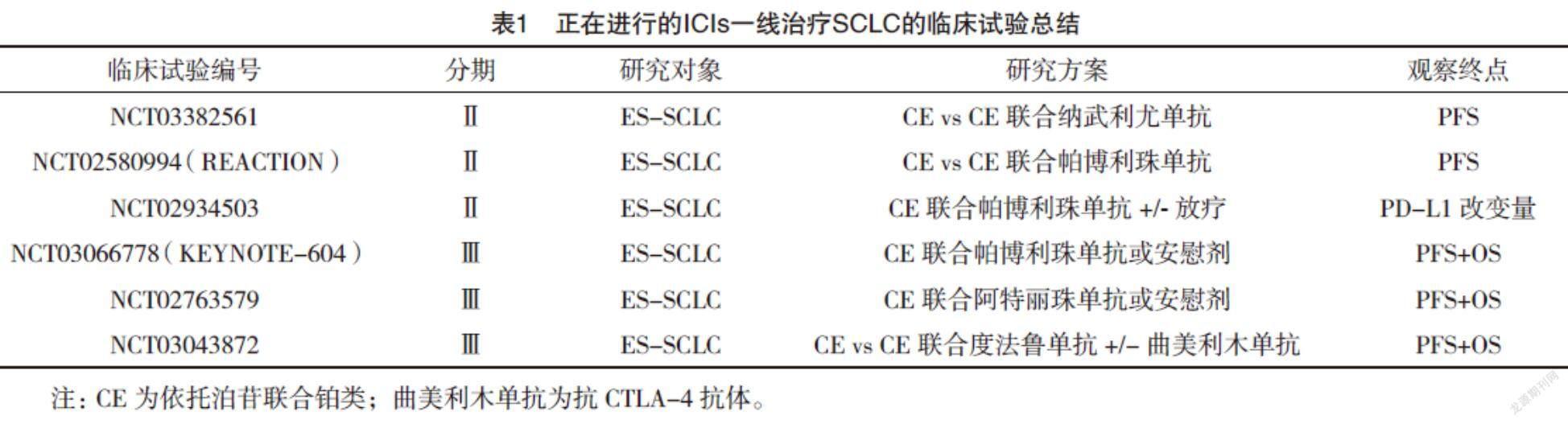
目前仍有许多将其他ICIs联合化疗作为一线治疗的临床研究正在进行,总结于表1。此外,放疗同样能导致肿瘤抗原暴露增多,将ICIs联合放疗不失为一种新的尝试。已有相关临床研究正在对放疗能否改善ICIs联合化疗方案的疗效进行评估(NCT02402920,NCT02934503,https://www.clinicaltrials.gov)。
2.2 二线治疗 SCLC的恶性程度决定了治疗后的疾病復发几乎是不可避免的,而进展后的治疗方案的选择十分局限。在不考虑3、4级的严重不良反应情况下,标准二线化疗的反应率仅为24.3%,中位反应持续时间(duration of response,DOR)约为14周。CheckMate 032首次对铂类治疗失败的SCLC患者进行免疫治疗的临床试验[11]。在该Ⅰ/Ⅱ期临床试验中,入组的复发SCLC患者随机接受纳武利尤单抗单药或纳武利尤单抗联合伊匹单抗(纳武利尤单抗1 mg/kg+伊匹单抗3 mg/kg和纳武利尤单抗3 mg/kg+伊匹单抗1 mg/kg)治疗,以评估各组的总体反应率。结果显示三组的ORR分别是10%、23%、19%,且治疗效果与PD-L1表达、既往接受治疗的次数等无关。这项研究展示出了双药免疫治疗对化疗失败的SCLC患者的持续抗肿瘤活性。基于这项研究,纳武利尤单抗联合伊匹单抗序贯纳武利尤单抗维持治疗方案已被NCCN列为2A类推荐。而治疗效果更佳的纳武利尤单抗1 mg/kg+伊匹单抗3 mg/kg的方案仍继续在CheckMate 032研究中观察,后续将与接受纳武利尤单抗单药治疗的患者进行对比。Keynote 028研究中也报道了类似的结果:该研究对PD-L1 TPS≥1%的标准治疗失败的SCLC患者按照10 mg/kg的剂量单药使用帕博利珠单抗,ORR和DOR分别为33.3%和19.4个月;其中只有8例患者发生≥3级免疫相关不良事件[8]。同样为复发难治的SCLC患者带来了新的曙光。对比ICIs在晚期NSCLC中的应用,ICIs在ES-SCLC中的表现与其不相上下。帕博利珠单抗和纳武利尤单抗单药方案治疗晚期NSCLC患者,可使所有患者的5年OS分别大于15%和13%,而多西他赛二线化疗的5年OS仅为2~3%[12-13]。由于ES-SCLC相关的研究队伍并未达到5年的随访观察时间,ICIs在SCLC患者中的长期获益率仍待时间的考验。
另外,CheckMate 331试验将纳武利尤单抗单药与标准二线化疗方案进行对比,治疗铂类进展的SCLC患者。该研究并没有达到其主要终点OS,但作者指出两组的OS曲线在12个月后出现分离[14]。因此,提示可能存在一部分SCLC患者能在单药免疫治疗中能够获得长期良好的治疗效果,而如何区分出这部分受益的患者将是未来几年临床和科研工作者所需要关注的重点。
3 ICIs的预测标志物
目前已有多项临床研究进行了相关研究,探索潜在的能够指导免疫治疗的预测标志物。
3.1 PD-L1 在肿瘤微环境中,PD-L1主要表达于肿瘤细胞表面。PD-L1对ICIs治疗NSCLC患者的预测价值已比较明确:目前普遍认为PD-L1表达水平较高的NSCLC对ICIs的治疗反应率高。但PD-L1在SCLC中的应用价值目前还较局限。一個含102例LS-SCLC和ES-SCLC的研究队列显示在ES-SCLC中PD-L1的表达与OS相关,为独立的良性预测因素(中位OS 9.2个月vs 5.4个月,P=0.037),而对LS-SCLC则无此预测价值[15]。IMPower 133临床试验报道的亚组分析结果显示,当SCLC患者肿瘤细胞和免疫细胞的PD-L1表达<1%时,化疗联合阿特珠单抗治疗方案可显著延长OS[中位OS 10.2个月vs 8.3个月;HR=0.51,95%CI(0.30,0.89)][16]。而根据CheckMate 032研究最新公布的数据显示,SCLC肿瘤细胞的PD-L1表达水平与ICIs治疗的ORR无显著相关性[17]。
分析以上不同研究的结果差异,首选需要考虑的是PD-L1在SCLC中的表达水平。SCLC中PD-L1的表达频率较NSCLC相对较低。CheckMate 032的研究人群中PD-L1表达≥1%的患者约为17%,而表达≥5%的患者仅有5%。另外,不同研究对PD-L1阳性表达的定义存在差异,意味着不同队列中的PD-L1阳性样本并不相通。因此,PD-L1对ICIs治疗SCLC患者的疗效及预测价值尚存在较大的争议。有必要进一步统一PD-L1的定义,扩大研究队列,进一步观察PD-L1对SCLC患者在免疫治疗中的预测价值。
3.2 TMB TMB是指肿瘤细胞基因组中特定区域内发生的非同义突变(置换、缺失和插入突变等)的总数,通常以每兆碱基含有多少个突变来表示。SCLC含有较高水平的TMB。CheckMate 032研究对TMB与ICIs的治疗效果进行了相关性分析。结果显示,接受纳武利尤单抗单药治疗的SCLC患者中,TMB水平较高的SCLC患者的ORR、中位OS和中位PFS均较低水平的TMB显著提高。接受纳武利尤单抗联合伊匹单抗治疗的SCLC患者呈现为类似的结果趋势:携带高水平TMB的SCLC患者的ORR、中位OS、中位PFS均显著延长[17]。另一项KEYNOTE-028试验则报道了SCLC患者肿瘤样本中的TMB与帕博利珠单抗治疗后的ORR和中位PFS均有显著相关性[18]。另外,这两项研究均提示SCLC患者的TMB与肿瘤细胞的PD-L1表达水平无明显相关性。相关的研究分析发现在各大常见肿瘤中TMB与ICIs治疗效果均成正相关性。NSCLC相关的研究同样也显示TMB较高的NSCLC患者接受纳武利尤单抗治疗的ORR和中位PFR均优于接受化疗的患者,且与PD-L1的表达无相关性。因而,TMB对SCLC患者的ICIs治疗反应率可能确实存在一定的预测价值。但由于这两项研究并非前瞻性研究,且KEYNOTE-028试验纳入的SCLC患者例数较有限,TMB与SCLC患者的ICIs治疗效果的相关性还有待进一步研究。
有学者尝试测量血浆中的TMB(blood-based TMB,bTMB)以代替测量肿瘤组织的TMB来减少对手术标本的依赖,进行对ICIs疗效的预测分析[19]。IMPower 133临床试验分析了bTMB对接受阿特珠单抗治疗的NSCLC患者的PFS获益预测价值[6]。由于其中不同亚组的总数存在较大差异,该分析并没有得到一致的阳性结果。但可以预见的是这种基于血液的检测方法在一定程度上能够进一步拓展TMB的临床应用。
3.3 循环肿瘤细胞(CTCs) 多项研究表明CTCs单独或联合某些基因可作为检测早期肺癌的依据,CTCs的检出与肺癌远处转移相关,并可为作为疾病复发的预测标志物。相关临床试验发现CTCs联合PD-L1可预测NSCLC患者对纳武利尤单抗的治疗反应率:在检出CTCs的患者中,PDL1阴性患者均获得临床获益,而PDL1阳性的患者均经历疾病进展[20]。而在SCLC中,Gadgeel等[21]研究发现帕博利珠单抗维持治疗的ES-SCLC患者的血液样本中可以检测到CTCs,但并没有发现基线CTCs或治疗后CTC的改变量与中位PFS或OS之间存在相关性。
综上所述,到目前为止,SCLC患者的免疫治疗还没有十分可靠的预测标志物。结合之前的研究,TMB在预测价值方面似乎比PD-L1表达更有意义,但缺乏可靠的研究队列。其他如T细胞炎症基因表达特征(T cell-inflamed gene-expression signature)、肿瘤-间质细胞接触位点的PD-L1表达水平等指标在一些试验中表明具有对ICIs延长SCLC患者OS或PFS的潜在预测价值[18,22-23],但均局限于研究分析的人数偏少,存在一定人群偏倚,需要进一步的大样本人群的研究分析。
4 免疫治疗的后续策略
放化疗联合ICIs维持治疗。当前认为SCLC能通过多种免疫逃逸途径获得机体的免疫抑制状态。文献[24]报道SCLC细胞通过分泌IL-15抑制CD4+ T细胞的增殖和促进Treg细胞诱导分化,抑制肿瘤局部和全身的免疫逃逸,导致SCLC的不良预后。此外,SCLC肿瘤细胞还可通过上调细胞表面CD47的表达,进而通过CD47/SIRPα信号通路抑制巨噬细胞的活化和吞噬而实现的免疫逃逸[25]。SCLC的免疫抑制状态似乎与TMB相关,TMB的降低可缓解免疫抑制状态。放化疗能够降低SCLC的TMB,缓解机体的免疫抑制状态,有利于提高后续SCLC对免疫治疗的敏感度。
5 總结
SCLC属于预后较差的恶性肿瘤,有限的SCLC治疗方案促使科研工作者、临床医生等不断试验包括免疫治疗在内的新治疗方案。尽管FDA已经批准阿特珠单抗联合依托泊苷和卡铂作为SCLC的一线治疗方案,但ICIs对SCLC的临床疗效远不如NSCLC显著。为了提高ICIs对SCLC患者的临床效益,了解ICIs在SCLC中的作用机制,必须密切跟进更多诸如IMPower 133的临床试验,进一步研究SCLC最佳的免疫治疗策略和预测标志物,使更多的SCLC患者获益。
参考文献
[1] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2019[J].CA:A Cancer Journal for Clinicians,2019,69(1):7-34.
[2] BERNHARDT E B,JALAL S I.Small Cell Lung Cancer[J]. Springer International Publishing, 2016,170:301-322.
[3] BERGHOFF A S,RICKEN G,WILHELM D,et al.Tumor infiltrating lymphocytes and PD-L1 expression in brain metastases of small cell lung cancer(SCLC)[J].J Neurooncol,2016,130(1):19-29.
[4] BONANNO L,PAVAN A,DIECI M V,et al.The role of immune microenvironment in small-cell lung cancer:Distribution of PD-L1 expression and prognostic role of FOXP3-positive tumour infiltrating lymphocytes[J].European Journal of Cancer,2018,101:191-200.
[5] IAMS W T,SHIUAN E,MEADOR C B,et al.Improved Prognosis and Increased Tumor-Infiltrating Lymphocytes in Patients Who Have SCLC With Neurologic Paraneoplastic Syndromes[J].Journal of Thoracic Oncology,Elsevier Inc,2019,14(11):1970-1981.
[6] HORN L,MANSFIELD A S,SZCZĘSNA A,et al.First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J].New England Journal of Medicine,2018,379(23):2220-2229.
[7] NOWAK A K,LAKE R A,MARZO A L,et al.Induction of Tumor Cell Apoptosis In Vivo Increases Tumor Antigen Cross-Presentation,Cross-Priming Rather than Cross-Tolerizing Host Tumor-Specific CD8 T Cells[J].The Journal of Immunology,2003,170(10):4905-4913.
[8] RECK M,BONDARENKO I,LUFT A,et al.Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-disease-small-cell lung cancer:results from a randomized,double-blind,multicenter phase 2 trial[J].Annals of Oncology,2013,24(1):75-83.
[9] RECK M,LUFT A,SZCZESNA A,et al.Phase Ⅲ randomized trial of ipilimumab plus etoposide and platinum versus placebo plus etoposide and platinum in extensive-stage small-cell lung cancer[J].Journal of Clinical Oncology,2016,34(31):3740-3748.
[10] PAZ-ARES L, DVORKIN M, CHEN Y,et al.Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer(CASPIAN):a randomised,controlled,open-label,phase 3 trial[J].Lancet,2019,394(10212):1929-1939.
[11] ANTONIA S J,LÓPEZ-MARTIN J A,BENDELL J,et al.Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer(CheckMate 032):a multicentre,open-label,phase 1/2 trial[J].The Lancet Oncology,2016,17(7):883-895.
[12] HORN L,SPIGEL D R,VOKES E E,et al.Nivolumab versus docetaxel in previously treated patients with advanced non-small-cell lung cancer:Two-year outcomes from two randomized,open-label,phase Ⅲ Trials(CheckMate 017 and CheckMate 057)[J].Journal of Clinical Oncology,2017,35(35):3924-3933.
[13] GARON E B,HELLMANN M D,RIZVI N A,et al.Five-year overall survival for patients with advanced non-small-cell lung cancer treated with pembrolizumab:Results from the phase i KEYNOTE-001 study[J].Journal of Clinical Oncology,2019,37(28):2518-2527.
[14] SALTOS A,SHAFIQUE M,CHIAPPORI A.Update on the Biology,Management,and Treatment of Small Cell Lung Cancer(SCLC)[J].Frontiers in Oncology,2020,10:1074.
[15] ISHII H,AZUMA K,KAWAHARA A,et al.Significance of programmed cell death-ligand 1 expression and its association with survival in patients with small cell lung cancer[J].Journal of Thoracic Oncology,2015,10(3):426-430.
[16] MANSFIELD A S,KAŻARNOWICZ A,KARASEVA N,et al.Safety and patient-reported outcomes of atezolizumab,carboplatin,and etoposide in extensive-stage small-cell lung cancer(IMpower133):a randomized phase Ⅰ/Ⅲ trial[J].Annals of Oncology,2020,31(2):310-317.
[17] READY N,FARAGO A F,DE BRAUD F,et al.Third-Line Nivolumab Monotherapy in Recurrent SCLC:CheckMate 032[J].Journal of Thoracic Oncology,2019,14(2):237-244.
[18] OTT P A,BANG Y J,PIHA-PAUL S A,et al.T-cell-inflamed gene-expression profile,programmed death ligand 1 expression,and tumor mutational burden predict efficacy in patients treated with pembrolizumab across 20 cancers:KEYNOTE-028[J].Journal of Clinical Oncology,2019,37(4):318-327.
[19] GARON E B,RIZVI N A,HUI R,et al.Pembrolizumab for the Treatment of Non-Small-Cell Lung Cancer[J].New England Journal of Medicine,2015,372(21):2018-2028.
[20] NICOLAZZO C,RAIMONDI C,MANCINI M,et al.Monitoring PD-L1 positive circulating tumor cells in non-small cell lung cancer patients treated with the PD-1 inhibitor Nivolumab[J].Scientific Reports,2016,6:31726.
[21] GADGEEL S M,PENNELL N A,FIDLER M J,et al.Phase Ⅱ Study of Maintenance Pembrolizumab in Patients with Extensive-Stage Small Cell Lung Cancer(SCLC)[J].Journal of Thoracic Oncology,2018,13(9):1393-1399.
[22] GANDARA D R,PAUL S M,KOWANETZ M,et al.Blood-based tumor mutational burden as a predictor of clinical benefit in non-small-cell lung cancer patients treated with atezolizumab[J].Nature Medicine,2018,24(9):1441-1448.
[23] HELLMANN M D,CALLAHAN M K,AWAD M M,et al.Tumor Mutational Burden and Efficacy of Nivolumab Monotherapy and in Combination with Ipilimumab in Small-Cell Lung Cancer[J/OL].Cancer Cell,2018,33(5):853-861,e4.
[24] WANG W,HODKINSON P,MCLAREN F,et al.Small cell lung cancer tumour cells induce regulatory T lymphocytes,and patient survival correlates negatively with FOXP3+ cells in tumour infiltrate[J/OL].International Journal of Cancer,2012,131(6):E928-E937.
[25] MATOZAKI T,MURATA Y,OKAZAWA H,et al.Functions and molecular mechanisms of the CD47-SIRPαsignalling pathway[J].Trends in Cell Biology 2009,19(2):72-80.
(收稿日期:2021-05-31) (本文編辑:田婧)
