一个普通化学实验:简易光伏电池的制作
2022-03-30马艳子马锴果贾莉王海荭李维红
马艳子,马锴果,贾莉,王海荭,李维红
北京大学化学与分子工程学院,化学国家级实验教学示范中心,北京 100871
普通化学实验是北京大学为化学学院本科一年级新生开设的核心课程,是化学类实验实践教学体系中最为基础的课程。该门课程通过经典实验引导学生学习实验相关理论知识、基本实验技能、实验室规范和统筹安排时间的方法,进而培养学生观察、思考和实践的能力[1]。如何在基础实验课中更好地激发学生兴趣,拓展学生视野,将普通化学理论课中的原理及配套的经典实验与前沿研究领域相关联,一直是我们在开发教学实验时关注的重点。光伏电池的概念虽然在19世纪就已提出,但在目前能源危机日益加重的形势下,光伏电池仍旧是一个非常活跃的研究领域。有关光伏电池制作的教学实验在国内外已有介绍和开设,涉及的电池类型包括:固态p-n结光伏电池[2]、染料/半导体敏化光伏电池[3-8]、量子点光伏电池[9]、钙钛矿光伏电池[10,11],有机光伏电池[12]等等,后四种电池属于新型光伏电池,其结构特点类似。虽然电池制作通常涉及多个环节及多学科技术,通常在高年级本科生的综合实验中开设,但近年来已有一部分经过简化设计的专门为低年级学生开设的实验项目,这类实验的实验流程和实验操作相对简单,实验时间短,目的是让学生能够通过实验结合半导体基本概念理解某一光伏电池的工作原理。
借鉴文献经验,结合本校普通化学实验课实际情况,我们对光伏电池制作的实验内容进行了重新设计与整合,在普通化学实验课程中开设了一个“简易光伏电池制作”的项目。实验包含两种类型电池的制作,一种为传统的基于p-n结结构的硫化铜/硅光伏电池,另一种为模仿光合作用原理的染料敏化光伏电池。前一种电池的重点是将半导体材料CuS镀在硅片上,这一过程与普通化学实验中“酸碱和沉淀溶解平衡”实验项目中的内容有关[13],学生在制作光伏电池中不仅要运用到前面实验所掌握的知识和技能,还需要考虑实验条件的控制使镀层更加致密,实验中也涉及了半导体能级和吸收光谱等内容,能加深学生对普通化学原理中所讲授内容[14]的理解。同时,染料敏化光伏电池内在的工作机制涉及了许多氧化还原反应,也是普通化学原理的重要内容。我们希望通过该实验的教学,实现如下教学目的:
(1)了解沉淀溶解平衡、元素性质等基本化学原理在制作光伏电池这类实际的功能器件上的具体应用,使学生体会普化实验所涉及的内容与化学前沿间的相关性。
(2)通过亲手组装简易光伏电池,使学生对半导体、能带理论、光伏效应等抽象概念有一定的感性认识,使学生了解化学过程与光、电现象之间的本质联系。
1 实验背景与原理简述
在能源短缺、环境污染日益严重的现代社会,太阳能的利用一直是人们研究的热点。光伏电池是一类将光能直接转化为电能的装置,经过数十年的研发,已有很多种类的光伏电池用于实际生活和生产中。本实验中将制作两种结构具有代表性的光伏电池,硫化铜/硅光伏电池和N719染料敏化的光伏电池。
光照下,光伏电池中的光敏材料吸收光能产生光生电子-光生空穴对,随后,光生电子和光生空穴被分离,并分别迁移到光伏电池的负极和正极上。在硫化铜/硅光伏电池中,硫化铜是p型半导体,硅(掺磷)是n型半导体,两者接触处形成p-n结(图1a)。光敏材料吸收光子产生光生电子-光生空穴对,在电池内建电场的作用下,光生电子和光生空穴在p-n结处分离,之后光生电子由硅导出至负极,光生空穴由硫化铜导出至正极。在以N719染料(二-四丁基铵-双(异硫氰基)双(2,2’-联吡啶-4,4’-二羧酸)钌(II))为敏化剂的光伏电池中,N719染料分子吸附在TiO2光阳极上(电池负极),光阳极和涂有石墨的对电极(电池正极)间填充电解液(图1b)。光照下,敏化剂吸收光能产生光生电子和光生空穴对,光生电子由TiO2光阳极导出,光生空穴(处于氧化态的染料正离子)则被由对电极导入、电解液传输的电子还原,即染料正离子得到电子而被再生。

图1 (a)硫化铜/硅光伏电池结构图(上)及工作原理图(下);(b)染料敏化光伏电池的结构图(上)及工作原理图(下)
2 实验部分
2.1 材料、试剂与仪器
试剂:硫酸铜(0.2 mol·L-1),硫代乙酰胺(0.5 mol·L-1),硫代硫酸钠(0.5 mol·L-1),N719染料乙醇溶液(5 × 10-4mol·L-1),二氧化钛浆料(1 g/4 mL),碘系电解液(70 mol·L-1),氟化钠-盐酸清洗液,中性镀膜玻璃清洗液。其中二氧化钛浆料配制方法为:用4 mL去离子水、0.40 g PEG-20000、0.4 mL乙酰丙酮及1滴Triton-100配成混合液,取P25粉体1.00 g,在搅拌下,缓慢倒入上述混合液中,超声,至混合物成为粘稠的浆状[15],亦可直接购买商品浆料。碘系电解液:AN-I,奥匹维特,成分为碘、无水碘化锂、1-丙基-3-甲基眯唑碘盐(PMII)、异硫氰酸胍、磷酸三丁酯(TBP)、乙腈。氟化钠清洗液配制方法为每百毫升水溶解1.05 g氟化钠,随后加入浓盐酸1.5 mL,相当于氟化氢含量为1%。中性镀膜清洗液:OPV-FCL,奥匹维特,为固体盐类和聚氧乙烯醚等非离子表面活性剂复配而成,稀释为2%溶液使用。
材料:n型单晶硅片(晶向<100>,2-4 Ω·cm-1,20 × 12 mm,单面抛光),ITO (氧化铟锡)玻璃(20 × 12 mm,其中导电部分为纵向居中6 × 18 mm,方阻≤ 15 Ω·cm-1,透过光率≥ 86%),FTO (氟掺杂氧化锡)玻璃(6-8 Ω·cm-1,20 × 25 mm),长尾夹,棉签,光面纸,胶带,滤纸,2B铅笔,镊子,尺子,工具刀,剪刀,带盖小塑料盒,铝箔,双头鳄鱼夹导线等。
仪器:电磁力加热搅拌器(IKA,RH Basic 1),万用表(UT61B),强光手电筒(10 W)。拓展实验选用仪器有:X射线粉末衍射仪(Malvern Panalytical,x’pert3 powder),扫描电镜(JEOL,JSM-IT300)。
2.2 硫化铜/硅光伏电池的制作
(1)清洗硅片(此步骤由实验室完成):将n型单晶硅片批量置于清洗架上,浸于丙酮中超声15 min,去离子水洗净后,再浸于NaF/HCl清洗液在75 °C超声10 min。取出后去离子水洗净,并浸于去离子水中备用。
(2)配制CuS前驱物溶液:有两种方案可供选择。
方案一:在合适的容器中依次加入0.2 mol·L-1硫酸铜溶液1 mL,去离子水2 mL,0.5 mol·L-1硫代乙酰胺溶液3 mL,搅拌均匀。
方案二:在合适的容器中依次加入0.2 mol·L-1硫酸铜溶液1 mL,去离子水1 mL,0.5 mol·L-1硫代硫酸钠溶液4 mL,搅拌均匀。
(3)制备CuS薄膜:将硅片光面朝上置于50 mL烧杯底部,缓慢倒入一种前驱物溶液,烧杯盖上表面皿后置于85-90 °C水浴中。观察CuS薄膜在烧杯壁上沉积的现象。经过一段时间(约10 min)后,取出烧杯,用滴管小心吸除反应液后取出硅片,分别用去离子水和乙醇小心冲洗,按图2a用棉签擦出CuS镀层图案(注意其宽度略大于ITO玻璃导电部分宽度),晾干。
(4)组装硫化铜/硅光伏电池:小心拿取一片ITO导电玻璃(拿取时勿用手大面积接触,以免污染),用万用表测出ITO玻璃的导电部分(图2b),将硅片的CuS镀层覆盖于ITO的导电部分之上,保证硅片的无CuS镀层部分与ITO玻璃导电部分没有接触,用长尾夹固定。
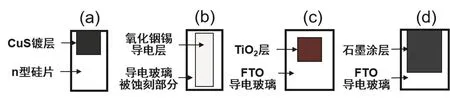
图2 硫化铜/硅光伏电池的p-n结Si片(a)和ITO导电玻璃(b);染料敏化光伏电池的光阳极(c)和对电极(d)
2.3 染料敏化光伏电池的制作
(1)清洗FTO导电玻璃(此步骤由实验室完成):将FTO导电玻璃置于中性镀膜清洗液中在50 °C超声10 min,再用去离子水超声10 min,烘干备用。
(2)制备光阳极:染料敏化光伏电池中的TiO2光阳极需要非常均匀地涂敷在FTO导电玻璃上。制作方法如下:小心取出一片FTO导电玻璃,在其导电面的居中靠上位置(图2c),用胶带(可用双层)做出一个约1 × 1 cm的方形凹槽,尽量将胶带与玻璃贴紧以保证凹槽四周密实不漏液。向方形凹槽内滴半滴左右TiO2浆料,使液面恰好与胶带边沿相平,切勿加得过多,以免干燥过程中TiO2层开裂。静置约20 min,待溶剂完全自然挥发干后,小心揭掉胶带,涂有TiO2的一面向上将其置于坩埚中,用天然气灯加热坩埚,当浆料由白色变为棕黑色再变为白色时停止加热。或将坩埚置于500 °C马弗炉内加热10 min。待坩埚完全冷至室温后,取出FTO玻璃,即得光阳极。
(3)制作N719染料敏化光阳极:取带盖塑料小盒,使涂有TiO2的一面向上,将光阳极平放于其中,小心加入5 × 10-4mol·L-1N719染料的乙醇溶液至光阳极全部浸入其中,盖好盒盖,用铝箔包好,避光放置30 min以上。用专用镊子取出光阳极,用乙醇小心冲洗,置于滤纸上自然晾干,得到N719敏化的光阳极。
(4)制作对电极:再取一块FTO导电玻璃,在导电面上用2B铅笔将2/3部分涂黑,如图2d所示,即为对电极。
(5)制作N719染料敏化光伏电池:将滤纸剪成约1 × 1 cm大小,置于光阳极的TiO2层上,向滤纸上滴加1滴碘系电解液,按照图1b组装光伏电池。注意,要将对电极涂有石墨的导电层与光阳极涂有TiO2的导电层(TiO2)相对,用长尾夹固定。
2.4 光伏电池的电学测试
将光伏电池、电压表(万用表毫伏档)、电流表(万用表毫安档)及开关用导线按图3a连接。将电池吸光层面朝上置于强光手电下,电池距手电约1 cm,如图3b固定。断开开关,打开手电,调节光源强度,观察电压表示数正负值与绝对值变化。手电置于强光档,记录当前光照强度下电池的开路电压Voc,合上开关,记录当前光照强度下电池的短路电流Isc。
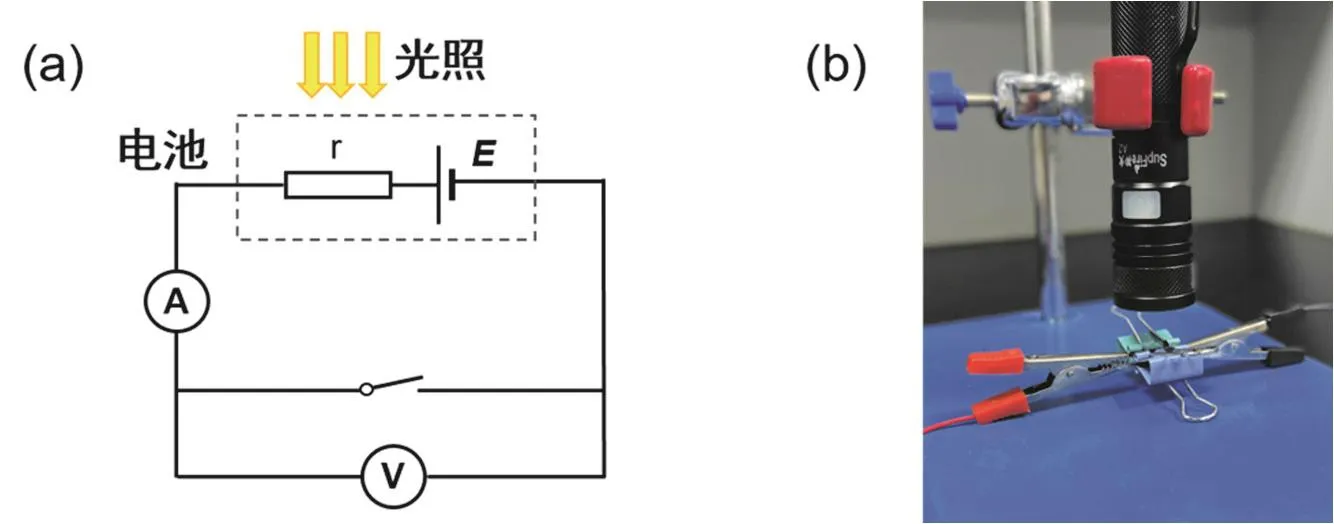
图3 光伏电池测试电路(a)及电池与光源的固定方式(b)
3 安全提示
实验要求学生全程穿着实验服,佩戴护目镜,加热操作佩戴隔热手套。加热后的坩埚、铁圈及FTO玻璃温度都很高,要求学生一定等它们完全冷却至室温后再进行其他操作。使用天然气灯前确保周围无可燃液体。硫代乙酰胺为2B类致癌物,涉及该试剂的实验操作务必在通风橱进行。含铜及硫的混合废液需倒入非浓酸环境的重金属离子废液桶,以避免硫化氢的释放。实验准备时,二氧化钛浆料的配制注意佩戴防尘口罩防止吸入肺部,含氟洗液清洗硅片需小心操作,避免洗液溅出。
4 实验结果与定性解释
按上述实验流程制作的两种光伏电池在光照下均可产生光伏效应。表1为实验室教师按本实验条件测试所得不同光伏电池的开路电压Voc及短路电流Isc,它们是反映光伏电池性能的重要参量。在测量两种电池的过程中,学生可观察到,电压表显示的正负值与光伏电池工作原理中阐述的电子流向一致,并可发现,光照强度越大,电池的开路电压和短路电流越大。根据能带填充模型[13],价带顶部的电子受光激发先填充到导带的底部,当这些能级占满后,对于价带剩下的电子,其有效带隙增大,光照增强或光照时间增加都会使得开路电压增大;同时,光照越强,光生载流子越多,光电流越大。因此学生可以观察到,打开光源一段时间内,电压表与电流表示数不稳定,且呈下降趋势,这主要是由于手电光源强度不稳定造成的。随着电池被光源照射的时间延长(此时光源已趋于稳定),开路电压仍会稍有下降,这可能是由于持续光照导致电池表面温度升高,进而使得半导体材料费米能级下降,带隙减小。从表1中可以看出,在相同测试条件下,硫化铜/硅和染料敏化两类光伏电池的开路电压和短路电流都存在明显差别,染料敏化电池比硫化铜/硅电池的开路电压高60%以上,反映出两类电池光敏材料的禁带宽度有明显差别;硫化铜/硅电池的短路电流明显低于染料敏化光伏电池的短路电流,可能是由于CuS镀膜工艺造成电池内阻较大。从已有数据来看,固态光伏电池的两种制备方案对其开路电压和短路电流造成的影响不大。

表1 两种方案制备的硫化铜/硅光伏电池及染料敏化光伏电池的性能参数
5 教学组织与讨论
本实验设计为4学时的单元教学实验,教学过程包括原理讲解、操作演示、学生实验、课堂讨论四部分,要求学生在3.5 h完成。学生两人一组进行实验,每组同学完成硫化铜/硅光伏电池和N719染料敏化光伏电池的制作,并进行简单的电池电学测试。由于每块电池在制作过程中都需要等待一定时间,因此需向学生强调实验过程的统筹安排。
对于面向一年级本科生的普通化学实验教学,讲解两类电池工作原理时,只需做到让学生简单了解到光伏电池的光电转换过程即可,推荐从它们的共性出发,即如何通过一定材料和相应结构实现光生电子-光生空穴对的产生与分离,明确随后产生的光生电子均为从高能级至低能级的跃迁路径,并经由外电路回到电池内部与处于氧化态的物质结合,形成电池回路。重点是通过实验引发学生思考电池制作和工作过程中所涉及的基本化学问题,使学生对普通化学基础知识应用于实际有一定的认识。具体可有如下方面:
(1)硫化铜/硅光伏电池的原理。这类半导体光伏电池的关键是p-n结的形成。本实验采用的是化学沉积法将p型半导体硫化铜以纳米晶的形式生长在n型半导体单晶硅上。其中掺磷的n型硅片为现成的商品,通过提拉法得到,学生直接在硅片上制备的CuS薄膜为p型半导体。在本征半导体中掺杂杂原子使其价带缺失电子形成空穴即是p型半导体,p型半导体也常见于低价的d区金属硫化物或卤化物[16]。对于CuS而言,虽然分子式看起来很简单,但通过分析可知其结构中含过硫键,实际上是一种混合价态的化合物,其中的一价铜原子易失去电子,形成空穴,显示出p型半导体的特征[17]。CuS作为半导体,可以应用于光伏电池的制作中,打破学生认为的“硫化铜仅为一种溶解度很低的黑色沉淀”这种固有观念。
(2)硫化铜前驱体溶液的配制比例基本参照《普通化学实验(第3版)》[2]实验“沉淀溶解平衡”中4.3节内容。在“沉淀溶解平衡”的这部分实验内容中,pH 4.8的醋酸缓冲体系下,CuS生成速度很快,以黑色无定型颗粒沉淀下来;而非缓冲条件下则会在器壁上生长出蓝色金属光泽的镀层,即硫化铜的纳米晶“铜蓝”。学生在实验过程中总会对此现象充满好奇,但上述实验主要讨论的是不同条件下硫化物是否能沉淀完全的问题,“铜蓝”的出现并不会影响该实验的结论。在光伏电池的制作实验中,学生则可以仔细考虑上一个实验的“异常现象”,根据沉淀溶解平衡的原理,通过选择不同硫源,调控铜源和硫源的比例,是否加入其他配体如EDTA,控制温度和pH等条件,从而得到厚度不同、均匀度不同的铜的硫化物(CuxS)纳米晶层,进而影响到电池性能[18]。这可以使学生明白,普通化学实验中看似简单的化学原理和不断强调的实验条件控制,在前沿的研究领域中也是很重要的。图4为本教学实验条件下在硅片上制备的硫化铜薄膜的微观结构,显示采用不同硫源制备的硫化铜均呈六方纳米片垂直堆积的花瓣状交错结构。采用S2O32-离子作为硫源生长出的纳米片较硫代乙酰胺作为硫源的纳米片更厚且更长。经X射线粉末衍射(PXRD)测定,两种方案制备出的铜的硫化物均为铜蓝相(Covellite),即CuS。

图4 方案一(a)及方案二(b)制备条件下硫化铜薄膜表面的SEM图
(3)相比于硫化铜/硅光伏电池,敏化光伏电池的结构组成较为复杂。其中关键的一部分在于半导体TiO2层与敏化剂的能级匹配,即敏化剂的激发态能级要高于TiO2的导带能级,这样才可以实现光生电子注入于TiO2的导带。在实验中的敏化剂N719染料溶液颜色为深紫红色,摩尔消光系数非常大,对可见光几乎能够做到全谱吸收,在条件允许的情况下,学生也可以使用不同色光照射N719染料敏化的光伏电池,观察其开路电压的响应。
(4)为了确保光生电子有效地注入TiO2的导带,还需要敏化剂以化学吸附的形式与TiO2结合,也就是它们之间能够形成稳定的化学键。对于N719染料这种钌基配合物,其配体上的羧基在室温下能够与TiO2表面的羟基形成酯键[19]。实验时,学生在用乙醇冲洗光阳极时,可以观察到乙醇是无法把染料冲掉的,通常需要采用NaOH/EtOH溶液才能将染料脱附[20]。学生可由此拓展配位化学的知识。
(5)在同样的光照强度下,能够使光阳极上有更多的光生电子产生也是相当重要的。实验中采用比表面很大的TiO2纳米晶粉体(比表面积为55 ±15 m2·g-1),相比于普通的TiO2粉末,载有纳米级TiO2的光阳极对敏化剂的吸附率更大。另一方面,对于实验中烧结的步骤,不仅可以使TiO2粉体附着在FTO玻璃上,还能够借助浆料中的有机物,使其在煅烧过程中形成介孔,从而进一步增大TiO2对敏化剂的吸附。此外,经过一段时间的灼烧,也有助于TiO2表面羟基的活化,使敏化剂能够更好地与TiO2结合。这些实验过程和操作可有助于学生了解为达到同一目的,可以采用多种手段协同作用。
(6)两种电池的制作均在较短时间内完成,实验流程缩短了一些关键性步骤的时间,为非优化的实验条件,如CuS的生成及其在硅片上的沉积,TiO2对染料的吸附等,且电学测试并无绝对统一标准,如光源强度、距离、角度、吸光面积等,因此学生测得的电池数据在一定范围内存在差异不作为讨论点。然而,有学生制作的电池测得的开路电压和短路电流明显较低,如测得硫化铜/硅光伏电池短路电流小于20 μA,染料敏化光伏电池短路电流在100μA数量级。对于硫化铜/硅光伏电池可考虑硅片上附着的CuS太少,通常是由于反应温度不够或硅片表面处理不得当造成的,也可能是电池内部局部出现短路造成的;对于染料敏化光伏电池可考虑TiO2层过厚,电池吸光面附近的TiO2未吸附到染料,此外,长期放置其电解液干涸也会造成电池无法正常工作。
6 结语
本实验设计为面向大学一年级学生的教学实验,也是光伏电池领域的一个入门级实验,在普通化学实验室的基本配备及设施下即可完成两种代表性光伏电池的制作。该教学实验已试运行三学期,得到了学生良好的反馈。在实验中,将光伏电池与化学密切相关的问题引入到课堂,提高了学生学习普通化学实验的趣味性,学生能够对化学的一些基本原理应用于实际场景有较为综合的认识,并产生对某一具体化学问题深入学习和探究的动力。结合微控制器编程,学生还可根据制备的电池特性将它们用作光敏传感器组装感光装置[5]。此外,在此基础上,继续开发相关的高阶课程实验项目,引入进阶的理论及实验技术,如无机实验中进行可控尺寸、形貌的薄膜或半导体纳米晶的制备;仪器分析实验中对电池材料的成分、结构进行分析;物理化学实验中对电池光电转化性能进行测试、简易恒电位仪的搭建等等,使光伏电池的制作发展为一个可以贯通不同实验课程的综合创新实验。
