水产动物异亮氨酸营养研究进展
2022-03-30李晋南王连生
李晋南 王 良 王连生*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江省水生动物病害与免疫重点实验室,哈尔滨150070;2.潍坊加易加生物科技有限公司, 潍坊261100)
异亮氨酸是支链氨基酸(branch-chain amino acid,BCAA)中唯一的生糖兼生酮氨基酸[1-2],与缬氨酸和亮氨酸一样具有由甲基侧链形成的分支结构[3],由Ehrlich发现并提取,其理化性质与亮氨酸差别较大,但化学组成相同,结构式为“α-氨基-β-甲基戊酸”,被认为是有别于亮氨酸的一种氨基酸,故将其定名为异亮氨酸。异亮氨酸在机体的生命活动中起重要的作用,其能够促进蛋白质的合成,并抑制蛋白质的分解;促进机体合成需要的激素或酶类,如胰岛素和生长激素等[4];作为谷氨酰胺合成的底物,调节氨基酸代谢,为机体提供能量[5]。本文将对水产动物异亮氨酸营养研究进展进行综述,包括水产动物异亮氨酸需要量以及异亮氨酸在水产动物蛋白质代谢、免疫、抗氧化功能、肠道发育和肉质等方面的作用,以期为异亮氨酸在水产动物饲料中的应用提供借鉴。
1 水产动物异亮氨酸需要量
异亮氨酸作为必需氨基酸之一,饲料中异亮氨酸的缺乏会降低水产动物的生长性能和蛋白质效率,增加饲料系数[6-7]。基于生长试验得出的水产动物异亮氨酸需要量见表1,由表可知,水产动物异亮氨酸需要量因品种、规格以及评价指标的不同而不同,鱼类对异亮氨酸的需要量为0.62%~1.98%,虾蟹类对异亮氨酸的需要量为1.01%~2.25%,而仿刺参对异亮氨酸的需要量为0.98%。不同品种的水产动物对异亮氨酸的需要量差别较大,斑点叉尾(Ictaluruspunctatus)对异亮氨酸的需要量仅为0.62%[8],而中华绒螯蟹(Eriocheirsinensis)对异亮氨酸的需要量则为2.25%[9]。而同一品种不同规格的水产动物对异亮氨酸的需要量也不同,体重为8.25和256.80 g的草鱼(Ctenopharyngodonidellus)对异亮氨酸的需要量分别为1.46%[10]和1.21%[11];体重为0.61和1.20 g的印度鲤鱼(Catlacatla)对异亮氨酸的需要量分别为1.13%[12]和0.94%[13];而小规格(0.087 g)的尼罗罗非鱼(Oreochromisniloticus)对异亮氨酸的需要量低于大规格(1.24 g)的尼罗罗非鱼[14-15]。评价指标的不同对异亮氨酸的需要量也有一定的影响印度鲮(Cirrhinusmrigala)经二次多项式模型分析后,评价指标为增重率、蛋白质效率和饲料系数时,得出异亮氨酸的需要量分别为1.32%、1.21%和1.23%[6];大黄鱼(Pseudosciaenacrocea)经二次多项式模型分析后,以增重率和饲料系数为评价指标,得出异亮氨酸的需要量分别为1.71%和1.59%[16]。

表1 水产动物异亮氨酸需要量(生长试验)

续表1项目 Items体重Bodyweight/g模型 Model评价指标Evaluation indicator需要量 Requirement占饲料干物质的百分比 Percentage of dietary dry matter/%占饲料蛋白质的百分比Percentage of dietary protein/%参考文献Reference大黄鱼 Large yellow croaker (Pseudosciaena crocea)6.00二次多项式模型特定生长率1.713.98饲料效率1.593.70李燕[16]尼罗罗非鱼 Nile tilapia (Oreochromis niloticus)0.087折线模型增重率0.873.11Santiago等[14]2.46折线模型增重率1.375.00Araújo等[15]18.09方差分析增重率0.702.50Neu等[24]吉富罗非鱼 Nile tilapia (Oreochromis niloticus)49.12二次多项式模型增重率1.474.52特定生长率1.474.52蛋白质效率1.444.43蛋白质沉积率1.444.43饲料系数1.434.40孙玉轩[25]遮目鱼 Milkfish (Chanos chanos Forsskal)0.32折线模型增重率1.604.00Borlongan等[26]乌鳢 Snakehead (Channa punctatus)6.74二次多项式模型增重率1.814.01饲料系数1.824.04蛋白质沉积率1.844.09异亮氨酸沉积率1.803.99Sharf等[27]美国红鱼 Red drum (Sciaenops ocellatus)3.68二次多项式模型增重率1.113.00Castillo等[28]红鳍东方鲀 Tiger puffer (Takifugu rubripes)29.00二次多项式模型蛋白质沉积率1.93鱼体粗蛋白质含量1.83—肌肉异亮氨酸含量1.96孙志远等[29]大鳞大麻哈鱼 Chinook salmon (Oncorhynchus tschawytscha)0.98折线模型增重率0.90~1.102.20~2.70Chance等[30]杂交石斑鱼 Hybrid grouper (Epi-nephelus fuscoguttatus ♀×Epinephelus lanceolatus)6.00二次多项式模型增重率1.983.99Zhou等[31]虹鳟 Rainbow trout (On-corhynchus mykiss)47.00二次多项式模型增重率1.404.00Rodehutscord等[32]湖鳟 Lack trout (Salveli-nus namaycush)3.20方差分析增重率0.722.06Hughes等[33]斑点叉尾 Channel cat-fish (Ictalurus punctatus)200.00折线模型增重率0.622.58Wilson等[8]

根据Kaushik等[38]的方法,将表1中列出的水产动物异亮氨酸需要量进行了Meta分析。如图1所示,将增重率进行标准化响应处理后与异亮氨酸需要量进行回归分析,得到二次多项式回归分析模型:y=-43.131x2+130.21x+1.514 9,R2=0.974 6(占饲料干物质的百分比,图1-A);y=-5.319 5x2+45.502x+0.516 4,R2=0.981 5(占饲料蛋白质的百分比,图1-B)。以增重率为评价指标,经计算得到水产动物对异亮氨酸的需要量为占饲料干物质的1.51%,占饲料蛋白质的4.28%。

图1 水产动物异亮氨酸需要量与增重率之间的关系分析
此外,关于氨基酸需要量的研究方法,除了比较常用的利用生长试验测定以外,还有氨基酸氧化法、析因法、氮平衡法等[39]。在水产动物上,近年来Hua等[40]利用析因法研究了大西洋鲑(Salmosalar)和虹鳟的异亮氨酸需要量。Walton等[41]利用氨基酸氧化法计算了虹鳟的赖氨酸需要量,而Kim等[42]认为该方法不适合对虹鳟苯丙氨酸需要量进行测定,而利用该方法检测水产动物异亮氨酸需要量的文献还未见报道。研究者利用氮平衡方法研究得出吉富罗非鱼的异亮氨酸需要量为占饲料蛋白质的3.26%[43]。此外,利用全鱼氨基酸组成或肌肉氨基酸组成来评估必需氨基酸需要量的方法具有节省时间和成本的优势,通常以A/E[A/E=(单一必需氨基酸量/必需氨基酸总量)×1 000]值作为评价指标。通过该方法测定的不同品种鱼对异亮氨酸的需要量为占饲料干物质的0.47%~1.40%,占饲料蛋白质的2.00%~3.44%(表2)。
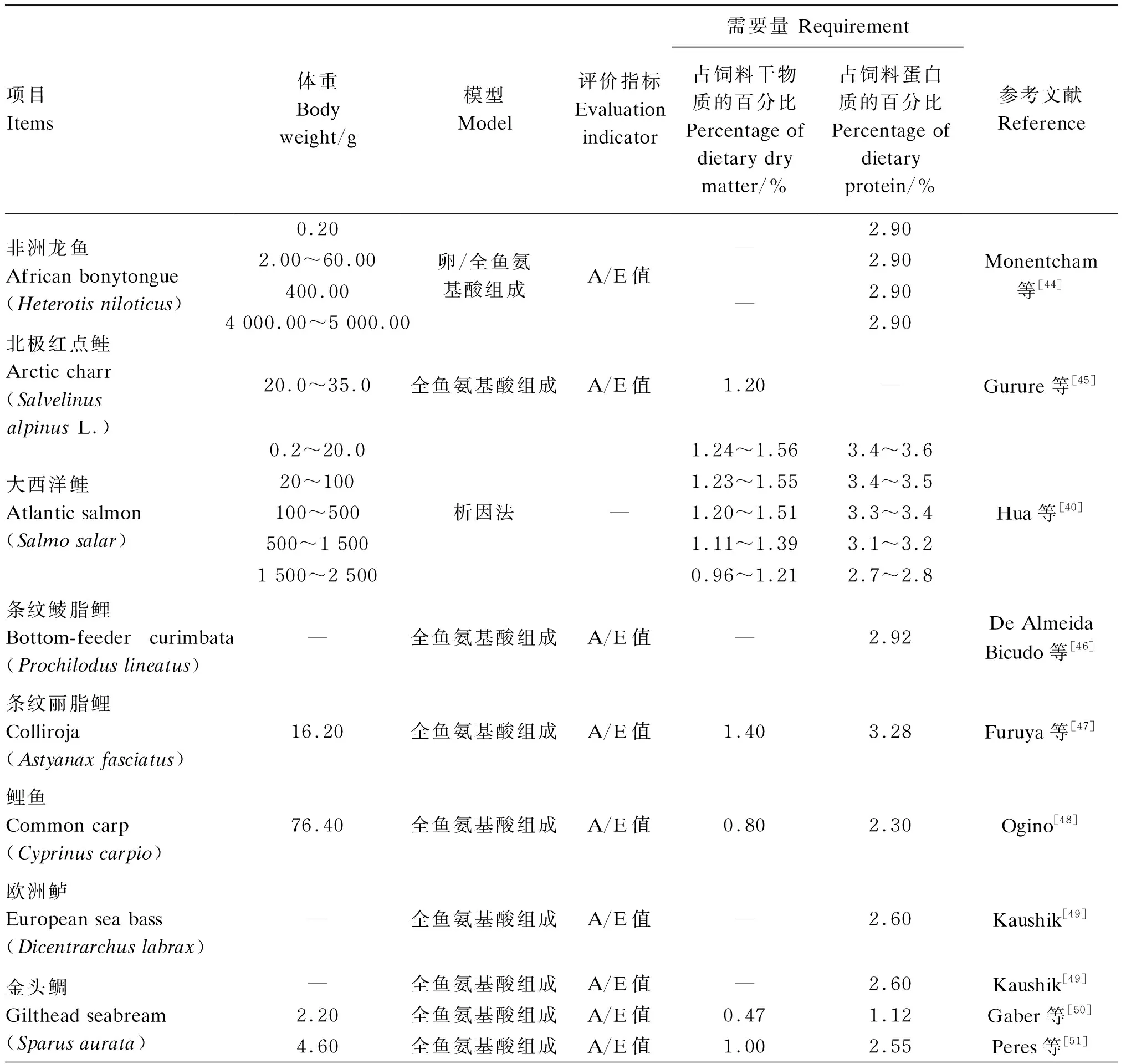
表2 水产动物异亮氨酸需要量(其他方法)

续表2项目 Items体重Bodyweight/g模型 Model评价指标Evaluation indicator需要量 Requirement占饲料干物质的百分比 Percentage of dietary dry matter/%占饲料蛋白质的百分比Percentage of dietary protein/%参考文献Reference银鲳参鱼 Plata pompano (Trachinotus marginatus)25.03全鱼/肌肉氨基酸组成A/E值—1.61~1.78Tesser等[52]牙鲆 Japanese flounder(Paralichthys olivaceus)3.00全鱼氨基酸组成A/E值1.002.00Forster等[53]亚马逊石脂鲤 Matrinxã(Brycon amazonicus)—全鱼氨基酸组成A/E值—3.08De Almeida Bicudo等[46]尼罗罗非鱼 Nile tilapia (Oreochromis niloticus)4.31全鱼氨基酸组成A/E值1.153.44Ogunji等[54]吉富罗非鱼 GIFT (Oreochromis niloticus)20.40全鱼氨基酸组成A/E值0.882.84Diógenes等[55]158.78氮平衡蛋白质效率—3.26Do Nascimento等[43]锯腹脂鲤 Pacu (Piaractus mesopotamicus)54.30822.501 562.80全鱼氨基酸组成A/E值0.820.810.85—Khan等[56]贝尔鲑脂鲤 Pebbly fish(Alestes baremoze)—全鱼氨基酸组成A/E值—2.40~2.45Kasozi等[57]虹鳟 Rainbow trout (Oncorhynchus mykiss)0.2~20.020~100100~500500~1 500析因法1.09~1.373.0~3.11.07~1.353.0~3.10.99~1.252.80.75~0.952.1~2.2Hua等[40]126全鱼氨基酸组成A/E值0.92.4Ogino[48]美国红鱼 Red drum—肌肉氨基酸组成A/E值1.002.90Moon等[58]真鲷 Red sea bream (Pagrus major)1.70全鱼氨基酸组成A/E值1.102.20Forster等[53]银鲳鱼 Sliver pomfret (Pampus argenteus)—全鱼氨基酸组成A/E值—2.00Hossain等[59]条纹鲈 Striped bass (Morone saxatilis)111.00790.00全鱼氨基酸组成A/E值0.902.50Small等[60]大鳞鲆 Turbot (Psetta maxima)—全鱼氨基酸组成A/E值—2.60Kaushik[49]高首鲟 White sturgeon (Acipens-er transmontanus)66.70全鱼氨基酸组成A/E值1.302.99Ng等[61]
2 异亮氨酸与其他支链氨基酸的相互作用
支链氨基酸在通过细胞膜时会竞争载体,因而,饲料中支链氨基酸的失衡会导致动物生长性能或免疫功能的下降[62]。关于支链氨基酸的拮抗作用在单胃和瘤胃陆生动物中已经进行了报道[63],但其在水产动物中相互作用的结果却没有统一结论[64]。对斑点叉尾的研究表明,血清中缬氨酸和异亮氨酸含量在亮氨酸缺乏的试验组中显著增加[8]。另外,饲料中异亮氨酸或缬氨酸含量的增加引起了血清中支链氨基酸含量的变化。对大鳞大麻哈鱼的研究表明,其对异亮氨酸的需要量是随着饲料中亮氨酸含量的增加而增加的[30]。在对牙鲆(Paralichthysolivaceus)的研究中发现,在高异亮氨酸试验组中,牙鲆的增重率随缬氨酸含量的升高而显著升高,而在低异亮氨酸组中则没有该现象[65];而在亮氨酸与异亮氨酸相互作用的中研究发现,以生长为评价指标,在低亮氨酸(2.58%)饲料中,牙鲆幼鱼的生长性能随着异亮氨酸的添加量的增加而显著提高,但在高亮氨酸(4.44%)饲料中添加异亮氨酸其生长性能随着异亮氨酸添加量的增加而显著下降,产生了拮抗作用;生长性能表现最佳的组为低亮氨酸-高异亮氨酸组和高亮氨酸-低异亮氨酸组[66]。在虹鳟[41]和湖鳟[33](Salvelinusnamaycush)的研究中发现,异亮氨酸和亮氨酸存在拮抗作用。但Choo等[67]认为过量亮氨酸对虹鳟鱼生长的抑制和形态异常不是由于支链氨基酸的拮抗作用,而是由于过量亮氨酸本身的毒性作用。在斑点叉尾中,当饲料中3种支链氨基酸满足要求时,支链氨基酸之间没有发生拮抗作用[68],在尼罗罗非鱼的研究中也发现同样的现象[15]。目前研究表明,尼罗罗非鱼的支链氨基酸最优比值是异亮氨酸∶亮氨酸∶缬氨酸=1∶1.3∶0.9[15],印度鲮[6]的支链氨基酸最优比值是异亮氨酸∶亮氨酸∶缬氨酸=1∶1.2∶1.2,杂交石斑鱼的支链氨基酸最优比值是异亮氨酸∶亮氨酸∶缬氨酸= 1∶1.7∶1.4[31]。
3 异亮氨酸的生理功能
3.1 异亮氨酸对蛋白质代谢的影响

3.2 异亮氨酸对机体免疫功能的影响
异亮氨酸在提高非特异性免疫细胞功能和免疫因子活性方面起到了重要的作用。非特异性免疫细胞包括树突状细胞、吞噬细胞和杀伤细胞等,免疫因子包括补体(complement,C)、酶类物质、白细胞介素(interleukin,IL)等,它们在抵挡入侵的病原体中发挥着重要的作用[77]。异亮氨酸可以增强吞噬细胞的吞噬和杀菌能力,在建鲤(Cyprinuscarpiovar. Jian)的研究中表明,其能提高头肾指数以及血清中白细胞数量、白细胞的吞噬能力和免疫球蛋白M的含量[20];对牙鲆的研究表明,适宜水平的异亮氨酸可以提高头肾的呼吸爆发活性[78]。研究表明,适宜水平的异亮氨酸能够提高牙鲆[78]、吉富罗非鱼[25]、卵形鲳鲹(Trachinotusovatus)[79]、建鲤[20]血清中溶菌酶、酸性磷酸酶活性以及C3和C4含量,从而提高机体非特异性免疫功能。目前关于异亮氨酸对鱼类炎症因子的影响仅有少量报道。在草鱼的研究中发现,异亮氨酸显著抑制了其鳃中由巨噬细胞分泌的促炎因子——肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-8(interleukin-8,IL-8)的表达,显著促进了抗炎因子白细胞介素-10(interleukin-10,IL-10)和转化生长因子-β(transforming growth factor-β,TGF-β)的表达[17]。Zhao等[20-21]对建鲤的研究表明,饲料中添加适宜水平的异亮氨酸可以改善建鲤的免疫反应,促进肠道和头肾TGF-β的表达,抑制TNF-α的表达,同时发现,异亮氨酸可以提高草鱼鳃中mTOR和其下游效应蛋白核糖体S6激酶(ribosomal protein S6 kinase,S6K1)mRNA的表达。研究表明mTOR活性的上调会抑制TNF-α含量的增加[17,80],而S6K1则能激活IL-10和TGF-β[81]。由此推测,异亮氨酸很可能是通过上调mTOR和S6K1基因表达来调节促炎因子和抗炎因子的表达,从而调节机体的抗炎作用,但具体的调控机制还有待深入研究。
3.3 异亮氨酸对机体抗氧化功能的影响
机体在病理情况下产生过多的活性氧(reactive oxygen species,ROS)会导致氧化损伤[77],而衡量氧化损伤程度高低的指标包括一些氧化产物和上皮细胞结构的完整性[82]。在建鲤[21]、草鱼[17]、卵形鲳鲹[79]和建鲤[82]肠道上皮细胞中均发现适宜水平的异亮氨酸能显著下调肠道组织或肠细胞及血清中的蛋白质氧化产物——蛋白质羰基(protein carbonyl,PC)和脂肪的氧化产物——丙二醛(malondialdehyde,MDA)的含量,以及评价上皮细胞完整性的胞外乳酸脱氢酶(lactate dehydrogenase,LDH)的活性,从而抵御机体的氧化应激。谷胱甘肽(glutathione,GSH)能有效地清除ROS,谷氨酸半胱氨酸连接酶(glutamate cysteine ligase,GCL)是GSH生物合成过程中的限速酶。在建鲤[21]和草鱼[17]上的研究中发现,饲料中补充异亮氨酸可以显著提高建鲤肠道和草鱼鳃中GSH含量,同时提高草鱼肌肉中GCL的基因表达水平。
一些抗氧化物酶可以清除机体内的ROS。研究表明,添加适宜水平的异亮氨酸可以显著增加牙鲆血清中超氧化物歧化酶(superoxide dismutase,SOD)活性[78],抑制肝脏中过氧化氢酶(catalase,CAT)活性[83];提高吉富罗非鱼[25]和卵形鲳鲹[79]血清中SOD活性;提高建鲤[21]肠道中谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、SOD、谷胱甘肽硫转移酶(glutathione S-transferase,GST)、CAT和谷胱甘肽还原酶(glutathione reductase,GR)活性,草鱼鳃中SOD、CAT和GPx活性[17]。
此外,在草鱼的研究中发现,异亮氨酸缺乏或过量会导致草鱼肌肉中核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)mRNA表达水平的下降,适宜的异亮氨酸可抑制其降低[17],Nrf2作为重要的转录因子可调节抗氧化酶基因的表达[84],这说明异亮氨酸是通过Nrf2信号通路激活抗氧化防御系统。
3.4 异亮氨酸对肠道健康的影响
肠道消化酶活性是评价肠道对营养物质消化吸收能力的重要指标,除前面所述的异亮氨酸对肠道抗氧化和免疫指标的影响外[21],饲料中适宜的异亮氨酸含量可以显著提高吉富罗非鱼[25]、卵形鲳鲹[79]肠道消化酶活性。王莉苹等[83]和王旭等[85]对牙鲆的研究发现异亮氨酸和亮氨酸或异亮氨酸和缬氨酸的相互作用均可显著提高其肠道消化酶活性,促进营养物质的吸收。胞质蛋白闭锁小带蛋白(zonula occludens,ZO)和闭合蛋白occludin、claudins组成的紧密连接蛋白(tight junctions,TJs)是保持细胞间结构完整性的重要蛋白[86]。在体外试验中,异亮氨酸通过预防和修复途径可以抑制铜诱导的建鲤原代肠上皮细胞的氧化损伤,从而保护肠上皮细胞的结构完整性[82]。在建鲤上的研究表明,异亮氨酸的缺乏上调了肠道occludin、claudin-3和claudin-7 mRNA表达水平[21]。这个结果与在草鱼[17]上的研究结果不一致,在草鱼上的研究表明适宜水平的异亮氨酸可以提高铜应激后草鱼鳃中claudin-3、claudin-b、claudin-c、ZO-1和occludin mRNA表达水平[17],从而提高细胞间的紧密连接。为了进一步阐明异亮氨酸与紧密连接蛋白的关系,Zhao等[21]检测了调节紧密连接蛋白的丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路,发现异亮氨酸对紧密连接蛋白基因表达的调控可能与下调细胞外调节蛋白激酶1(extracellular regulated protein kinase 1,ERK1)和提高p38MAPK基因表达有关。关于异亮氨酸对紧密连接蛋白相关基因的调控机制还需要深入的研究。
肠道微生物群对宿主动物的肠道健康起着重要作用。在建鲤上的研究发现,异亮氨酸促进了乳酸菌和芽孢杆菌的生长,抑制了嗜水气单胞菌(Aeromonashydrophila)和大肠杆菌(Escherichiacoli)的生长[21]。乳酸杆菌在抑制肠道内有害菌生长的同时,对紧密连接蛋白的分布与表达起到促进作用[87],从而对肠道起到保护作用。而嗜水气单胞菌和大肠杆菌则会破坏动物的肠道菌群结构,这说明异亮氨酸可以通过改善肠道菌群结构促进鱼类肠道健康。
3.5 异亮氨酸对肉质的影响
异亮氨酸作为支链氨基酸,不同于非支链氨基酸,其主要在肌肉中分解代谢产生谷氨酸[66]。饲料中补充谷氨酸可以增强大西洋鲑鱼(SalmosalarL.)鱼片的硬度[88]。基于此,Gan等[11]研究了异亮氨酸对草鱼肌肉品质的影响。肌肉硬度和保水率是鱼肉质量的2个重要参数,这些参数的下降通常被认为是鱼肉质量损失的指标[89]。研究表明,饲料中缺乏(3.8 g/kg)或添加过量(18.5 g/kg)的异亮氨酸会使草鱼幼鱼肌肉剪切力与9.3 g/kg异亮氨酸组相比分别下降20%和30%;同时,异亮氨酸缺乏和过量还会导致肌肉蒸煮损失与12.5 g/kg异亮氨酸组相比分别增加近24%和26%。组织蛋白酶B和L在鱼类肌肉降解过程中起关键作用[90]。饲料中添加9.3~12.5 g/kg异亮氨酸可以降低因异亮氨酸缺乏和过量引起的蛋白酶B和L活性的增强。Ofstad等[91]证明,胶原将肌肉纤维和纤维束粘在一起,有助于鱼类肌肉的持水。缺乏异亮氨酸会导致草鱼幼鱼肌肉乳酸浓度的升高,当给予足够水平的异亮氨酸时,可降低乳酸浓度。乳酸浓度与肌肉pH呈负相关[92],而鱼类肌肉pH下降通常伴随着肌肉软化和水分流失[93]。这表明,异亮氨酸可能通过降低鱼体内乳酸浓度提高肌肉的pH,从而适当改善鱼类的肉质。
4 小结与展望
目前,研究人员已经开展了大量关于水产动物异亮氨酸需要量的研究,鱼类对异亮氨酸的需要量为0.47%~1.98%,虾蟹类对异亮氨酸的需要量为1.01%~2.25%,而仿刺参对异亮氨酸的需要量为0.98%;同时,研究人员还研究了异亮氨酸与其他2个支链氨基酸之间的相互作用,开展了大量的关于异亮氨酸提高机体蛋白质代谢、免疫和抗氧化功能的研究。但是,关于异亮氨酸对肠道健康和肉质影响的报道相对较少,对其调控机制值得深入研究。此外,异亮氨酸还具有促进胰岛素分泌的作用,暗示其可能具有调节机体糖、脂代谢的作用,未来有必要开展异亮氨酸对水产动物糖、脂代谢影响的研究。
