circPVT1对鼻咽癌细胞增殖、转移和凋亡的影响及作用机制研究*
2022-03-29游莉斯
何 雯 ,杨 森 ,王 琦 ,游莉斯
1.四川省成都市第六人民医院耳鼻喉科,四川成都 610051;2.四川省遂宁市中心医院耳鼻咽喉科,四川遂宁 629000;3.四川省成都市第六人民医院检验科,四川成都 610051;4.四川省成都市第六人民医院肿瘤科,四川成都 610051
鼻咽癌(NPC)是指发生于鼻咽腔顶部和侧壁的恶性肿瘤,发病率为耳鼻咽喉恶性肿瘤之首[1]。该病涉及一系列的遗传变化,如原癌基因的激活和肿瘤抑制基因的失活,这些变化会扰乱体内的生理平衡,导致异常的细胞增殖,从而促进肿瘤的发生和发展[2-3]。由于鼻咽癌缺乏个体化的治疗方法和治疗药物,目前仍以放疗为主[4]。大多数鼻咽癌病患者发现时已经处于晚期,治疗效果不佳,5年生存率较低[5]。因此研究鼻咽癌恶性发展的分子机制,对提高鼻咽癌患者的治疗效果和改善预后具有重要意义。环状非编码RNA 基因PVT1(circPVT1)为一种新的环状RNA,在人类癌症如肺癌和前列腺癌中的表达高于邻近的正常组织,已有研究发现其具有许多与癌症进展相关的功能,包括细胞存活和迁移[6-7]。circPVT1可能是肿瘤治疗的潜在靶点,然而其在鼻咽癌中的功能与作用机制报道较少。本研究主要探讨circPVT1对鼻咽癌细胞增殖和转移的影响及作用机制,旨在为临床预防和治疗鼻咽癌提供新的思路和方法。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年1月于成都市第六人民医院耳鼻喉科治疗的临床鳞状细胞鼻咽癌患者的活检组织标本31例为研究对象。纳入标准:(1)患者活检前未经受过任何治疗;(2)活检组织经病理证实为鼻咽癌;(3)患者未患有其他类型的肿瘤。选取慢性鼻窦炎患者活检组织31例作为对照组。所有患者均签署知情同意书,本研究由成都市第六人民医院批准审核通过。
1.2 试剂与仪器 鼻咽癌细胞系HNE1 购于德国DSMZ细胞库;二甲基噻唑-二苯基溴化四唑(MTT)购自美国Gibco 公司;DMEM 培养液、胎牛血清(FBS)购自美国HyClone 公司;聚偏二氟乙烯膜(PVDF)膜购自美国Pall Life Sciences公司;Western blot相关化学试剂购自上海碧云天生物科技有限公司;增强化学发光(ECL)试剂购自英国Abcam 公司;兔抗大鼠circPVT1单克隆抗体、小鼠抗大鼠p-AKT单克隆抗体、小鼠抗大鼠p-PI3K 单克隆抗体、兔抗大鼠PTEN 单克隆抗体、兔抗大鼠AKT 单克隆抗体、小鼠抗大鼠PI3K 单克隆抗体、小鼠抗大鼠β-actin单克隆抗体和HRP标记的兔抗小鼠IgG 和HRP标记的山羊抗兔IgG 购自英国Abcam 公司;Transwell Chamber购自美国Corning 公司;RNA 提取试剂盒、逆转录试剂盒和lipo2000 试剂购自美国Invitrogen公司;circPVT1 mimic和circPVT1 inhibitor由上海吉马制药科技有限公司合成;超净工作台购自苏州太素净化设备工程有限公司;细胞培养箱购自美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 实时荧光定量PCR(RT-qRCR)检测circPVT1的表达 使用TRIzol试剂提取总RNA,并根据试剂盒说明书进行DNA 逆转录合成。引物由Primer Premier 6.0根据各基因序列设计,由上海鹰君生物技术有限公司合成。反应条件如下:95 ℃预变性60 s,92 ℃变性30 s,58 ℃退火45 s,72 ℃延伸35 s,共35个循环。甘油醛3-磷酸脱氢酶(GAPDH)作为参照。根据荧光定量计算所有样品和标准品的起始循环数。基于标准CT 值,绘制标准曲线,然后使用2-ΔΔCt方法进行半定量分析。circPVT1引物F:5'-GGT TCC ACC AG CGT TAT TC-3';R:5'-CAA CTT CCT TTG GGT CTC C-3'。内参GAPDH 引物F:5'-CCA GGT GGT CTC CTC TGA-3';R:5'-GCT GTA GCC AAA TCG TTG T-3'。试验重复3次。
1.3.2 HNE1细胞培养和分组 将储存在液氮中的鼻咽癌细胞系HNE1放置于37 ℃水浴中解冻。细胞完全解冻后,以1 000 r/min离心3 min,转移到含有新鲜DMEM 培养基的细胞培养皿中,在37 ℃、5%CO2细胞培养箱中培养48 h。当细胞融合度为95%左右时,以1×106个/孔接种于6 孔板中。培养的HNE1细胞随机分为3组:阴性对照组、circPVT1过表达试验组和circPVT1干扰试验组。
1.3.3 circPVT1 mimic 和circPVT1 inhibitor 转染 按照上述步骤培养阴性对照组、circPVT1 过表达试验组和circPVT1干扰试验组HNE1细胞,当细胞接种12 h融合度达到70%~80%时,将circPVT1 mimic、circPVT1 inhibitor和阴性对照组细胞分别加入到200 μL无血清的DMEM 培养基中,充分混合,室温下孵育15 min。lip2000分别与circPVT1 mimics、circPVT1 inhibitor、阴性对照组细胞稀释液充分混合,室温下孵育30 min。PBS冲洗各组细胞,除去细胞中的血清,分别加入1.6 mL 无血清DMEM 培养基及各组转染试剂,放置在37 ℃、5% CO2培养箱中培养。6 h后更换一次培养液,并进一步继续培养48 h。采用RT-qRCR 检测circPVT1 mimic和circPVT1 inhibitor转染效果。试验重复3次。
1.3.4 MTT 法检测细胞增殖能力 将HNE1细胞从含有10%PBS的DMEM 培养基吸出,以5×103个/孔接种于96孔板中,培养24 h后弃去上清液。每组细胞间隔24 h处理一次,然后每组加入20 μL无菌MTT。在每个时间点设置3 个复制孔。连续培养4 h后,完全除去上清液,以每孔150 μL 加入DMSO孵育10 min。当晶体完全溶解时,在570 nm的波长下测量吸光度值(A570)以反映细胞增殖情况。试验重复3次。
1.3.5 Transwell Chamber检测细胞侵袭能力 circPVT1 mimics和circPVT1 inhibitor转染到HNE1细胞48 h后,吸出培养液,向每个孔中加入50 μL 含10 g/L BSA的无血清培养基,37 ℃孵育30 min。随后将Transwell小室置于24孔板中,500 μL 含10%FBS的DMEM 培养基加入到小室中,100 μL HNE1细胞悬液加入到小室中,并在无血清DMEM 培养基中培养。细胞培养48 h 后取出Transwell小室,用PBS冲洗,棉签擦去微孔膜上层的细胞,固定在冰乙醇中30 min。转移到微孔膜下层的细胞在倒置显微镜下计数。对每个样品计数10个视野,最后计算平均值。试验重复3次。
1.3.6 流式细胞术分析细胞凋亡 circPVT1 mimic和circPVT1 inhibitor转染处理48 h后,常规消化计数后收集HNE1细胞,固定于75%乙醇中,4 ℃过夜。次日,PBS洗涤后,将细胞悬置于800 μL 1×PBS和1%BSA的混合溶液中,随后加入100 μg/mL PI溶液(3.8%枸橼酸钠,pH=7.0)和100 RNase (RNase,10 mg/mL),在37 ℃避光室下孵育30 min,然后用流式细胞仪检测细胞凋亡情况。试验重复3次。
1.3.7 Western blot 检测鼻咽癌细胞中PTENP13K/AKT 信号通路相关蛋白的表达 提取各组的总蛋白后加入裂解液,冰上裂解15~30 min,4 ℃10 000 r/min离心机下离心15 min 后吸取上清液,BCA 法测蛋白浓度。分离的蛋白质在10% SDSPAGE上电泳后,转移到PVDF膜上,5%脱脂奶粉封闭2 h,封闭完成后,分别用兔抗大鼠circPVT1单克隆抗体(1∶500)、小鼠抗大鼠p-AKT 单克隆抗体(1∶800)、小鼠抗大鼠p-PI3K 单克隆抗体(1∶800)、兔抗大鼠PTEN 单克隆抗体(1∶800)、兔抗大鼠AKT 单克隆抗体(1∶800)、小鼠抗大鼠PI3K 单克隆抗体(1∶800)和小鼠抗大鼠GADPH 单克隆抗体(1∶1 000),4 ℃孵育过夜。次日,洗涤后,分别加入HRP标记的兔抗小鼠IgG(1∶2 000)或HRP标记的山羊抗兔IgG(1∶2 000),37 ℃孵育1.5 h。用Leagene ECL发光液于暗室内对Western blot条带进行发光显影,使用蛋白质图像处理系统软件和Quantity one软件分别扫描X 光胶片和条带密度测量值。试验重复3次。
1.4 统计学处理 采用SPSS20.0软件对数据进行分析。计量资料以表示,两组间比较采用t检验,3组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 circPVT1在鼻咽癌组织中的表达 采用RTqRCR检测circPVT1在慢性鼻窦炎组织和鼻咽癌组织中的表达,结果显示,与对照组(0.46±0.05)相比,circPVT1在鼻咽癌组织(1.24±0.22)中表达显著增加(t=6.10,P=0.004)。
2.2 RT-qRCR 检测circPVT1 mimic和circPVT1 inhibitor转染效果 采用RT-qRCR 检测转染circPVT1 mimic和circPVT1 inhibitor对鼻咽癌细胞HNE1中circPVT1表达的影响。结果显示,与阴性对照组(0.68±0.18)相比,circPVT1 过表达试验组中circPVT1的表达(1.55±0.26)显著增加(t=4.765,P=0.005);与阴性对照组相比,circPVT1干扰试验组中circPVT1的表达(0.21±0.16)显著降低(t=3.38,P=0.020)。
2.3 circPVT1对鼻咽癌细胞增殖能力的影响 采用MTT 法检测circPVT1对鼻咽癌细胞增殖能力的影响,结果显示,与阴性对照组(112.67±2.78)相比,circPVT1 过表达试验组 HNE1 细胞的A570值(178.35±5.62)显著增加(t=18.14,P<0.001),circPVT1干扰试验组HNE1 细胞的A570值(42.23±3.45)显著降低(t=27.54,P<0.001)。
2.4 circPVT1对鼻咽癌细胞转移能力的影响 采用Transwell Chamber试验检测circPVT1对鼻咽癌细胞转移能力的影响,结果显示,与阴性对照组[(175.67±11.38)个]相比,circPVT1过表达试验组HNE1细胞的转移细胞数[(256.33±18.62)个]显著增加(t=6.40,P=0.001),circPVT1 干扰试验组HNE1细胞的转移细胞数[(56.33±13.24)个]显著降低(t=11.84,P<0.001),见图1。

图1 Transwell Chamber试验分析circPVT1对鼻咽癌细胞转移能力的影响
2.5 circPVT1对鼻咽癌细胞凋亡的影响 采用流式细胞术检测circPVT1对鼻咽癌细胞凋亡的影响,结果显示,与阴性对照组(13.32%±4.35%)相比,circPVT1 过表达试验组 HNE1 细胞的凋亡率(6.24%±2.57%)显著降低(t=2.65,P=0.045),circPVT1干扰试验组HNE1 细胞的凋亡率(28.65%±5.23%)显著增加(t=3.90,P=0.011),见图2。

图2 流式细胞术分析circPVT1对鼻咽癌细胞凋亡的影响
2.6 circPVT1对PTEN-PI3K/AKT 信号通路的影响 采用Western blot检测circPVT1对鼻咽癌细胞PTEN-PI3K/AKT 信号通路的影响,结果显示,与阴性对照组相比,circPVT1过表达试验组HNE1细胞中PTEN 蛋白表达显著降低、p-PI3K、p-AKT 表达显著增加(P<0.05)。circPVT1干扰试验组HNE1细胞中PTEN的表达显著增加,p-PI3K、p-AKT的表达显著降低(P<0.05),见图3和表1。

图3 Western blot检测circPVT1对PTEN-PI3K/AKT信号通路的影响
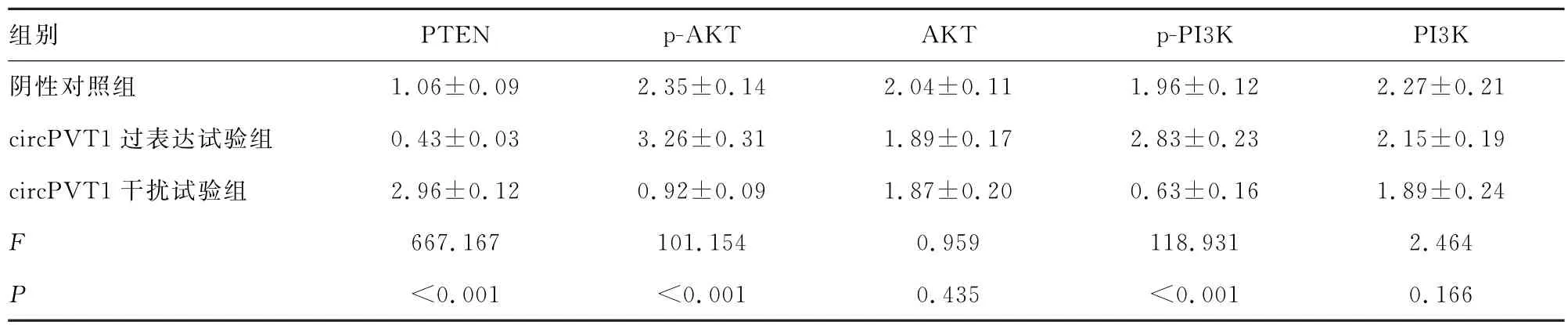
表1 各组细胞中PTEN-PI3K/AKT 信号通路相关蛋白的相对表达量
3 讨论
鼻咽癌是一种独特的Ⅱ型头颈部恶性肿瘤,具有明显的地理和种族分布特征,特别是在东南亚和中国南方,发病率较高[8]。该病发病部位深且隐蔽,早期进展缓慢,常导致误诊,增加了临床治疗难度[9]。大多数鼻咽癌患者在晚期被诊断,且多数鼻咽癌是分化较差的未角化鳞状细胞癌,恶性程度高,浸润能力强,易转移[10]。尽管原发肿瘤在放疗(IMRT)及放化疗结合治疗下得到短期控制,但仍存在局部复发和远处转移等问题[11]。鼻咽癌的确切发病机制至今尚未阐明。因此,筛选和鉴定有效的分子标志物对鼻咽癌早期诊断和干预具有重要意义。
circRNA 为一种新发现的非编码RNA,在3'和5'末端通过共价键形成闭环的过程中产生[11]。由于这种封闭的结构,circRNA 具有较强的稳定性,对RNA 降解途径具有高度抗性,表明与线性非编码RNA 相比,circRNA 可以更有效地对疾病进行诊断[12]。越来越多的研究表明,circRNA 可以作为诊断和治疗疾病的分子标志物,特别是在肿瘤的发生和发展中起作用[13-14],如circPIP5K1A 敲低可通过调节miR-101/ABCC1轴抑制非小细胞肺癌的进展并提高顺铂敏感性[15]。circABCB10在乳腺癌组织和细胞中上调,通过靶向调节miR-1271促进乳腺癌细胞的增殖、迁移和侵袭[16]。circPVT1 来自lncRNA-PVT1的第3个外显子,位于已知的癌症易感性区域chr 8:128902834-128903244中,被鉴定为许多类型癌症的候选癌基因,包括头颈鳞状细胞癌和白血病[17-18]。既往研究表明,在非小细胞肺癌中circPVT1表达上调,可能是一个潜在的预后标志物[19]。在乳腺癌组织和细胞系中circPVT1高表达,可通过调节miR-29a-3p介导的AGR2-HIF-1α轴促进乳腺癌细胞生长、侵袭、迁移并抑制细胞凋亡,从而成为乳腺癌中的致癌基因[20]。circPVT1为多种肿瘤治疗的潜在分子靶点,但是在鼻咽癌中的作用尚不清楚,本研究首先采用RT-qRCR 检测鼻咽癌组织中circPVT1的表达水平,结果显示,与对照组相比,鼻咽癌组织中circPVT1表达明显增加,提示circPVT1在鼻咽癌中可能发挥癌基因作用,但是本研究收集样本较少,未对circPVT1鼻咽癌患者中表达的临床意义进行分析,后续需要进一步扩大样本量进行验证及深入分析。研究显示,在非小细胞肺癌和乳腺癌等常见恶性肿瘤中circPVT1促进肿瘤细胞的增殖和转移能力[19-20],本研究也显示,干扰circPVT1的表达显著抑制鼻咽癌细胞的增殖和转移能力,过表达circPVT1显著增强了鼻咽癌细胞的增殖和转移能力,表明circPVT1的表达促进鼻咽癌细胞的恶性进展,发挥促癌作用。
关于circPVT1促进鼻咽癌细胞增殖和转移的作用机制研究显示,circPVT1 可以抑制Bax、p53 和Daxx等促凋亡蛋白的表达,并激活Caspase级联反应,抑制细胞凋亡从而促进肿瘤细胞生长[20-22]。PTEN 是一种抑癌因子,属于负调控细胞增殖的基因[23-24],PTEN 是乳腺癌和胰腺癌等癌症的肿瘤抑制因子,可以通过拮抗磷酸化酶如酪氨酸激酶的活性来抑制肿瘤的发展[25-26]。PTEN 可作为分子靶点抑制鼻咽癌细胞的恶性进展[27]。本研究采用Western blot检测发现,干扰circPVT1的表达促进鼻咽癌细胞PTEN 蛋白的表达,过表达circPVT1抑制鼻咽癌细胞PTEN 蛋白的表达。PTEN 负向调节PI3K/AKT 信号通路是其发挥肿瘤抑制因子作用的重要机制[28],PI3K/AKT 信号通路与肿瘤发生密切相关,其激活可导致肿瘤细胞增殖、疾病进展。有研究已经证实鼻咽癌的进展与PI3K/AKT 信号通路有关[29],YAO 等[28]报道在鼻咽癌细胞HK-1 中干扰PTEN的表达,可通过激活PI3K/AKT 信号通路促进鼻咽癌细胞的发生发展,PTEN-PI3K/AKT 信号轴可作为抗鼻咽癌治疗的靶点。本研究发现上调鼻咽癌HNE1细胞中circPVT1的表达导致p-PI3K、p-AKT表达增加;抑制HNE1细胞中circPVT1的表达导致p-PI3K、p-AKT 表达降低。
综上所述,circPVT1在鼻咽癌组织中上调,促进了鼻咽癌细胞的增殖和转移能力,抑制细胞凋亡,可能是通过靶向调节PTEN-PI3K/AKT 信号途径实现的。因此,circPVT1 可能成为鼻咽癌诊断和治疗的分子靶点。
