冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的抑制活性研究
2022-03-24顾玉卿殷成芮潘凤好纠敏汪伦记
顾玉卿,殷成芮,潘凤好,纠敏,汪伦记
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
嗜水气单胞菌(Aeromonas hydrophila)隶属于弧菌科(Vibrionaceae)、气单胞菌属,革兰氏阴性菌,是一种人-畜-鱼共患的条件致病菌[1]。嗜水气单胞菌不仅是鱼类病害的主要病原菌,也是水产品中主要的腐败菌[2],其可引起鱼类的败血症,也可引起蟹类颤抖病及蛙类的红腿病等[3]。嗜水气单胞菌也可感染人体,并具有血液侵袭性,病死率33%~70%[4]。现代渔业养殖模式的水体温度和pH值都接近于嗜水气单胞菌的最适生长条件,养殖密度较高,鱼类很易受损伤,进而增加了鱼类感染该菌的概率。同时,由于饲用抗生素的长期不合理使用致使其出现了严重的耐药性[5]。自然界中的嗜水气单胞菌大多是以生物膜的形式存在,生物膜的形成对其内部菌体具有一定的保护作用,进而提高了其耐药性[6]。
目前,国内外对中草药及其活性成分在水产养殖方面预防细菌性感染疾病的相关报道逐年增加。已有研究表明,黄连[7]、黄芩[8]、秦皮素[9]、和厚朴酚[10]、白藜芦醇[11]等中草药及其活性成分对嗜水气单胞菌均有抑菌作用,且对微生物生物膜的形成具有良好的抑制作用[12]。但由于中草药活性成分可溶性较差,限制了其进一步的应用[13]。纳米脂质体是指粒径分布在50 nm~1 000 nm的纳米球[14],可以有效传递多种分子,提高药物的水溶性[15],能够扩大中草药及其活性成分的应用范围,并降低药物的不良反应[16]。
冬凌草,学名碎米桠[Rabdosia rubescens(Hemsl.)Hara],是我国一种特色中草药,在我国分布广泛。冬凌草甲素是冬凌草各成分中主要的抑菌活性成分。现代药理学研究证实冬凌草甲素具有抗癌性,并具有抑菌、抗氧化和调节机体免疫功能的作用[17]。目前关于冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的抑制活性研究鲜有报道。因此,本研究进行了冬凌草甲素纳米脂质体制备,并研究了其对嗜水气单胞菌生物膜形成的抑制作用及清除效果,进而为其应用于水产养殖、水产保鲜等方面提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株
嗜水气单胞菌(A.hydrophila):河南科技大学食品与生物工程学院实验室保存。菌株保存于专用菌种保藏管中,使用前挑出管中瓷珠,在液体培养基中活化后接种于平板上,28℃培养12 h后挑取单菌落使用。
1.1.2 材料与试剂
大豆卵磷脂:北京索莱宝科技有限公司;胆固醇(纯度>95%):上海蓝季科技发展有限公司;聚乙烯吡咯烷酮(polyvidone povidone,PVP):上海阿拉丁生化科技股份有限公司;冬凌草甲素:上海源叶生物科技有限公司;营养肉汤培养基(nutrient broth,NB)、营养肉汤琼脂培养基(nutrient broth agar,NBA)、水解酪蛋白培养基(Mueller-Hinton,MH):北京奥博星生物技术有限公司;0.22 μm微孔滤膜:岛津技迩(上海)商贸有限公司;MTT试剂盒:生工生物工程(上海)股份有限公司;5-(4,6-二氯三嗪基) 氨基荧光素 [5-(4,6-dichlorotriazinyl)aminofluorescein,5-DTAF]:西格玛奥德里奇(上海)贸易有限公司;其他试剂均为分析纯。
1.1.3 试验仪器
RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;UV1800PC紫外可见分光光度计:上海菁华科技仪器有限公司;H-2050R低温超速离心机:湖南湘仪离心机仪器有限公司;JY92-2D超声细胞破碎仪:宁波新芝生物科技股份有限公司;Infinite F50酶标仪:瑞士帝肯(Tecan)公司;Leica DM2500荧光正置显微镜:莱卡显微系统贸易有限公司;TM3030Plus扫描电镜:日本日立高新技术公司。
1.2 方法
1.2.1 菌种活化和菌悬液制备
用接种环挑取供试菌单菌落,接入NB液体培养基中,置于28℃摇床,180 r/min培养20 h至对数期。采用比浊法,用无菌0.9%NaCl溶液调整细菌浓度为1×108cfu/mL。
1.2.2 冬凌草甲素对嗜水气单胞菌的抑菌活性
采用牛津杯法测定抑菌活性。试验组冬凌草甲素质量浓度分别为5 mg/mL和2.5 mg/mL,对照组(CK)加入溶剂为甲醇,28℃培养18 h,用游标卡尺测量抑菌圈直径。试验重复3次,取平均值。
1.2.3 冬凌草甲素纳米脂质体的制备
称取大豆卵磷脂和胆固醇(5∶1,质量比)加入适量氯仿中,充分溶解后,加入冬凌草甲素溶液,使其终浓度为500 μg/mL。40℃减压蒸馏至瓶内壁形成均匀脂质膜,放入真空干燥箱中,60℃,真空干燥24 h。然后加入质量浓度为0.2%PVP表面活性剂和pH7.4磷酸盐缓冲液(phosphate buffer solution,PBS),在水浴条件下进行超声处理形成乳浊液。乳浊液进行超声破碎(运行 3 s、间隔 3 s、功率 360 W、时间 20 min)后过 0.22 μm微孔滤膜,滤液即为制备的500 μg/mL冬凌草甲素纳米脂质体,置于4℃冰箱保存备用[18]。
1.2.4 冬凌草甲素纳米脂质体对嗜水气单胞菌的最小抑菌浓度测定
采用二倍稀释法[19]进行测定。接种环挑取供试菌单菌落接种于无菌MH培养基中,28℃、180 r/min培养过夜(生长至对数生长期),将菌液浓度调整为1×105cfu/mL。取菌悬液和供试液,使供试液在MH培养 基 中 的 终 浓 度 为 250、125、62.5、31.25、15.625、7.812 5 μg/mL,分别取200 μL培养液加入96孔板中,同时设置不添加供试液的空白对照组。28℃恒温条件下培养过夜后,用全波长酶标仪测OD600,确定冬凌草甲素、冬凌草甲素纳米脂质体的最小抑菌浓度(minimum inhibitory concentration,MIC)值。试验重复3次。
1.2.5 嗜水气单胞菌产膜能力鉴定
取制备的菌悬液,用接种环小心划线于刚果红平板上,28℃培养过夜后观察供试菌菌落。判断标准如下:菌落有金属光泽,颜色生长为黑色,即有产膜能力;反之,没有产膜能力[19]。
1.2.6 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的抑制活性
采用结晶紫法[20]测定抑制活性。96孔板每孔中加入200 μLMH培养基和20 μL制备的菌悬液,28℃静置培养24 h后,吸出孔中的MH培养基,再加入200 μL含冬凌草甲素纳米脂质体的MH培养基,使其终浓度分别为 250、125、62.5、31.25 μg/mL。同时以不含冬凌草甲素纳米脂质体的MH培养基为空白对照。28℃静置培养24 h后,吸出每孔的菌液,使用无菌PBS漂洗3次后,加入200 μL甲醇,对孔中生物膜进行固定,15 min后吸出,自然风干,加入200 μL 1%结晶紫溶液,在常温25℃下染色20 min,小心冲洗,倒扣晾干,加入200 μL 30%醋酸,振荡10 s,使用酶标仪测量OD562值,试验重复3次,取平均值。
1.2.7 冬凌草甲素纳米脂质体抗嗜水气单胞菌生物膜的代谢活性
96孔板中,各孔菌液和药物的添加同1.2.6。28℃静置培养24 h后按照MTT试剂盒说明书的步骤进行MTT染色,用酶标仪测量OD570值[20]。试验重复3次,取平均值。
1.2.8 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用
荧光显微镜法[20]:24孔板每孔加入无菌的2%琼脂溶液,凝固后,插入1片无菌盖玻片(14 mm×14 mm),然后加入2 mL含冬凌草甲素纳米脂质体的MH培养基,使其终浓度分别为 250、125、62.5、31.25 μg/mL 和15.625 μg/mL,加入20 μL制备的菌悬液。以不含冬凌草甲素纳米脂质体的MH培养基为空白对照。28℃静置培养24 h后,弃掉培养基,0.9%NaCl漂洗3次。加入适量4%多聚甲醛(将盖玻片覆盖),对盖玻片上生物膜进行固定,30 min后用无菌PBS漂洗3次。加入适量的100 μg/mL 5-DTAF荧光染料(将盖玻片覆盖),25℃避光静置染色2 h,弃掉荧光染料,用无菌PBS漂洗,荧光显微镜观察。
扫描电镜法[20]:生物膜制备方法同上。培养完成后弃掉培养基,无菌生理盐水洗涤3次。4℃条件下(避光),加入适量2.5%戊二醛(将盖玻片覆盖),静置过夜(约12 h),将生物膜固定,随后用无菌PBS洗涤3次;依次用不同浓度乙醇脱水,乙醇浓度分别为50%、70%、80%、90%,每次脱水10 min;然后用100%乙醇脱水,脱水20 min后用叔丁醇置换乙醇,共置换两次。干燥后喷金仪喷金,扫描电镜观察。
1.2.9 冬凌草甲素纳米脂质体对嗜水气单胞菌成熟生物膜的清除作用
荧光显微镜法:24孔板每孔加入无菌的2%琼脂溶液,凝固后插入1片无菌盖玻片(14 mm×14 mm),每孔加入2 mLMH培养基和20 μL菌悬液,28℃恒温培养1 d后,弃掉培养基,加入2 mL含冬凌草甲素纳米脂质体的MH培养基,使其终浓度分别为250、125、62.5、31.25、15.625μg/mL。以不含冬凌草甲素纳米脂质体的MH培养基为空白对照。28℃静置培养24 h后,弃掉培养基。其余操作步骤同1.2.8。扫描电镜法:生物膜制备方法同上。其余操作步骤同1.2.8。
1.2.10 数据分析
本试验用SPSS17.0进行数据分析,组间分析采用One-Way ANOVA两两比较得到相应的P值,P<0.05为显著性差异。
2 结果与分析
2.1 冬凌草甲素对嗜水气单胞菌的抑菌活性
冬凌草甲素对嗜水气单胞菌的抑菌活性结果如图1所示。
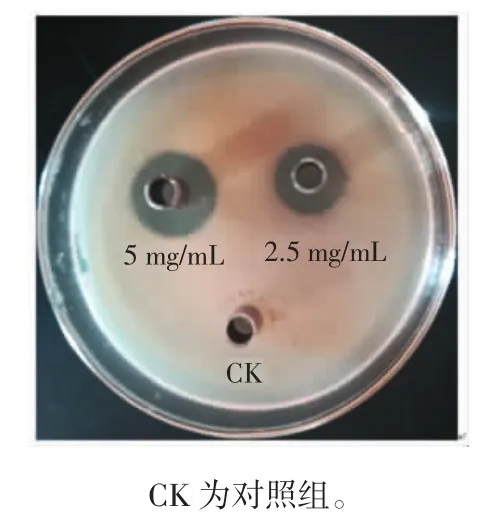
图1 冬凌草甲素对嗜水气单胞菌的抑菌活性Fig.1 Antibacterial activity of oridonin against A.hydrophila
由图1可知,冬凌草甲素对嗜水气单胞菌具有显著的抑菌活性。2.5 mg/mL冬凌草甲素作用嗜水气单胞菌时的抑菌圈直径达15.75 mm,相对敏感性达到高度敏感。
2.2 冬凌草甲素纳米脂质体对嗜水气单胞菌MIC
二倍稀释法测定冬凌草甲素纳米脂质体对供试菌MIC的结果如图2所示。
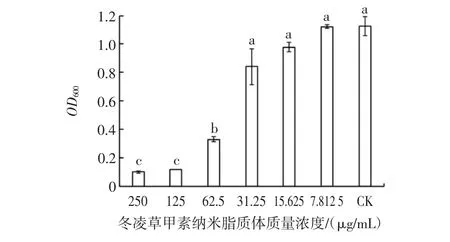
图2 冬凌草甲素纳米脂质体对嗜水气单胞菌MIC测定Fig.2 MIC determination of oridonin nanoliposomes against A.hydrophila
由图2可知,质量浓度为62.5 μg/mL冬凌草甲素纳米脂质体显著抑制了该菌的生长(P<0.05),浓度越高其抑制活性越强,当冬凌草甲素纳米脂质体的质量浓度大于125 μg/mL时,供试菌不再生长。MIC是指经24 h培养后药物组无明显生长的最低浓度,因此冬凌草甲素纳米脂质体对该菌的MIC为62.5 μg/mL。
2.3 嗜水气单胞菌产膜能力鉴定
釆用刚果红培养基培养法对嗜水气单胞菌的产膜能力进行了鉴定,结果如图3所示。
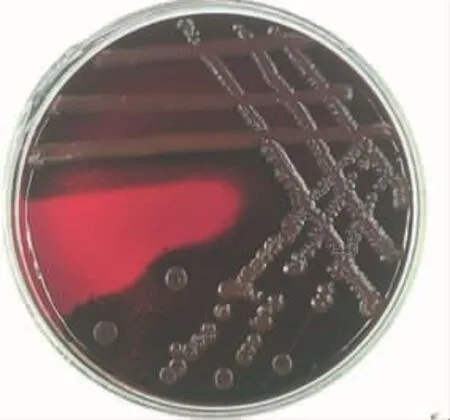
图3 刚果红平板鉴定嗜水气单胞菌生物膜成膜能力Fig.3 Identification of biofilm forming ability of A.hydrophila by Congo red plate
由图3可知,平板中形成的菌落颜色呈黑色,有金属光泽,这表明试验所用供试菌具有生物膜形成能力。
2.4 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的抑制活性
冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用见图4。
由图4可知,亚抑制浓度(31.25 μg/mL)的冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制率为3.59%,抑制活性不明显,但随着冬凌草甲素纳米脂质体含量的增加,对嗜水气单胞菌生物膜形成的抑制率有所提高。冬凌草甲素纳米脂质体质量浓度为62.5 μg/mL时,其对嗜水气单胞菌生物膜形成的抑制率达到51.12%,与亚抑制浓度的冬凌草甲素纳米脂质体处理组相比,差异显著(P<0.05)。当冬凌草甲素纳米脂质体质量浓度提高到125 μg/mL和250 μg/mL,其对该菌生物膜形成的抑制率分别达到66.63%和72.66%,与62.5μg/mL冬凌草甲素纳米脂质体处理组相比差异显著(P<0.05)。试验结果表明,抑制浓度的冬凌草甲素纳米脂质体能抑制嗜水气单胞菌的生物膜形成。
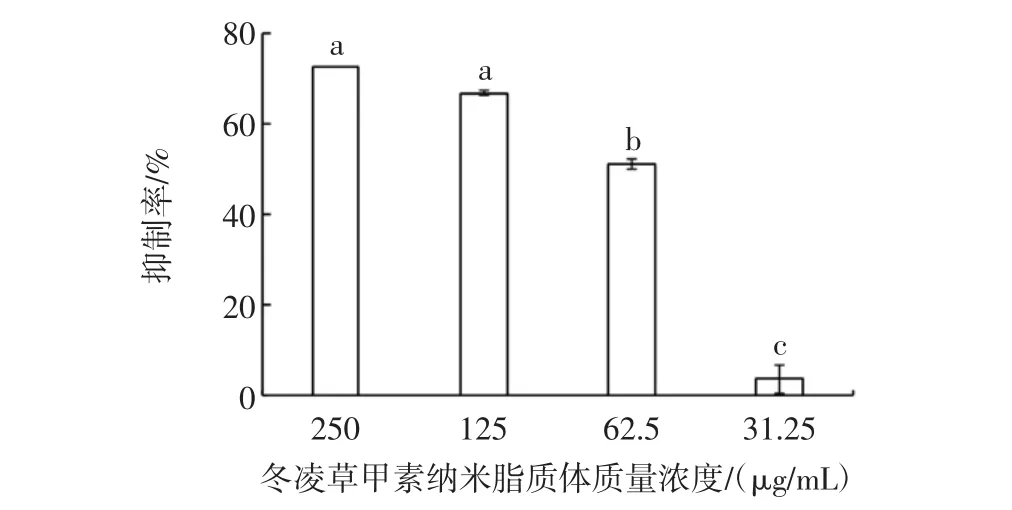
图4 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用Fig.4 Inhibitory effect of oridonin nanoliposomes on A. hydrophila biofilm formation
2.5 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜代谢活性的影响
活菌体内的琥珀酸脱氢酶可以分解外源性四唑盐 [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]并形成甲瓒,因此只有活菌才能代谢MTT,故可用MTT法判断冬凌草甲素纳米脂质体对供试菌生物膜代谢活性的抑制作用。冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜代谢活性的影响见图5。
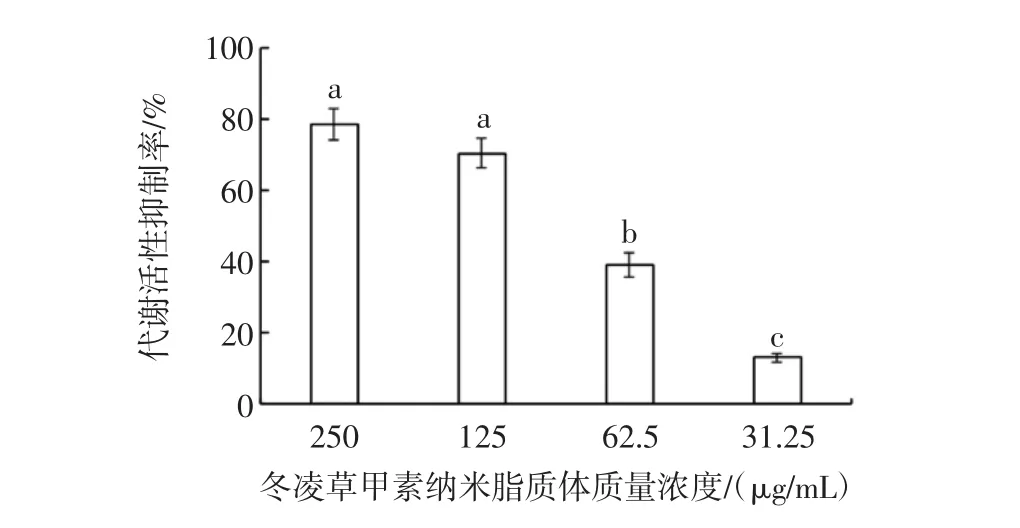
图5 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜代谢活性的影响Fig.5 Effect of oridonin nanoliposomes on metabolic activity of A.hydrophila biofilm
由图5可知,亚抑菌浓度(31.25 μg/mL)的冬凌草甲素纳米脂质体对该菌生物膜代谢活性的抑制率仅为13.1%,但随着冬凌草甲素纳米脂质体含量的增加,对该菌生物膜代谢活性的抑制率也逐渐提高。冬凌草甲素纳米脂质体质量浓度为62.5 μg/mL时,其对该菌生物膜代谢活性的抑制率达到38.99%,与亚抑菌浓度的冬凌草甲素纳米脂质体处理组相比,差异显著(P<0.05)。当冬凌草甲素纳米脂质体质量浓度提高到125 μg/mL和250 μg/mL,其对嗜水气单胞菌生物膜代谢活性的抑制率分别达到70.46%和78.60%,与62.5 μg/mL冬凌草甲素纳米脂质体处理组相比差异显著(P<0.05)。试验结果表明,抑制浓度的冬凌草甲素纳米脂质体能抑制嗜水气单胞菌生物膜的代谢活性。
2.6 冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用
用荧光染料处理后,生物膜会在相应激光供能刺激下释放绿色荧光。因此,为了直观观察冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用,对不同质量浓度冬凌草甲素纳米脂质体作用的嗜水气单胞菌进行了荧光显微镜观察,结果如图6所示。

图6 荧光显微镜观察冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用Fig.6 Inhibitory of oridonin nanoliposomes on A.hydrophila biofilm formation by fluorescence microscope
由图6可知,随着冬凌草甲素纳米脂质体浓度的增加,菌体数量明显下降,绿色荧光减少。不同质量浓度的冬凌草纳米脂质体作用于嗜水气单胞菌的扫描电镜观察结果见图7。

图7 扫描电镜观察冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的抑制作用Fig.7 Inhibition of oridonin nanoliposomes on A.hydrophila biofilm formation by scanning electron microscopy
由图7可知,对照组嗜水气单胞菌生物膜形成良好,菌体聚集,形成多层立体结构,而药物处理组中的菌体数量则随着药物浓度的增加依次减少,未有聚集和形成多层立体结构现象。由此可见,冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的形成具有显著的抑制活性。
2.7 冬凌草甲素纳米脂质体对嗜水气单胞菌成熟生物膜的清除作用
为了考察冬凌草甲素纳米脂质体对嗜水气单胞菌成熟生物膜的清除效果,对不同质量浓度冬凌草甲素纳米脂质体作用的嗜水气单胞菌进行了荧光显微镜和扫描电镜观察,结果见图8和图9。
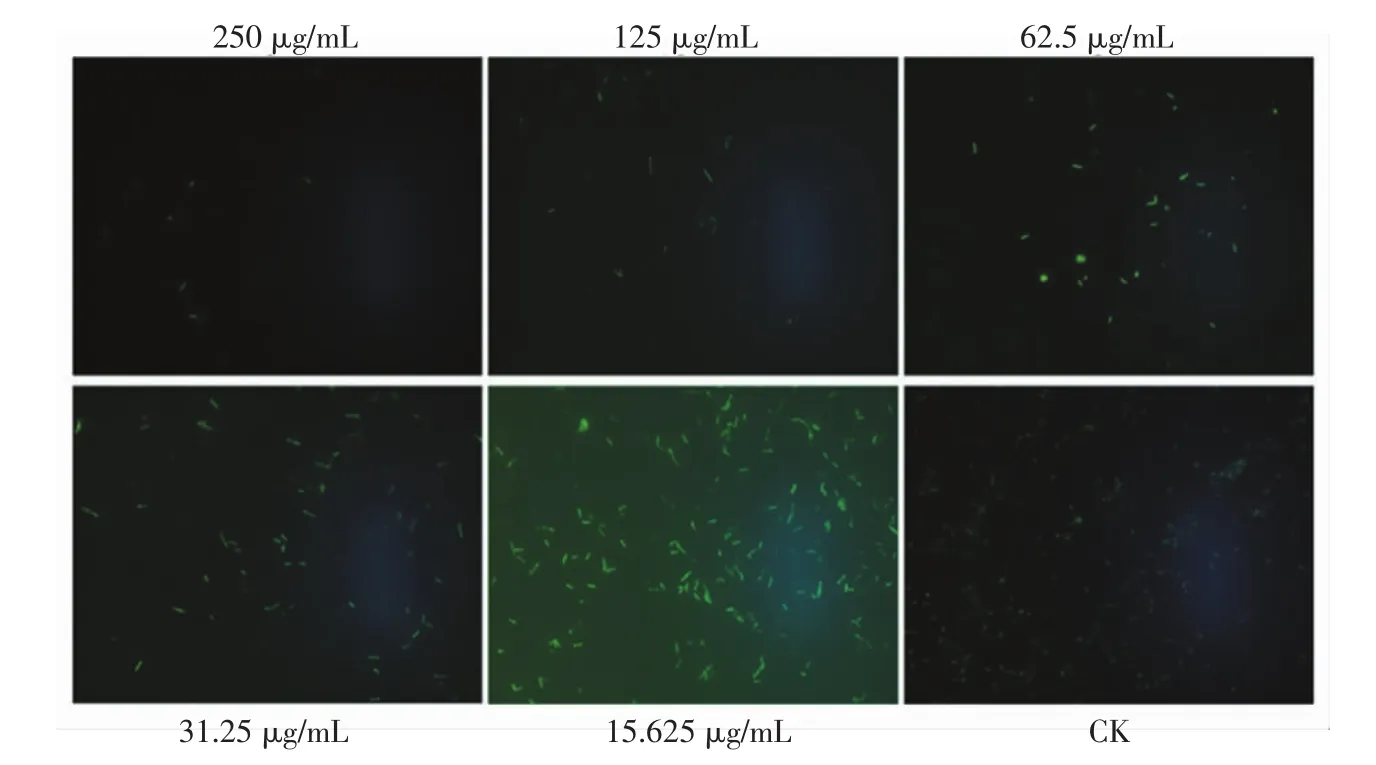
图8 荧光显微镜观察冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的清除作用Fig.8 Scavenging effect of oridonin nanoliposomes on A.hydrophila biofilm formation by fluorescence microscope

图9 扫描电镜观察冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜形成的清除作用Fig.9 Scavenging effect of oridonin nanoliposomes on A.hydrophila biofilm formation by scanning electron microscope
由图8和图9可知,亚抑制浓度的冬凌草甲素纳米脂质体对嗜水气单胞菌成熟生物膜的清除效果较弱,药物处理后,虽然生物膜的结构受到破坏,但仍有大量菌体聚集。随着冬凌草甲素纳米脂质体浓度的进一步升高,荧光正置显微镜视野中绿色荧光显著减弱,扫描电镜中菌体数量显著减少,这表明抑制浓度的冬凌草甲素纳米脂质体能有效清除嗜水气单胞菌生物膜。
3 结论
本文研究了冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的抑菌活性。试验结果表明,冬凌草甲素纳米脂质体对嗜水气单胞菌的最小抑菌浓度为62.5 μg/mL;抑制浓度的冬凌草甲素纳米脂质体对嗜水气单胞菌生物膜的形成具有抑制活性,并显著抑制其代谢活性,且对嗜水气单胞菌的成熟生物膜也具有一定的清除作用。该研究可为冬凌草甲素纳米脂质体应用于水产养殖、水产保鲜等方面提供理论依据。
