基于Fe3O4@Au微粒电化学检测邻苯二酚的研究
2022-03-23关桦楠龚德壮
关桦楠,张 悦,龚德壮,宋 岩
(哈尔滨商业大学 食品工程学院,哈尔滨 150028)
0 引言
邻苯二酚(Catechol,CC),是一种广泛应用于染料、化妆品和农药等行业的毒性较强物质,对环境和人类的健康构成了很大的威胁[1-2]。因此,检测CC的残留对于人类健康和环境保护具有重要意义。目前,CC的常规检测方法一般具有操作复杂、检测成本高和耗时长等缺陷。其中,电化学酶生物传感器检测CC具有灵敏、快速和准确等优点,但是需要依赖于天然过氧化物酶的活性,使其难以推广使用。与天然酶相比,纳米材料模拟酶具有成本低、结构稳定、易于贮存、易于回收和活性可调等显著的优势。其中Fe3O4是一种广泛应用于电化学、催化和传感器等领域的金属氧化物催化剂[3]。由于Fe3O4纳米颗粒的磁性核心具有较大的表面自由能和强磁偶极矩的相互作用,可以重复的回收利用,减少利用成本[4],然而彼此之间也容易发生聚集现象[5],降低催化活性,因此,需要通过在磁性核心表面包覆金纳米粒子(AuNPs)的方法,制备磁性纳米复合颗粒来克服磁性纳米颗粒自身的不足[6-7]。此外,AuNPs还具有高比表面积、优异的表面改性能力和高稳定性等独特的模拟酶性质[8],已成功地在许多电化学反应中被用作有效的电催化剂[9],通过调谐信号放大和加速电子转移,大大增强了传感器的灵敏度和选择性。
本文采用自组装的方法将AuNPs包覆于Fe3O4磁性纳米颗粒的外表面,制备出具有过氧化物模拟酶活性的复合纳米材料(Fe3O4@Au)。并考察Fe3O4@Au的过氧化物模拟酶活性,根据模拟酶催化H2O2产生羟基自由基,促进CC发生氧化还原反应生成邻苯醌,增加电极表面电子转移的原理,建立电化学循环伏安法测定CC含量的简便方法。将为高效检测CC的残留提供参考依据。
1 仪器及试剂
1.1 仪器
H-7500型透射电子显微镜(日本电子株式会社);YZHR-25型水热反应釜(上海耀冠仪器有限公司);PS-100A型超声波清洗机(深圳市得康洗净电器有限公司);VSM LDJ 9600型振动磁强计(北京翠海佳诚磁电科技有限责任公司);FC204型电子天平(沈阳龙腾电子有限公司);JY-PH160型pH计(广州佳仪精密仪器有限公司);CS310H型电化学三电极工作站(武汉科思特仪器股份有限公司);HH-4型数显恒温水浴锅(常州鸿泽实验科技有限公司)。
1.2 试剂
NaAc·3H2O、冰 醋 酸、H2O2、PEG-4000、乙醇、氯金酸(分析纯,上海诺泰化工有限公司);FeCl3·6H2O(分析纯,海博生物技术有限公司);乙二醇(分析纯,天津市华东试剂厂),3-氨丙基三乙氧基硅烷(APTES)(分析纯,淮安和元化工有限公司)。
2 试验方法
2.1 金磁微粒的制备和表征
取2 g Fe3O4纳米微粒超声分散于50 mL含有20 %乙醇的水溶液中,逐滴加入1 mL APTES,于室温下搅拌12 h,反应结束后可看到具有细微颗粒的悬浊液呈浅棕色,得到产物即为氨基化改性后的Fe3O4纳米微粒。采用0.1 mol/L的HAc-乙醇溶液磁分离清洗所得产物3次,烘干后备用。取上述已氨基化改性的Fe3O4纳米微粒2 g于烧杯中,在室温下150 r/min的磁力搅拌器中不断搅拌,并迅速加入20 mL所制备的金纳米粒子溶液,混合溶液由棕色逐渐变淡,低速搅拌反应8 h后,获得Fe3O4@Au金磁微粒。置于超声波清洗器上超声振荡使其均匀分散,然后利用透射电子显微镜观察材料的形貌和粒径。
2.2 金磁微粒模拟酶活性验证
采用循环伏安(CV)法评估Fe3O4@Au对CC的电化学响应行为。所有电化学试验均采用电化学工作站三电极系统完成,其中,玻碳电极(GCE)为工作电极,Ag/AgCl电极为参比电极,铂电极为辅助电极。
筛选4种不同的反应体系,采用CV法验证Fe3O4@Au检测CC过程中的过氧化物模拟酶的活性:
(1)H2O2+CC体系:向盛有10 mL HAc-NaAc缓冲液(pH=5)的小烧杯中加入200 μL的H2O2标准溶液(50 mmol/L),将反应体系混匀置于温度为20 ℃水浴锅中(反应过程中每隔1 min温和摇晃一次,下同),最后加入200 μL CC标准溶液(0.01 mmol/L)。
(2)H2O2+Fe3O4@Au体系:将0.012 5 g Fe3O4@Au纳米粉末加入到盛有10 mL HAc-NaAc缓冲液(pH=5)的小烧杯中,将反应体系混匀置于温度为20 ℃水浴锅中,加入 200 μL H2O2标准溶液。
(3)CC+Fe3O4@Au体系:将0.012 5 g Fe3O4@Au纳米粉末加入到盛有10 mL HAc-NaAc缓冲液(pH=5)的小烧杯中,将反应体系混匀置于温度为20 ℃水浴锅中,加入200 μL CC标准溶液。
(4)H2O2+CC+Fe3O4@Au体系:将0.012 5 g Fe3O4@Au纳米粉末加入到盛有10 mL HAc-NaAc缓冲液(pH=5)的小烧杯中,再加入200 μL H2O2标准溶液,混匀后,将反应体系混匀置于温度为20 ℃水浴锅中充分反应15 min后,加入200 μL CC标准溶液。
调节电化学工作站扫描速率为0.10 V/s,监测(1)→(4)氧化峰电流并取其绝对值,重复试验3次,将其作为体系指标,指标越大越好。
2.3 单因素优化检测体系
将不同添加量的Fe3O4@Au粉末(0.005,0.007 5,0.01,0.012 5,0.015 g)分别加入到不同pH值(4,5,6,7,8,9)的 10 mL HAc-NaAc 缓冲溶液中混匀,再加入200 μL的H2O2标准溶液,并将其置于不同的水浴温度(4,20,30,40,50 ℃),充分反应15 min后(在此期间需要温和摇晃,使其反应均匀),再加入200 μL CC标准溶液,调节电化学工作站采用不同扫描速率(0.02,0.04,0.06,0.08,0.10 V/s)进行检测。监测氧化峰电流的绝对值,重复试验3次,并将其作为体系指标,指标越大越好。
2.4 正交试验设计优化检测体系
分别考察反应温度(A因素)、Fe3O4@Au添加量(B因素)、扫描速率(C因素)和pH值(D因素)对整个试验体系的影响,每种因素设计3个水平(根据单因素试验优化得出),选用L9(34)正交设计表进行优化试验。
采用电化学工作站三电极系统,利用CV法检测体系中的CC浓度,监测氧化峰电流绝对值的变化,重复试验3次,并确定因素影响的主次顺序及优选方案。
2.5 金磁微粒模拟酶工作曲线的构建
按照优化试验得出的最适电化学增强检测体系对不同浓度(0.001,0.002 5,0.005,0.01,0.025,0.05,0.1 mmol/L)的CC进行检测,以CC的浓度为横坐标,以氧化峰电流绝对值为纵坐标,绘制工作曲线,并计算最低检测限和回收率。
2.6 金磁微粒模拟酶抗干扰性研究
为验证电化学体系在检测过程中的抗干扰性能,在最优试验条件下向电化学检测体系中分别加入浓度为 10 mmol/L 的 MgSO4、KCl、AlCl3、Zn(NO3)2、CaCl2和葡萄糖等常见干扰物质,观察氧化峰电流绝对值的变化,对其抗干扰性能进行评估。
3 结果与讨论
3.1 金磁微粒的表征
取Fe3O4纳米粒子的水溶液稀释至一定浓度,采用高分辨率透射电镜观察粒子的形貌和粒径分布,如图1所示。制备的粒子多为球形,平均粒径约为130 nm。由于磁性纳米粒子具有较高的比表面能和粒子与粒子之间的偶极矩作用,使得Fe3O4磁性纳米粒子出现聚集的现象。
采用透射电子扫描显微镜观察所制备出的AuNPs外观形貌和粒径大小,结果如图2所示。AuNPs形状均一,基本呈现圆球形,且分散度良好,基本没有聚集。
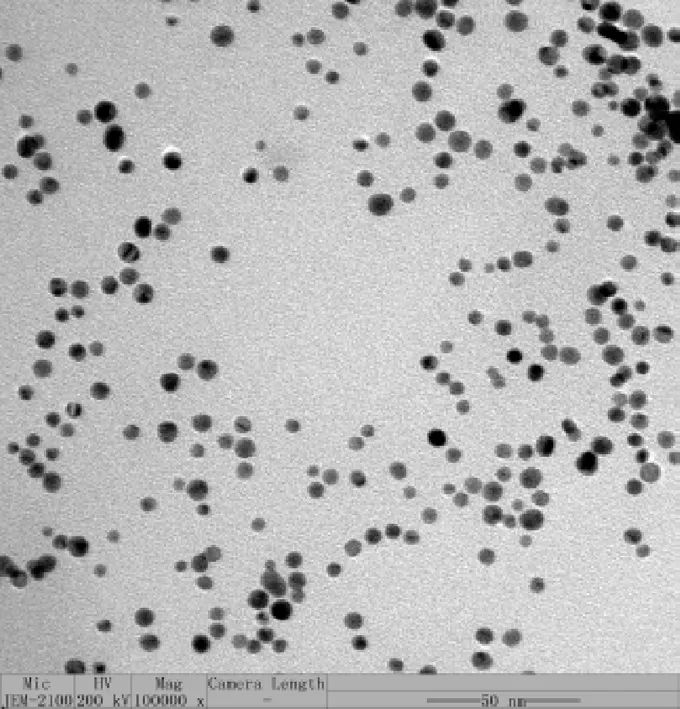
图2 AuNPs的透射电子显微镜图片Fig.2 Transmission electron microscope picture of AuNPs
采用APTES将Fe3O4纳米粒子表面氨基化,用于吸附AuNPs。APTES是一种常用氨基偶联剂,水解产生的羟基可与磁性纳米粒子表面基团发生脱水反应,将硅烷接枝到磁性纳米粒子的表面[10]。因为APTES末端含有氨基,所以可以在磁性纳米粒子表面形成一个氨基单分子层。AuNPs与Fe3O4纳米粒子通过氨基相交联,从而形成稳定的Fe3O4@Au粒子,结果如图3所示。Fe3O4纳米粒子的表面吸附有密集的AuNPs,表明氨基化的磁性材料可以固载AuNPs。利用振动样品磁强计测量组装型Fe3O4@Au粒子的饱和磁化强度为43 emu/g。试验表明,复合微粒的磁化强度会随着AuNPs的含量升高而产生轻微降低的现象,较低的饱和磁化强度表明制备的Fe3O4@Au粒子中Fe3O4纳米粒子相对含量低而AuNPs相对含量高。综上所述,Fe3O4@Au的饱和磁化强度可以一定程度上阻止纳米磁性团簇的聚合,同时可以满足纳米磁性团簇磁分离和回收的条件。

图3 Fe3O4@Au粒子透射电子显微镜图片Fig.3 Transmission electron microscope picture of Fe3O4@Au particles
3.2 金磁微粒模拟酶活性的验证
由图4可知,当体系中只有H2O2和Fe3O4@Au粒子存在时,没有氧化还原峰产生,即体系中没有发生氧化还原反应,说明H2O2的电化学活性较低,H2O2和Fe3O4@Au粒子不足以产生电流响应;当体系中有CC和H2O2存在时,氧化还原峰产生,即体系中发生氧化还原反应,这可能是由于H2O2在溶液中产生了微量的具有氧化活性的自由基,而这些微量的自由基与CC发生氧化还原反应,从而产生电流峰;当体系中加入CC与Fe3O4@Au时,氧化还原峰产生,说明Fe3O4@Au可一定程度上催化溶液中的氧产生自由基,并与CC发生氧化还原反应,促进电子转移,也证明Fe3O4@Au具有过氧化物模拟酶的活性;当体系中同时存在CC、H2O2和Fe3O4@Au时,氧化峰电流绝对值明显增大,说明Fe3O4@Au作为过氧化物模拟酶极大地催化H2O2产生大量的具有氧化活性的自由基,促使CC氧化为邻苯醌,并伴随有大量的电子转移,增加电流响应,从而增大氧化电流峰。因此,应采用同时存在CC、H2O2和Fe3O4@Au的体系进行试验。综上所述,证明Fe3O4@Au具有过氧化物模拟酶的催化活性,也证明其作为过氧化物模拟酶可起到增强电化学信号的作用。
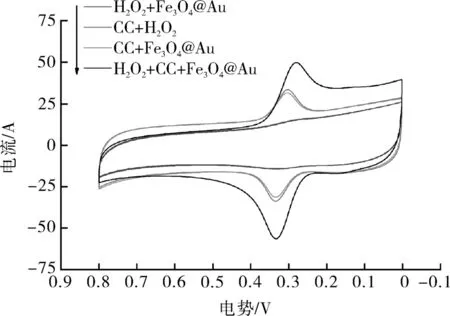
图4 模拟酶活性验证曲线Fig.4 Validation curve of simulated enzyme activity
3.3 单因素试验优化检测体系
3.3.1 金磁微粒添加量对电化学检测体系的影响
由图5(a)可知,体系总体积为10.40 mL,Fe3O4@Au添加量在0.005~0.012 5 g范围内时,氧化峰电流绝对值随添加量的增加逐渐增大。这是由于一方面,随着Fe3O4@Au添加量的增加,体系内的模拟酶活性也增强,从而促进H2O2催化反应产生更多具有氧化活性的自由基,进而与CC发生氧化还原反应,增加电子转移产生电流响应;另一方面,有少量的Fe3O4@Au附着于电极的表面,增大电极的灵敏度。当Fe3O4@Au添加量处于0.012 5~0.015 g范围内时,氧化峰电流绝对值明显下降,这是由于随着体系中Fe3O4@Au添加量不断地增加,纳米粒子发生团聚现象,导致复合纳米模拟酶催化活性逐渐降低[11]。综上所述,Fe3O4@Au添加量在0.012 5 g时电化学检测效果最优。因此,Fe3O4@Au添加量选取0.01,0.012 5,0.015 g参与正交设计优化试验最为适合。
3.3.2 温度对电化学检测体系的影响
由图 5(b)可知,当温度处于 4~20 ℃范围内时,随着温度的增加,氧化峰电流绝对值不断地增大。当温度处于20~30 ℃范围内时,随着温度的增加,Fe3O4@Au模拟酶的催化活性增强,体系的反应速率迅速增大,产生大量的氧化自由基,并与CC发生氧化还原反应,增大电子转移速率和电化学响应,因此氧化峰电流绝对值显著升高。当温度处于30~50 ℃范围内时,反应速率明显下降,由于在较高的温度下,Fe3O4@Au模拟酶的催化活性受到了一定程度的抑制,使得体系中电子转移速率减小。综上所述,温度选取30,40,50 ℃参与正交设计优化试验最为适合。
3.3.3 pH值对电化学检测体系的影响
由图5(c)可知,当pH=5时,氧化峰电流绝对值达到最高点,此时Fe3O4@Au模拟酶的催化效果最为显著。当pH=4时,氧化峰电流绝对值显著下降,这是由于在较酸性溶液中含有大量的质子,从而影响反应体系中电子的转移,降低电化学的响应。当pH处于5~9范围内时,随着pH值不断地增加,氧化峰电流绝对值明显的降低,这可能是由于体系中的质子随着pH值不断地增加而减少,而质子参与体系的氧化还原反应[12],当质子处于短缺的状态时,体系很难发生氧化还原反应,电子转移量减少,电化学响应降低,从而氧化峰电流绝对值降低。综上所述,选取pH值为4,5,6参与正交设计优化试验最为适合。
3.3.4 扫描速率对电化学检测体系的影响
由图5(d)可知,随着扫描速率的逐渐增加,体系的氧化峰电流绝对值显著地上升。这是由于体系中的电子转移过程受控于扩散效应[13],扫描速率增加,电子转移速率随之增大,电化学响应增加,从而氧化峰电流绝对值增高。因此,选取扫描速率为0.06,0.08,0.10 V/s参与正交设计优化试验最为适合。
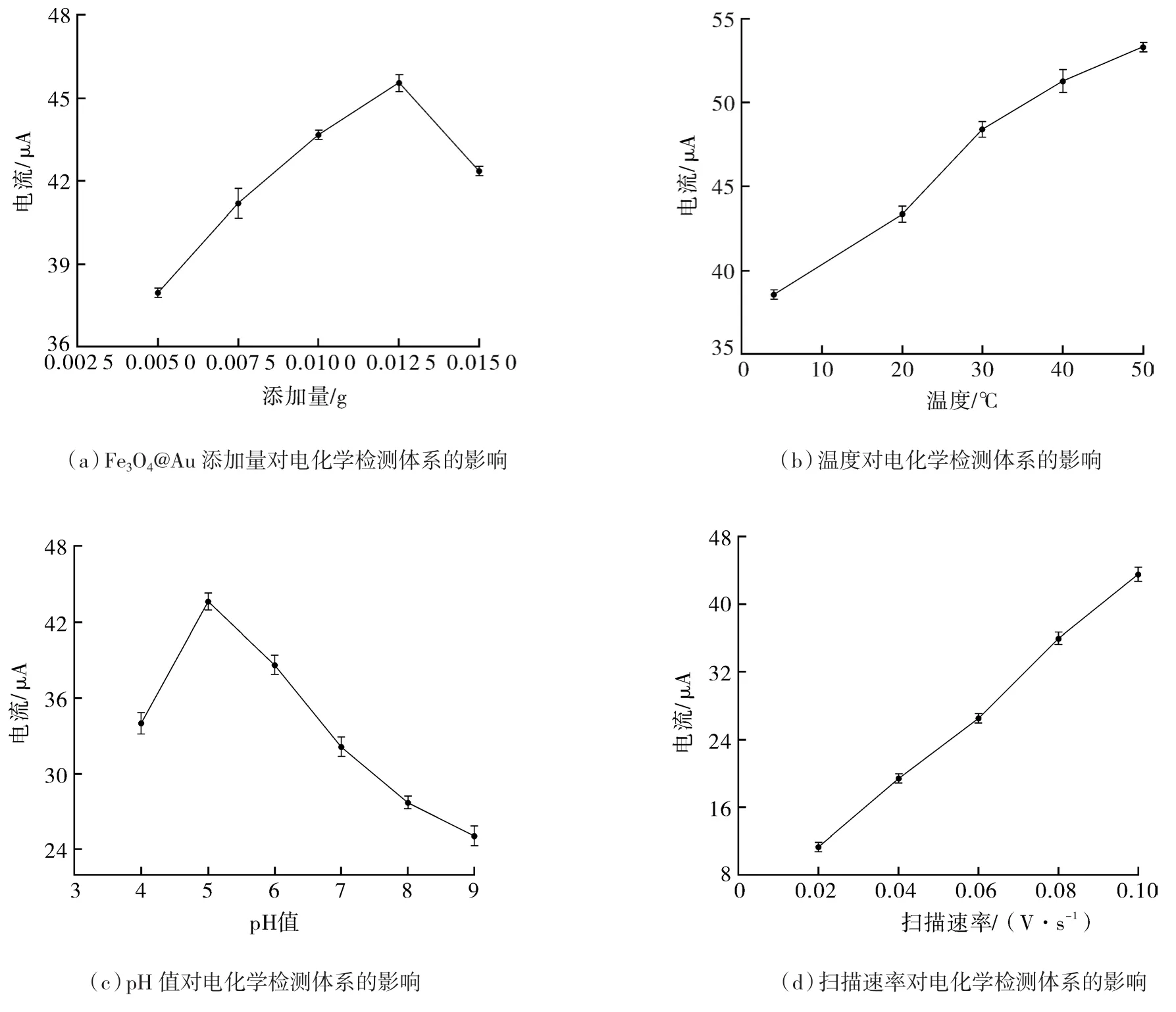
图5 单因素优化CC电化学增强检测体系Fig.5 Single-factor optimization of CC enhanced electrochemical detection system
3.4 正交试验设计优化检测体系
由表1可知,通过极差分析可得到试验各因素对氧化峰电流绝对值的影响主次顺序:C>D>A>B。通过极差分析确定的最优试验方案组合为A3B2C3D2,即在检测体系体积为10.40 mL时,反应温度50 ℃,Fe3O4@Au添加量0.012 5 g/mL,扫描速率0.10 V/s和缓冲液pH=5。正交优化的结果与单因素优化结果基本吻合,以最优条件进行3次平行试验,氧化峰电流绝对值平均值约为55.54 μA。综上所述,说明扫描速率是影响Fe3O4@Au模拟酶催化体系的主要因素,温度、pH值和Fe3O4@Au添加量对模拟酶检测CC体系也有相应的影响。
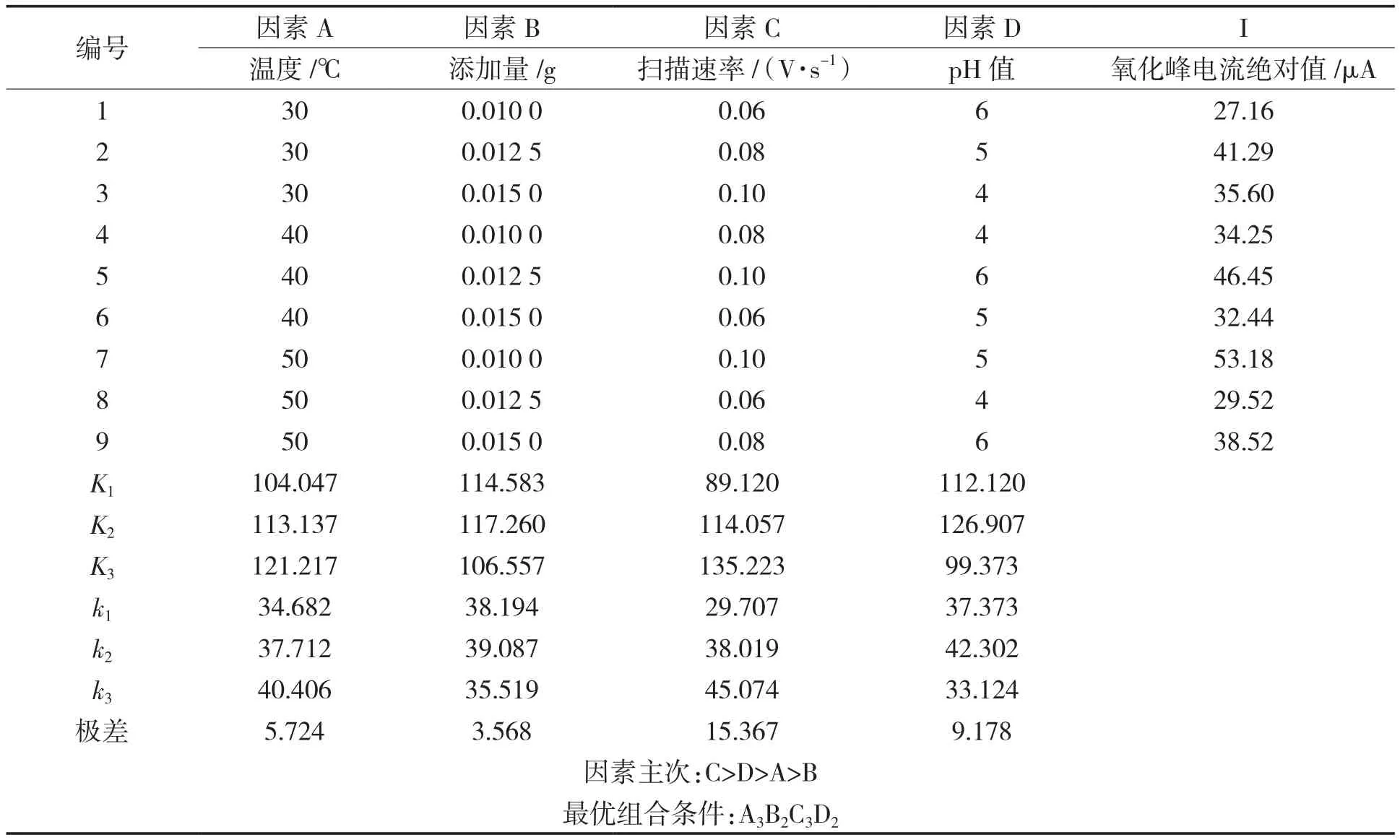
表1 正交试验结果分析Tab.1 The result of orthogonal experiment
3.5 模拟酶检测体系的工作曲线、检测限和回收率
由图6可知,CC浓度在0.001~0.1 mmol/L范围内,与氧化峰电流绝对值具有良好的线性关系,工作曲线回归方程为y=1189.2x+39.693,相关系数R2=0.991 5,计算最低检出限为 0.014 89 μmol/L。为评估体系的检测实用性,选取浓度为0.005 mmol/L和0.025 mmol/L的CC标准溶液,在最优的检测体系下,根据所得的工作曲线回归方程,进行回收率的评价,计算其回收率分别为97.10%和101.44%。结果表明,在Fe3O4@Au模拟酶催化的电信号增强效应下,所建立的检测方法对CC具有较高的灵敏度和精密度。
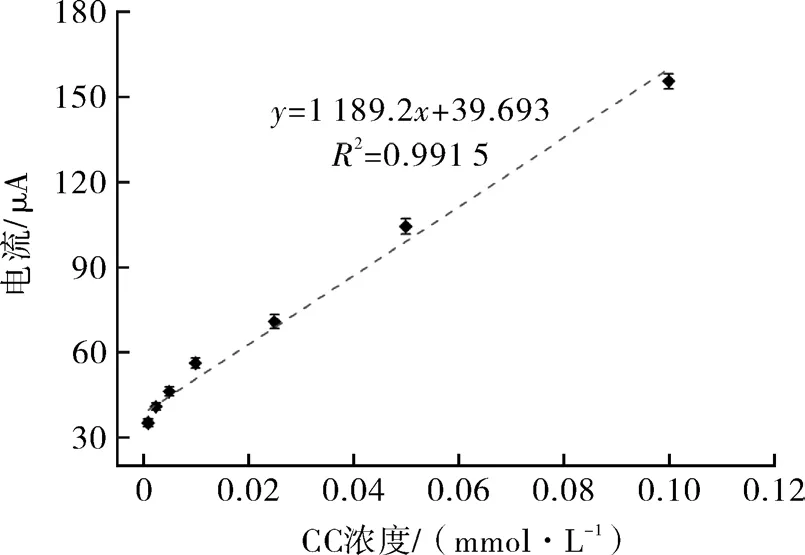
图6 模拟酶电化学增强体系检测CC的工作曲线Fig.6 Working curve of CC detection by mimetic enzyme electrochemical enhancement system
3.6 模拟酶检测邻苯二酚的抗干扰性研究
选取食品及环境中6种常见物质作为干扰物质,对体系的抗干扰性能进行评估。以浓度为0.01 mmol/L的CC作为参照标准,选取浓度为10 mmol/L 的 MgSO4、KCl、AlCl3、Zn(NO3)2、CaCl2和葡萄糖作为干扰物质。由图7可知,电化学增强体系对 MgSO4、KCl、AlCl3、Zn(NO3)2、CaCl2和葡萄糖没有显著的电流响应,而对CC表现出显著的电流响应,具有较高的氧化峰电流绝对值。表明该电化学增强体系对CC的检测具有良好的选择性和抗干扰性能。
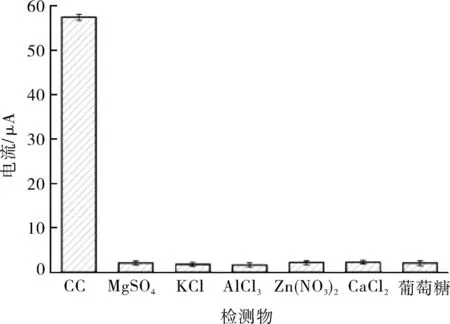
图7 检测体系的抗干扰性Fig.7 Anti interference of detection system
4 结语
本文将AuNPs包覆于Fe3O4磁性纳米粒子的表面,以减少Fe3O4磁性纳米粒子的聚集,制备饱和磁化强度为43 emu/g的具有过氧化物模拟酶活性的Fe3O4@Au复合纳米粒子。通过活性验证试验证明该模拟酶具有良好的催化活性。通过单因素试验和正交试验确定电化学增强检测体系的最佳方案,即在检测体系体积为10.40 mL下,反应温度为50 ℃,金磁微粒添加量为0.012 5 g/mL,扫描速率为0.10 V/s,缓冲溶液pH=5。此外,经试验证明该电化学增强检测体系具有较低的检测限、良好的抗干扰性和选择性。可以高效、准确和灵敏地检测CC的浓度,为食品质量安全检测工作提供一种高效便捷的途径。
