1种新型喹唑啉类抗癌试剂的合成及其抗癌活性研究
2022-03-22李万婷石海龙
张 晗 李万婷 石海龙 李 琰
(绍兴文理学院 化学化工学院,浙江 绍兴 312000)
0 引言
ROS包括一系列的氧自由基和非自由基型ROS.在正常的生理条件下,ROS在生物体系中可通过很多刺激因素生成,但在抗氧化酶的作用下,它又会被反应消耗掉从而保持着一个动态的平衡[1].作为信号分子的一种,ROS被证实可以参与很多细胞信号转导的过程,对维持机体正常的生理功能至关重要[2].而另一方面,细胞内ROS的生成一旦超负荷,会导致DNA、蛋白质等很多细胞重要大分子的结构破坏、功能紊乱,触发氧化还原敏感的细胞死亡信号通路,导致细胞生长抑制甚至死亡[3].研究表明,癌细胞具有线粒体功能缺陷、无限制增殖、新血管快速形成、向其他组织转移等恶性特征.为了满足其快速失控的生长所需要的能量供给,癌细胞内的氧化还原状态相比正常细胞发生了明显的变化,其ROS的水平明显升高.因此破坏细胞抗氧化的能力或增加细胞内氧化应激的程度,对于癌细胞来说显得更加致命[4].癌细胞与正常细胞氧化还原状态的不同成为癌细胞的一大致命弱点,也成为通过促ROS生成的策略来实现癌症治疗的依据.这一新的抗癌策略受到越来越多研究者的关注和认同.即利用促氧化剂诱导ROS产生,破坏癌细胞正常生长增殖所依赖的氧化还原调控能力,使癌细胞先于正常细胞到达死亡线,而正常细胞由于其较低的ROS本底水平而免受其害[4].
据报道,很多导致细胞功能异常,细胞周期紊乱及凋亡从而杀死癌细胞的毒性试剂都是通过诱导ROS的产生来发挥作用的,包括常用的化疗试剂如市售的抗癌药5-氟尿嘧啶[5]和紫杉醇[6].更有意思的是,在基于ROS的抗癌药物中,很多都含有Michael受体单元.Michael受体作为亲电试剂可以靶向很多细胞防御体系的功能蛋白,包括负责机体防御反应、细胞凋亡及肿瘤生长抑制过程信息传递的NF-κB或负责维持细胞氧化还原稳态的硫氧还蛋白还原酶等.Michael受体单元可与靶蛋白功能区域的巯基(-SH)残基发生共价加成反应破坏其功能性,或通过蛋白半胱氨酸上-SH和其二硫键(-S-S-)的转换实现对靶蛋白的氧化修饰,导致氧化还原体系的破坏,进而诱导细胞凋亡.因此含有Michael受体单元(a,b-不饱和酮)药效团的亲电小分子已成为近年来抗癌药物研究的一大热点[7].例如姜黄素[8]、二甲基富马酸[9]、肉桂醛[10]、6-姜烯酚[11]、小白菊内酯[12]及荜茇酰胺[13]等含有a,b-不饱和酮结构的天然来源的亲电小分子都可通过促进ROS的生成而诱导癌细胞凋亡.尤其是小白菊内酯和荜茇酰胺都具有非常优越的癌细胞选择性,不阻滞正常细胞的生长[12-13],这也进一步证实了利用癌细胞的氧化还原缺陷来选择性杀死癌细胞的策略具有合理性[4].
喹唑啉杂环是很多药物结构中重要的核心骨架,具有抗炎、抗氧化、抗肿瘤等非常广谱的生理活性[14].在近年来基于喹唑啉骨架的药物优化设计工作中也发现了很多具有促氧化作用的喹唑啉类抗癌先导化合物[15].QNZ(图1)也是一种喹唑啉类化合物,由于其优异的NF-κB抑制活性而成为明星分子[16],最近的研究发现它同时具有抗癌细胞增殖的活性[17].抗癌药物阿法替尼也有着与QNZ相同的喹唑啉母环结构(如图1),并且在喹唑啉环的6位具有一个Michael受体单元,Michael受体单元的存在对其不可逆地抑制表皮生长因子受体(EGFR)起着重要的作用.这引起了我们对这一喹唑啉母环结构进一步修饰的极大兴趣.
本文基于NF-κB抑制剂QNZ与EGFR抑制剂阿法替尼的结构共性,通过分子骨架杂合,设计合成一种新型亲电分子QNZ-Afa(图1).
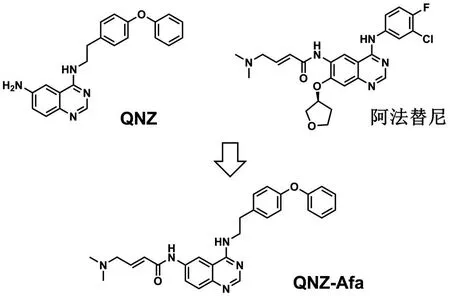
图1 QNZ、阿法替尼及化合物QNZ-Afa的分子结构
1 实验
1.1 材料及所用仪器
RPMI-1640培养基、噻唑蓝(MTT)、2′,7′-二氯荧光黄(DCFH-DA)等购于美国Sigma-Aldrich有限公司;凋亡试剂盒购于美国BD公司;人宫颈癌细胞(Hela)、人肝癌细胞(HepG2)及人脐静脉内皮细胞(HUVEC)购于中科院上海细胞库;其他试剂均为分析纯以上级别.Bruker AV 400核磁共振仪(瑞士布鲁克拜厄斯宾);SX-500高压灭菌锅(日本Tomy Digital);5430R高速冷冻离心机(德国艾本德);FACSCanto流式细胞仪(美国BD);CryoCube F570h超低温冰箱(德国艾本德);SB-2000型旋转蒸发仪(德国海道夫);真空干燥箱(上海一恒);电热鼓风干燥箱(上海一恒);RCT磁力搅拌器(IKA公司,德国);Infinite M200酶标仪(瑞士Tecan).
1.2 化合物QNZ-Afa的合成
化合物QNZ-Afa可根据图2中所示的路线进行合成,具体步骤如下:
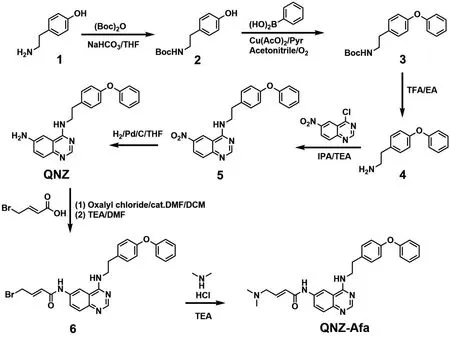
图2 化合物QNZ-Afa的合成路线
叔丁基(4-羟基苯乙基)氨基甲酸酯(2)[18]
首先将4-(2-氨乙基)苯酚(1,0.15 mol)溶解于200 mL四氢呋喃中,并依次加入碳酸氢钠(0.3 mol)和二碳酸二叔丁酯(0.165 mol),于室温下搅拌过夜.反应液过滤后得到浅棕色的粗产物2,不再分离纯化,待用.
叔丁基(4-苯氧基苯乙基)氨基甲酸酯(3)[18]
将化合物2(0.15 mol)溶解于400 mL干燥的乙腈中,并在O2氛下于室温中依次加入苯基硼酸(0.225 mol)、吡啶(1.5 mol)及无水醋酸铜(0.15 mol).反应液在35 ℃下搅拌过夜,旋转蒸发除去溶剂.将得到的固体残渣重新溶于500 mL乙酸乙酯,搅拌2 h后过滤,收集滤液,依次用氨水(33%,100 mL)、纯水(200 mL)、盐酸溶液(6 N,150 mL)和饱和食盐水(50 mL)洗两次,用无水NaSO4干燥,过滤后旋干.得到的固体粗产物再经过柱层析(石油醚/乙酸乙酯,100/1至10/1)分离纯化得到白色固体氨基甲酸酯3(产率86.7%).
2-(4-苯氧基)苯乙胺(4)[18]
将化合物3(0.10 mol)溶于60 mL乙酸乙酯,并于室温下逐滴加入60 mL三氟乙酸,然后回流12 h.旋转蒸发除去溶剂后,加入500 mL二氯甲烷和200 mL水溶解反应残渣,向此两相体系中缓慢加入碳酸钠直至无明显的气泡生成,此时pH≈10.水相用200 mL二氯甲烷进行萃取,合并所有有机相,洗涤(饱和食盐水),无水NaSO4干燥,过滤后旋干.得到的固体粗产物再经过柱层析(二氯甲烷/甲醇,50/1至30/1)分离纯化得到浅黄色油状产物4(产率91.3%).
6-硝基-4-(4-苯氧基苯乙氨基)喹唑啉(5)[18]
将化合物(0.09 mol)、4-氯-6-硝基喹唑啉(0.086 mol)及三乙胺(0.129 mol)溶解于异丙醇,并分别在室温下搅拌4 h,在15 ℃下搅拌4 h.过滤得到反应沉淀物,依次用冷的异丙醇/水(5/1,100 mL)和异丙醇(50 mL)进行洗涤,真空干燥后得到黄色结晶状固体硝基喹唑啉5(产率84.8%).
6-氨基-4-(4-苯氧基苯乙氨基)喹唑啉(QNZ)[18]
将化合物5(0.073 mol)溶解于400 mL四氢呋喃中,并在氢气氛下向溶液中添加催化量的Pd/C(5%).反应液在室温下搅拌5 h,过滤除去Pd/C,收集滤液并浓缩,得到的固体残余物在乙酸乙酯中进行重结晶,得到浅黄色粉末状固体产物QNZ(产率89.3%).
6-(4-溴巴豆酰氨基)-4-(4-苯氧基苯乙氨基)喹唑啉(6)
将4-溴巴豆酸(0.073 mol)溶解于20 mL干燥的二氯甲烷中,室温下加入草酰氯(0.08 mol),滴加2滴N,N-二甲基甲酰胺,继续搅拌0.5 h,旋转蒸发除去溶剂后,得到4-溴巴豆酰氯,待用.将化合物QNZ(0.56 mmol)和三乙胺(1.12 mmol)溶于5 mL干燥的四氢呋喃和1 mL N,N-二甲基甲酰胺的混合溶剂中,在0 ℃磁力搅拌下滴加现制的4-溴巴豆酰氯(0.73 mmol),升高温度至室温,并继续搅拌0.5 h,旋转蒸发除去溶剂.得到的固体粗产物经过柱层析(二氯甲烷/甲醇,50/1至25/1)分离纯化得到浅黄色粉末状固体产物6(产率66.3%).
6-(4-二甲氨基巴豆酰氨基)-4-(4-苯氧基苯乙胺基)喹唑啉(QNZ-Afa)
将化合物6(0.33 mmol)和盐酸二甲胺(0.39 mmol)溶解于4 mL N,N-二甲基甲酰胺中,加入三乙胺(0.99 mmol),室温下搅拌3 h,旋转蒸发除去溶剂后,得到的粗产物经过柱层析(二氯甲烷/甲醇,50/1至10/1)分离纯化得到浅黄色粉末状固体产物QNZ-Afa(产率56.4%).
QNZ-Afa:熔点131.4~132.0 ℃;1H NMR(400 MHz,DMSO-d6),δ2.21(s,6H),2.95-2.99(t,J=7.2 Hz,2H),3.10-3.12(d,J=5.6 Hz,2H),3.76-3.78(d,J=7.2 Hz,2H),6.35-6.39(d,J=15.6 Hz,1H),6.78-6.85(m,1H),6.95-6.99(t,J=7.6 Hz,4H),7.10-7.14(t,J=7.6 Hz,1H),7.29-7.30(d,J=8.8 Hz,2H),7.36-7.40(m,2H),7.66-7.68(d,J=9.2 Hz,1H),7.73-7.76(m,1H),8.30-8.32(t,J=5.2 Hz,1H),8.43(s,1H),8.59-8.60(d,J=1.2 Hz,1H),10.38(s,1H);13C NMR(100 MHz,DMSO-d6),δ34.3(1C),42.7(1C),45.5(2C),60.1(1C),112.1(1C),115.5(1C),118.7(2C),119.3(2C),123.6(1C),126.3(1C),126.8(1C),128.5(1C),130.4(2C),130.7(2C),135.3(1C),136.6(1C),142.0(1C),146.3(1C),154.5(1C),155.2(1C),157.5(1C),159.4(1C),163.7(1C);MS(ESI)M/Z468[M+H]+.
1.3 化合物QNZ-Afa对癌细胞增殖抑制活性的测定
采用MTT比色法测定化合物QNZ-Afa对癌细胞的增殖抑制活性.将Hela或HepG2细胞以3×103个/孔,HUVEC细胞以5×103个/孔的密度分别种于96孔板中,37 ℃孵育过夜后加入一定浓度梯度(0、5 mM、10 mM、15 mM、20 mM、25 mM、30 mM、40 mM、50 mM)的QNZ-Afa,同时设定不加药处理的对照孔,在培养箱中继续孵育48 h后,吸出培养基,每孔加入100 mL MTT,37 ℃下作用4 h.弃去MTT培养液,每孔加入100 mL色谱纯的DMSO,混匀5 min,使生成的有色结晶溶于DMSO中.通过酶标仪在570 nm处进行吸光度值的检测.抗氧化剂对QNZ-Afa细胞增殖抑制活性的影响也采用相同的MTT法测定,抗氧化剂处理组需提前1 h加入NAC(10 mM)或VE(500 mM),再加入指定浓度的待测化合物孵育48 h.细胞存活率表示为相对于对照组的百分比,计算公式如下:细胞存活率(%)=加药组吸光度值/对照组吸光度值×100%.每组实验均独立重复3次.
1.4 细胞凋亡的测定
本文采用Annexin V-PI双染色法测定化合物诱导Hela细胞凋亡的能力.将Hela细胞以2×105个/孔的密度种至六孔板,于37 ℃细胞培养箱培养24 h后换液,加入化合物QNZ-Afa(5 mM、10 mM、15 mM),孵育48 h,同时设定不加药处理的对照孔.药物处理后吸出培养基,加入胰蛋白酶消化并分别收集各孔细胞于2 mL的离心管中,250 g转速离心6 min除去培养基后,用4 ℃预冷的PBS缓冲液(1 mL/管)以相同转速离心洗1~2次.对每管中的细胞进行计数,根据计数结果用稀释至1×的Binding缓冲液调整细胞密度,每管中分别取两份进行Annexin V与PI的单染.室温下染色15 min,然后加入1×的Binding缓冲液稀释,并于1 h内通过FACSCanto流式细胞仪进行检测,每管采集细胞数104个,激发波488 nm,发射波长530 nm.通过FACSDiva软件分析得到细胞不同状态的比例.抗氧化剂对QNZ-Afa诱导细胞凋亡活性的影响也采用相同的方法测定,抗氧化剂处理组需要提前加入NAC(10 mM)预处理1 h,再加入15 mM的QNZ-Afa孵育48 h,同时设定抗氧化剂处理后不加药的对照孔.每组实验均独立重复3次.
1.5 细胞内ROS水平的测定
荧光探针DCFH-DA具有细胞膜渗透性,它进入细胞后可在细胞酯酶的作用下水解得到不可透膜的DCFH,水解产物被胞内ROS氧化生成DCF.DCF是荧光物质,其荧光强度的大小就可反映细胞内ROS的浓度.将Hela细胞以3×105个/孔的密度种至六孔板中,于37 ℃细胞培养箱培养24 h后换液,加入化合物QNZ-Afa(5 mM、10 mM、15 mM),药物作用3 h、6 h或9 h后吸出培养基,加入胰蛋白酶消化并分别收集各孔细胞于2 mL离心管中,250 g离心6 min除去培养基后用PBS缓冲液(1 mL/管)以相同转速离心洗1~2次,然后加入DCFH-DA染料(终浓度为3 mM),置于37 ℃温箱中避光染色0.5 h.用PBS缓冲液洗去残余染料后通过流式细胞仪进行检测.所测荧光的激发波为488 nm,发射波长为525 nm.抗氧化剂对QNZ-Afa诱导细胞内ROS生成的影响也采用相同的方法测定,抗氧化剂处理组需要提前加入NAC(10 mM)或VE(500 mM)预处理1 h,再加入15 mM的QNZ-Afa孵育9 h,同时设定抗氧化剂处理后不加药的对照孔.结果相对于对照组进行归一化处理.每组实验均独立重复3次.
2 结果与讨论
2.1 化合物的合成
基于喹唑啉类抗癌药物QNZ与阿法替尼的结构共性,通过分子骨架杂合,设计合成了一种新型亲电分子QNZ-Afa(图1),以4-(2-氨乙基)苯酚为原料通过图2所示的合成路线首先合成化合物QNZ,再与4-溴巴豆酰氯反应得到a,b-不饱和酰胺结构,最后引入二甲氨基,得到目标化合物QNZ-Afa.
2.2 QNZ-Afa通过ROS依赖的方式选择性地抑制癌细胞增殖
通过MTT法测定了化合物QNZ-Afa对Hela、HepG2及HUVEC的细胞增殖抑制活性,如图3A所示,化合物作用48 h后,细胞存活率都表现出浓度依赖的降低.QNZ-Afa对Hela、HepG2及HUVEC三种细胞增殖抑制的IC50值分别为10.8 mM、16.7 mM和23.2 mM,从结果可知,QNZ-Afa在正常细胞HUVEC中表现出最小的细胞毒性,说明癌细胞相比于正常细胞更容易受到QNZ-Afa的毒性影响而被杀死,尤其Hela细胞对QNZ-Afa的耐受性最弱(图3A).
基于QNZ-Afa对Hela细胞明显的选择性,采用Hela细胞作为模型进一步对其细胞毒性机制进行了研究.ROS是导致癌细胞生长阻滞并死亡的重要诱因之一.通过使用两种ROS清除剂,N-乙酰半胱氨酸(NAC)和a-生育酚(VE)来阐明ROS在QNZ-Afa的毒性机制中是否发挥作用.如图3B所示,NAC预处理1 h导致QNZ-Afa对Hela细胞增殖的抑制作用被完全逆转.NAC是含有巯基的抗氧化剂,它们既可利用抗氧化活性清除ROS,也可以作为亲核试剂与QNZ-Afa发生反应从而消除其Michael加成活性位点.相比之下,非亲核性的VE只能作为抗氧化剂发挥作用,而VE预处理1 h后对QNZ-Afa抗癌细胞增殖的活性也表现出显著的抑制效果.上述结果清晰地表明:ROS的产生对QNZ-Afa的细胞毒性起着至关重要的作用,而另一方面,Michael受体单元在这一过程中也作出了一定贡献.
2.3 QNZ-Afa通过ROS依赖的方式诱导HepG2细胞凋亡
抑制细胞增殖导致细胞死亡的机制有很多种,通过PI染色及Annexin-V-FITC/PI双染的方法探究了QNZ-Afa的增殖抑制活性是否来自于细胞凋亡诱导作用.从图4可以看出,不同浓度的QNZ-Afa处理48 h后显著地诱导了Hela细胞凋亡的发生,并且具有浓度依赖关系,15 mM的QNZ-Afa使细胞凋亡的比例超过了65%.ROS清除剂NAC预处理后可明显地逆转QNZ-Afa所诱导的细胞凋亡,而NAC单独作用不会引起细胞凋亡的发生.这与细胞毒性测定中得到的结果相一致.以上结果也证实了QNZ-Afa诱导的细胞凋亡是其细胞增殖抑制活性机制的重要部分,并且这个过程中ROS扮演着重要的角色.
2.4 QNZ-Afa诱导Hela细胞中ROS的大量产生
基于前期实验所证实的ROS的重要作用,采用流式细胞仪对Hela细胞内ROS的水平进行了检测.结果如图5所示,化合物QNZ-Afa能显著地诱导Hela细胞中ROS的产生,ROS水平随着浓度的增大而升高,从不同时间点的数据可以看出ROS的产生有时间依赖性.15 μM的QNZ-Afa作用9 h后可将细胞内ROS的水平提升到对照组水平的3.5倍.
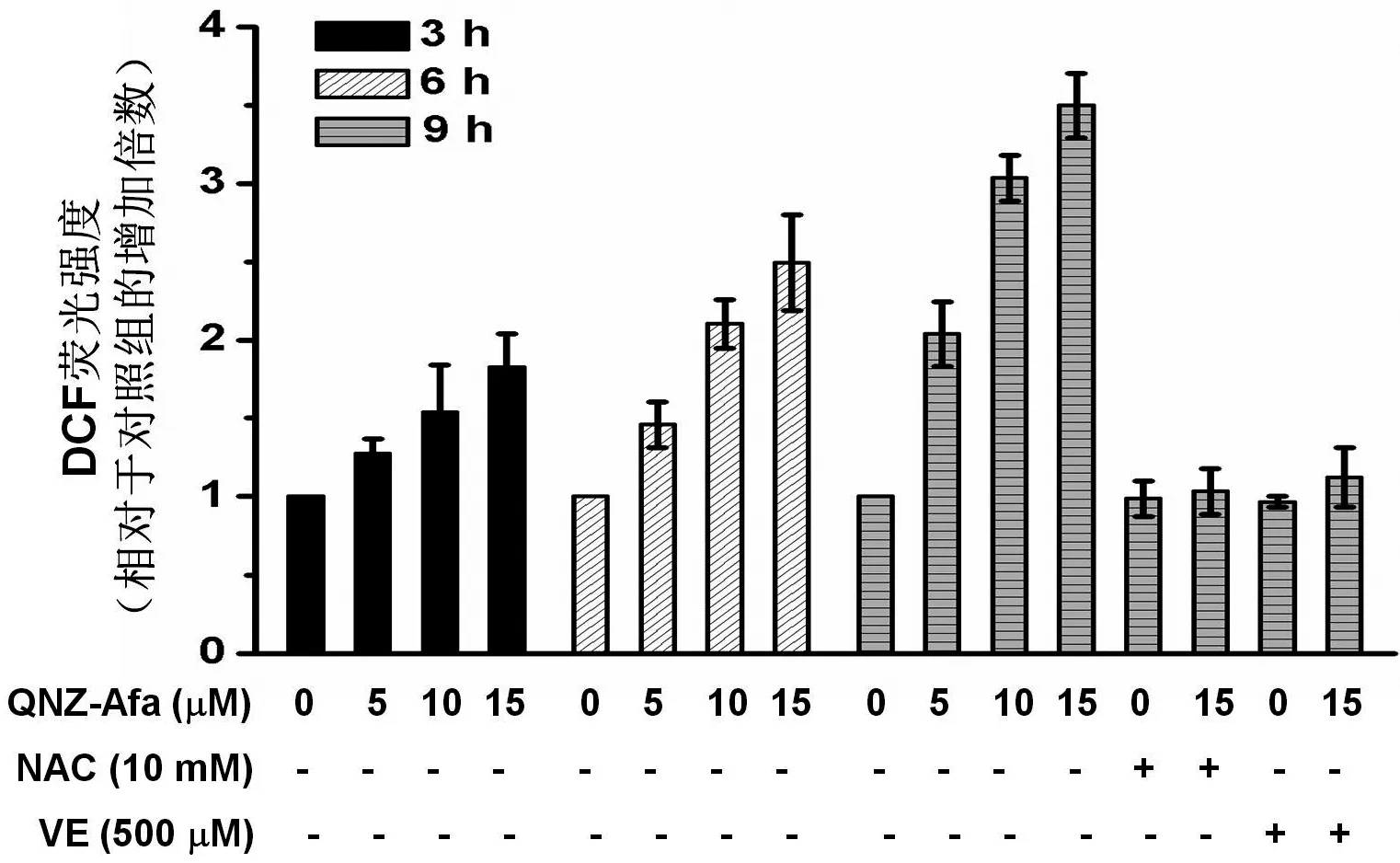
图5 QNZ-Afa作用后Hela细胞内ROS水平的变化及抗氧化剂NAC、VE对QNZ-Afa诱导的细胞内ROS累积的影响
值得注意的是,采用NAC或者VE都会导致QNZ-Afa促进ROS生成的能力大大削弱甚至丧失,在抗氧化剂的预孵育1 h后,同样作用9 h,15 μM的QNZ-Afa对细胞内的ROS的水平几乎没有影响(图5).而抗氧化剂NAC或VE单独预处理1 h后以不含QNZ-Afa的培养基孵育相同时间,测得的胞内ROS含量与对照组也无明显变化(图5).上述结果表明,QNZ-Afa的促氧化能力很大程度上贡献了其细胞凋亡诱导的活性,并且Michael受体单元也起到了必不可少的作用.
3 总结
本文基于NF-κB抑制剂QNZ与EGFR抑制剂阿法替尼的结构共性,通过分子骨架杂合,设计合成了一种新型喹唑啉类亲电分子QNZ-Afa.并首次证实QNZ-Afa是一种优异的选择性抗癌试剂,它可以选择性地阻滞Hela细胞的增殖,而对正常细胞HUVEC的细胞毒性却大大减弱.抗氧化剂NAC或VE对QNZ-Afa抗癌细胞增殖能力的逆转作用明确地表明了ROS在QNZ-Afa对Hela细胞增殖抑制的活性机制中发挥着重要的作用.值得一提的是,与非亲核性抗氧化剂VE不同,作为含有巯基的抗氧化剂,NAC既可作为抗氧化剂清除ROS也可以作为亲核试剂与QNZ-Afa发生反应从而消除其Michael加成活性位点.相比VE,NAC能更彻底地消除QNZ-Afa对Hela细胞的增殖抑制活性.这一结果清晰地表明:ROS的产生对QNZ-Afa的细胞毒性有着很大的贡献,且Michael受体单元在其中也作出了一定贡献.另一方面,细胞凋亡的发生是QNZ-Afa抑制Hela细胞增殖的关键原因,而在这一过程中,Michael受体依赖的ROS的产生也发挥着至关重要的作用.同时,也证实了QNZ-Afa作用后的确可以显著地引起Hela细胞内ROS水平的升高,并且NAC与VE均可以完全逆转QNZ-Afa诱导的ROS累积,这也进一步支持了ROS作为细胞凋亡重要调控者的结论.综上所述,本文设计了一种新型喹唑啉类化合物QNZ-Afa,并发现它通过Michael受体依赖的促氧化作用而表现出选择性的抗癌活性.QNZ-Afa可作为亲电分子靶向癌细胞氧化还原缺陷,诱导Hela细胞内ROS的大量累积进而引发细胞内氧化还原平衡体系的崩溃,ROS升高,最终导致细胞凋亡.以上结论可为基于促氧化策略设计喹唑啉类抗癌试剂提供有价值的依据.
