神经干细胞分离与纯化方法的比较
2022-03-22张晓枫宋孝雄邢婉青
张晓枫,姚 瑶,宋孝雄,邢婉青,喻 斌
(南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
神经干细胞(neural stem cells,NSCs)是存在于脑和脊髓中的未分化细胞,具备自我更新和向神经元、星形胶质细胞、少突胶质细胞分化的潜能[1]。1992年,Reynolds[2]从成鼠脑纹状体分离得到NSCs,而且已经发现在成年和胚胎哺乳动物脑中均有NSCs分布,此后,NSCs用于中枢神经系统退行性疾病及脑损伤修复的研究受到重视。离体细胞评价是药理学研究的重要组成部分,但至今还没有理想的可以替代原代NSCs的细胞株,因此获得稳定而高效的原代NSCs是进行后继生理和药理学研究的重要基础和保障。原代细胞培养的困难主要在于细胞的纯度、得率以及活性方面的控制,虽然已有文献对NSCs的原代分离和细胞纯化方法进行介绍[3],但这些研究往往是对某一种既定的方法进行改良,而并没有对不同分离方法,以及不同纯化方法进行全面的评估。此外各文献报道的培养条件差异很大[4-5],这也必然导致其他研究者在条件选择中的困惑。鉴于此,本次实验对三种分离方法和两种纯化的方法进行比较,其结果可为其他学者的体外NSCs培养体系构建提供技术支持。
1 材料
1.1 实验动物出生24 h内的ICR/Gpt小鼠,雌雄不限,由江苏省集萃药康生物科技有限公司提供,许可证号:SCXK(苏)2018-0008。
1.2 试剂和仪器Neurobasal培养基(批号:21177670)、B-27 Supplements(批号:2175187)、GlutaMAX(批号:2164675)、双抗(批号:2145460)、胰酶(批号:2120917)均购于Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(批号:0315395-1)、表皮生长因子(epidermal growth factor,EGF)(批号:0819179)均购于PeproTech公司;小鼠巢蛋白(Nestin)抗体(批号:31016A32)、小鼠Alexa Fluor 488 goat anti-rabbit IgG(批号:2018207)均购于Invitrogen公司;多聚赖氨酸(Poly-L-lysine solution,PLL)(批号:RNBJ2237)、层粘连蛋白(Laminin)(批号:049M4183V)均购于Sigma公司;肝素钠(批号:722I024)、胰蛋白酶抑制剂(批号:1028D062)、脱氧核糖核酸酶(DNaseⅠ)(批号:623X034)、中性蛋白酶(Dispase)(批号:325U012)、木瓜蛋白酶(Papain)(批号:628L021)、D-无水葡萄糖(批号:526J022)、台盼蓝(批号:722I024)、曲拉通(Trition-100)(批号:829I0210)、细胞核染色液(DAPI)(批号:20200715)购于索莱宝公司。
超净台(SW-CJ-1F,苏州市净化公司);CO2恒温培养箱(MCO-20AIC,日本SANYO公司);荧光倒置显微镜(Ti-S,日本NIKON公司);解剖显微镜(SZ51型日本OLYMPUS公司);细胞计数仪(美国Countstar公司);ImageQuant LAS4000mini成像系统(美国GE公司)。
2 方法
2.1 NSCs不同分离方法比较研究
2.1.1NSCs的分离 将新生24 h乳鼠分为3组,分别为机械吹打组(mechanical pipetting)、胰酶消化组(trypsin digestion)和PDD混合酶消化组[5](木瓜蛋白酶2.5 kU·L-1,中性蛋白酶1 kU·L-1,DNaseⅠ 250 kU·L-1,Papain-Dispase-DNase enzyme digestion,PDD)。各组乳鼠脱颈处死,75%乙醇中消毒5 min,剪开颅骨取出大脑,置于冷磷酸盐缓冲液(phosphate buffered saline,PBS)中,在解剖显微镜下去除脑膜、小脑、嗅球等,用预冷的PBS冲洗组织,吸去多余的PBS,随后按照组别进行不同的分离操作。
(1)机械吹打组:脑组织用手术刀切碎至1 mm3,转移到含有37 ℃预热的基础培养基中,用巴氏滴管吹打至无肉眼可见组织,过400目细胞筛得单细胞悬液,1 000 rpm,离心5 min,弃上清,加入1 mL完全培养基重悬细胞;(2)胰酶消化组:相同体积的碎脑组织转移至预热的0.05%的胰酶[6]中,37 ℃消化7 min,加入0.125 g·L-1胰蛋白酶抑制剂(含0.01 g·L-1DNaseⅠ)混匀,离心,弃上清,加入5 mL完全培养基过筛,离心,加入1 mL完全培养基重悬细胞;(3)PDD混合酶消化组:相同体积的碎脑组织转移至37 ℃预热的PDD混合酶中,37 ℃消化20 min,轻轻吹打细胞后再次37 ℃消化20 min,用巴氏滴管吹打细胞,离心,弃上清,用混合缓冲液(1× HBSS,30 mmol·L-1葡萄糖,2 mmol·L-1HEPES缓冲液,26 mmol·L-1NaHCO3)重悬细胞并过筛,离心,加入1 mL完全培养基重悬细胞。
以上重悬细胞分别用台盼蓝染色,计数总细胞数及存活率。
2.1.2NSCs的培养和神经球直径的检测 采用无血清的培养基进行培养,其中Neurobasal培养基中包含2%B27、1%GlutaMAX、2 mg·L-1肝素、20 μg·L-1EGF、20 μg·L-1bFGF和1%青链霉素。将分离出的单细胞密度调整为1.0×109·L-1,于25 cm2培养瓶内原代培养5 d,每2 d半量换液,并于1、3、5 d检测神经球直径。
2.1.3NSCs的活性和增殖检测 在96孔板内把三种不同分离方法总细胞数以2×108·L-1密度接种,每组5个复孔,分别在1、5 d向细胞悬液中加入10%CCK-8试剂,混匀,继续培养4 h,用酶标仪测定450 nm处的吸光度。
2.1.4Western blot检测Nestin蛋白含量 将培养瓶内培养5 d的细胞取出,RAPI裂解液提取细胞总蛋白后进行蛋白质定量(BCA法),等量蛋白进行SDS-PAGE电泳、转膜和封闭,4 ℃孵育一抗过夜,TBST洗膜后室温孵育二抗,再次洗膜3次,显色成像,利用ImageJ进行灰度和面积计算。以NSCs标志物Nestin和Actin的比值代表Nestin相对表达量,以间接反映NSCs的纯度。
2.2 NSCs不同纯化方法比较研究为了让纯化方法的结果齐同可比,我们选择机械吹打法分离原代NSCs,然后分别采用过筛法和差速离心法纯化NSCs。
2.2.1过筛法 原代神经球直径达100 μm左右,通过200目细胞筛去除杂细胞,颠倒筛子,基础培养基将神经球冲洗下来,离心,弃上清,0.05%胰酶消化,以5×107·L-1密度接种到包被的24孔板的爬片内,待细胞贴壁成球后,荧光鉴定杂细胞数。
2.2.2差速离心法 每2~3 d换液时,分别使用1 000、800、500 rpm离心,获得神经球,去除杂细胞,最后同样使用0.05%胰酶消化成单细胞悬液,以5×107·L-1密度接种,待细胞贴壁成球后,荧光鉴定杂细胞数。
2.2.3Nestin/DAPI双染法检测NSCs纯度 提前用PLL/Laminin包被24孔板内的盖玻片,将单细胞以5×107·L-1的密度接种,培养5 d后,PBS洗去残留培养基,4%多聚甲醛固定30 min,PBS清洗后加0.25%Trition-100室温下透膜15 min,清洗,用1%牛血清白蛋白室温下封闭1 h,吸去封闭液,加入一抗(1 ∶100兔抗鼠Nestin抗体)4 ℃孵育过夜,PBS清洗,加入二抗(1 ∶500山羊抗兔488抗体),37 ℃避光孵育1 h,PBS清洗,滴加DAPI避光染色10 min,PBS清洗,滴加抗荧光淬灭液封片,在荧光显微镜下观察并随机选取5个视野拍照,以Nestin阳性细胞数与DAPI阳性细胞数的比值反应NSCs的纯度。

3 结果
3.1 不同分离方法的原代NSCs生长情况比较原代培养5 d,分别观察1、3和5 d神经球生长情况(Fig 1A)并测量神经球的直径(Fig 1B),提示PDD混合酶消化组得到的NSCs成球速度较机械吹打组和胰酶消化组更快(P<0.01)。

Fig 1 Comparison of three separation methods in neurosphere’s growth situation on day 1,day 3 and day 5 n=3)
3.2 不同分离方法的原代NSCs活性和增殖情况比较3种分离方法都能得到大量的NSCs,台盼蓝染色计数后,与机械吹打组相比,胰酶消化组(P<0.05)和PDD混合酶消化组得到细胞的存活率更高(P<0.01)(Tab 1),CCK-8活性检测结果显示(Fig 2),机械吹打组和胰酶消化组的吸光度低于PDD混合酶消化组,且差异具有显著性(P<0.01);Fig 3结果显示,d 5,机械吹打组和胰酶消化组的吸光度明显低于PDD混合酶消化组,差异具有显著性(P<0.01),提示PDD混合酶消化所得细胞活性更高,增殖更快。

Tab 1 Total cell count and survival rate of three primary
3.3 不同分离方法的原代NSCs的Western Blot检测结果如Fig 4所示,d 5,Western blot结果显示,胰酶消化法和PDD酶消化法Nestin蛋白含量表达高于机械吹打法(P<0.05)。

Fig 2 Activity of primary cells on day 1 n=3)

Fig 3 Activity of primary cells on day 5 n=3)
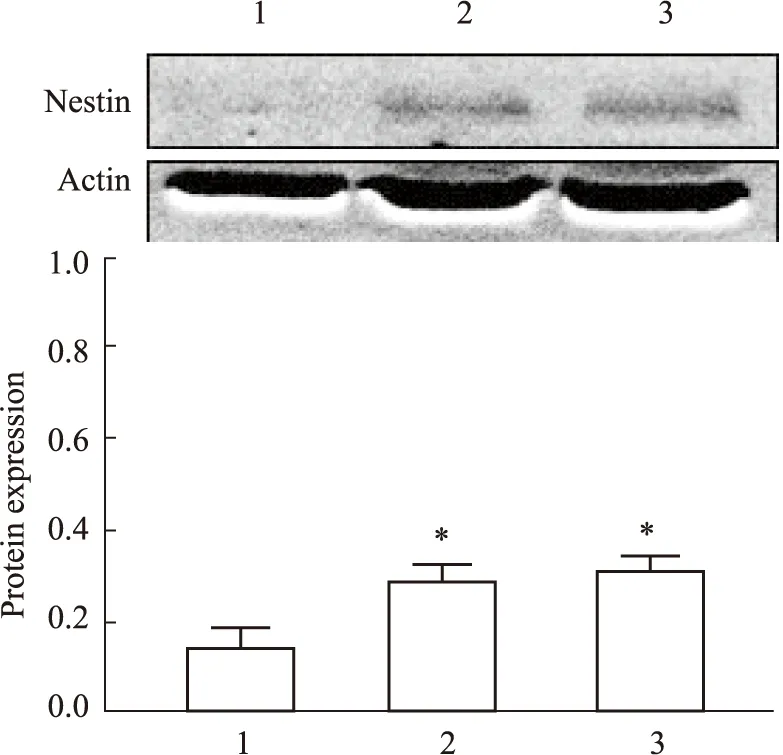
Fig 4 The protein expression of Nestin and Actin by each separation method on day 5 n=3)
3.4 不同分离方法的原代NSCs纯度比较结果对原代培养5 d的细胞进行Nestin/DAPI双染,观察到Alexa Fluor 488标记Nestin发绿光,有细胞染色为阳性,确定为NSCs,只标记DAPI发蓝色荧光的细胞为杂细胞,其中3种分离方法的杂细胞数差异没有显著性(Fig 5A,B)。

Fig 5 Immunofluorescence staining of nestin in separating and purifing primary n=3)
3.5 两种纯化方法的NSCs荧光鉴定结果对两种纯化方法得到的NSCs进行Nestin免疫荧光染色,如Fig 5C,D所示,两种纯化方法的Nestin阳性率均高于原代NSCs(P<0.05)。
4 讨论
目前,分离NSCs常用的方法包括机械吹打法、胰酶消化法,但前者的分离方法得到的细胞存活率低,后者酶的浓度、消化时间难控制;纯化方法包括连续传代法、有限稀释法[5]、免疫磁珠法[12]等,但这些纯化方法周期长、价格昂贵。本文在现有的分离和纯化方法上进行比较,得到原代NSCs存活率更高的分离方法和操作简便且纯度高的纯化方法。
3种分离方法中,机械吹打法虽然获得的细胞数多,但细胞的存活率低、NSCs成球速度慢,在实验操作中吹打至肉眼见不到组织即可,不可过度吹打;胰酶消化法中使用0.05%的胰酶,对乳鼠疏松的脑组织损伤更小;PDD混合酶[7]消化作用温和,对NSCs的损伤较其他两种方法小,且得到的NSCs成球速度快,且这次研究对该方法进行了优化,现有的该方法用于成年小鼠DG区域NSCs的分离,步骤繁琐耗时,因此,优化其步骤,缩短分离时间可以最大限度保证细胞活性。此次研究采用过筛法和差速离心法纯化NSCs,两种纯化方法Nestin鉴定证实两种方法均能有效纯化NSCs,为了减少过筛法中细胞的损失,多次使用培养基吹打收集筛网上的神经球;换液时可以根据神经球的大小改变离心速度,从而差速离心出神经球,去除单细胞或组织碎片,纯化NSCs。Nestin是神经干细胞特异性标志物,文中主要使用免疫荧光双染法鉴定神经干细胞,具有特异性强、速度快的优点,较传统的DAB显色法[13]得到的图片更清晰。
目前,大量实验和临床研究发现,NSCs移植可以分化为神经元并逐渐替代变性神经元,保护神经元免受兴奋性毒性损伤,还可以通过产生神经营养因子,改善疾病症状,从而治疗各种神经退行性疾病和神经损伤性疾病,如帕金森病[7-8]、阿尔茨海默病[9]、亨廷顿病[10]、中风[11]等。因此,比较神经干细胞在体外分离、维持、扩增的最佳培养方法,能够更详细地探索其性质以及调节它们的机制,把基础研究应用到临床。
