类风湿关节炎患者血管紧张素Ⅱ水平与临床炎症指标相关性研究及ARBs类药物的治疗作用
2022-03-22王鑫铭杨春兰董逸翔章乐成门红康涂佳杰
王鑫铭,杨春兰,董逸翔,江 肖,章乐成,门红康,涂佳杰,尹 力
(安徽医科大学1.第一附属医院药剂科、国家中医药管理局中药化学三级实验室、2.临床药理研究所、3.第一临床医学院、4.第一附属医院肾脏内科、5.第一附属医院骨科创伤骨科七东病区、6.药学院、7.第一附属医院骨科、关节外科五东病区,安徽 合肥 230022)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜组织异常增殖以及炎症细胞异常浸润为主要特征的自身免疫性疾病。关节滑膜处炎症细胞大量浸润可刺激成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)异常增殖;进而侵蚀软骨和骨质最终导致关节畸形和运动功能的丧失[1]。研究显示,RA患者中约有40%会合并高血压;同时血压的高低与脑卒中、冠心病、心血管病等不良心血管事件的死亡风险呈连续、独立、直接正相关。而不良心血管事件是导致RA患者死亡的主要原因,约占RA患者总死亡数的40%[2-4]。但是当前RA主要治疗药物如非甾体抗炎药、糖皮质激素、改善病情的抗风湿药以及生物制剂等对RA所继发的不良心血管事件的防治作用有限甚至某些药物能够诱导不良心血管事件的发生。因此探寻新的RA发病机制及潜在药物治疗靶点具有重要意义。
肾素-血管紧张素系统在维持机体正常的心血管功能中具有重要作用。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是肾素-血管紧张素系统主要的效应物,与血管紧张素Ⅱ1型受体(angiotensinⅡ type 1 receptor,AT1R)结合后维持血压平衡等心血管功能稳态。在RA患者机体慢性炎症环境中RAS过度活化,大量AngⅡ可诱导AT1R表达上调;AngⅡ与血管平滑肌上异常上调的AT1R结合引起血管持续收缩升高血压,进而提高RA患者不良心血管事件的发生率。与此同时,异常上调的AngⅡ和AT1R也是RA患者关节进行性破坏的危险因素之一[5]。研究发现血管紧张素受体拮抗剂(angiotesin receptor blockers,ARBs)对多种自身免疫病均有治疗作用。因此,本研究拟基于人群的病例-对照研究,探讨RA患者血浆中AngⅡ水平与患者临床指标之间的相关性;通过构建大鼠胶原性关节炎(collagen-induced arthritis,CIA)模型同时给予血管紧张素受体拮抗剂(angiotensin receptor blockers,ARBs)类药物,明确ARBs类药物对CIA大鼠的治疗作用,以期将ARBs药物用于RA伴高血压患者的临床治疗提供依据。
1 材料与方法
1.1 临床研究对象选择2019~2021年期间医院风湿科住院RA患者共计53人,所有参与者均获得知情同意。RA诊断标准依据美国风湿病学会和欧洲抗风湿病联盟新修订的RA分类标准和评分系统,即:至少1个关节肿痛,临床、超声或MRI证实存在滑膜炎症;同时排除了其他疾病引起的关节炎,并有典型的常规放射学RA骨破坏的改变,可诊断为RA。此外通过对关节受累情况、血清学指标、滑膜炎持续时间和急性时相反应物4个部分进行评分,总得分>6分也可诊断RA[6]。此外选取血压、血常规及相关炎症指标均在正常范围内的来院体检人群32例作为对照组。本研究涉及的血液样本均为我院检验科完成临床实验室检查后获得。RA患者及对照组的滑膜样本由我院关节外科行关节置换术后的废弃物。研究涉及的临床样本,属于生物样本的二次利用;符合医学伦理学标准并通过安徽医科大学医学临床医学研究伦理委员会认证(PJ-2021-14-33)。
1.2 患者临床资料及样本收集①临床资料:包括血压、肝功能、肾功能、血常规指标、血沉(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody,CCP)。②RA患者及健康对照人群EDTA抗凝血样本经4 ℃,12 000g低温离心10 min后获得血浆样本;分装后置于-80 ℃冷冻保存待用。③RA患者及对照组的滑膜样本分别经多聚甲醛固定,石蜡包埋、OCT包埋等不同处理保存,以便进行后续实验。
1.3 实验动物与试剂体质量(165±15)g,雄性SD大鼠,购于邳州市东方养殖有限公司,许可证号:SCXK(苏)2017-0003。鸡Ⅱ型胶原(Chondrex公司,Cat:20011)、完全弗氏佐剂(Chondrex公司,Cat:7027)、Masson 三色染色液试剂(Solarbio 公司,Cat:G1345)、AT1R兔多克隆抗体(Abcam公司,Cat:ab124505)、CD4小鼠单克隆抗体(Santa Cruz公司,Cat:sc-20079)、FITC偶联山羊抗小鼠荧光二抗(武汉三鹰生物技术有限公司,Cat:SA00003-1)、CoraLite-594偶联驴抗兔荧光二抗(武汉三鹰生物技术有限公司,Cat:SA00013-8)、AngⅡELISA试剂盒(武汉华美生物工程有限公司,Cat:CSB-E04493h)。淋巴细胞分离液(深圳市达科为生物技术股份有限公司,Cat:DKW-KLSH-0100)、CD4-FITC和IL-17A-PE(BD公司Cat:550628 和Cat:560436)。细胞刺激混合物(赛默飞世尔科技有限公司 Cat:00-4970-93)。
1.4 CIA模型构建及分组将胶原粉末加入冰醋酸(0.01 mol·L-1)中,配成终浓度为4 g·L-1胶原溶液,置于冰箱4 ℃过夜至溶液澄清。并将其加入研钵中,冰上研磨乳化2 h,再将乳化后的液体与完全弗氏佐剂等体积混合后再次充分乳化。在大鼠右侧足底皮内注射0.1 mL。另吸取 0.1 mL 在大鼠尾根部多点皮内注射,时间记为d 0。1周后在尾根部皮内多点注射乳剂 0.1 mL,浓度剂量同上。基于人群数据,ARBs组有50%患者口服缬沙坦,因此体内实验选择ARBs类药物缬沙坦进行动物实验。将大鼠分成正常对照组,CIA 组和缬沙坦组(7.2 mg·kg-1·d-1)。大鼠造模后d 14开始给药,d 35处死大鼠,疗程持续21 d。
1.5 人群中AngⅡ的水平将ELISA试剂盒(武汉华美生物工程有限公司,货号:CSB-E04493h)置于室温进行复温。依次加入标准品或血浆37 ℃孵育2 h,继续加入生物素工作液37 ℃孵育1 h,洗板后,加入辣根过氧化物酶-亲和素工作液37 ℃孵育1 h。最后加入TMB底物工作液和终止液,在酶标仪中检测每孔的吸光度值,规定时间内完成整个检测过程。根据不同浓度的标准品,建立标准曲线。然后将不同样本吸光度值带入已知标准曲线中,计算血浆中AngⅡ水平。
1.6 HE染色大鼠关节及人滑膜石蜡切片置于烘箱中80 ℃烘烤4 h,样本玻片脱蜡至水后用苏木精染核3 min,立即置于自来水流水冲洗。镜下观察细胞核成蓝色。随后将玻片放于伊红染液中浸染3 min,用流水去除浮色后,甩干封片。
1.7 Masson染色采用Solarbio公司Masson三色染色试剂盒,依据说明书操作。大鼠关节及人滑膜切片脱蜡至水,切片上滴加Bouin染液,室温孵育过夜后流水冲洗净。滴加天青石蓝染色液,染色3 min后,流水洗涤。苏木素染细胞核3 min后置于自来水流水冲洗反蓝。丽春红染色10 min后,蒸馏水冲洗3次。随后磷钼酸溶液滴染10 min,弃去液体,直接滴加苯胺蓝染液染5 min。0.2%醋酸分化1 min,蒸馏水洗1次,无水酒精脱水,透明,封片。
1.8 IHC染色滑膜组织石蜡切片脱蜡至水,将滑膜组织玻片置于柠檬酸盐缓冲液中高压修复1 min 15 s,冷却至室温,蒸馏水冲洗2次。将3%过氧化氢滴加在组织上,阻断内源性过氧化物酶15 min。加T细胞标记抗原CD4一抗(1 ∶10),4 ℃湿盒孵育过夜。充分洗涤后滴加通用型二抗,37 ℃湿盒孵育30 min,PBS充分清洗后DAB显色,自来水冲洗干净后,苏木素染核,脱水,封片。
1.9 免疫荧光双重标记染色使用冰冻切片机将人滑膜样本切成4 μm,丙酮固定20 min。滴加含有1%牛血清蛋白的PBS溶液浸泡2 h。弃去PBS后滴加CD4单克隆抗体(1 ∶50)室温孵育3 h。用含有0.1%牛血清蛋白的PBS冲洗组织切片,去除未结合的一抗,清洗3次。用FITC偶联的荧光二抗(1 ∶200),室温避光孵育1 h。清洗后滴加AT1R一抗(1 ∶150),4 ℃过夜。在切片组织上滴加CoraLite-594偶联驴抗兔荧光二抗(稀释度1 ∶400),室温避光孵3 h;DAPI染核,滴加抗荧光淬灭剂后,盖玻片封片。
1.10 关节核磁共振检查使用3.0T核磁共振仪以SE T1-加权(TR/TE=674.84/20 ms)和FSET2-加权 (TR/TE=4771.53/90 ms)。以1.0 mm从冠状位和矢状位扫描,使用352×352重建矩阵,检测关节病理改变。
1.11 ARBs类药物对RA患者外周血Th17细胞的影响抗凝血通过淋巴细胞分离液分离淋巴细胞,将样本间细胞密度调成一致。加入细胞刺激剂刺激4 h后,加入细胞膜表面抗体-CD4-FITC 抗体,避光孵育40 min,清洗后,加入细胞固定破膜剂,避光孵育30 min,破膜液清洗3次,加入细胞内抗体-IL-17A-PE 抗体,避光孵育30 min,用破膜液清洗3次。离心PBS重悬,流式细胞仪检测。
1.12 Western blot取对照组和RA患者滑膜组织,组织匀浆提取组织蛋白,进行标准蛋白定量。加入5×loading buffer加热煮10 min后,采用质量分数为10%的SDS PAGE,电压80 V电泳2.5 h。随后电流200 mA,约2 h将SDS PAGE上的蛋白质转移至0.45 μm PVDF膜。用0.05%的脱脂奶粉室温封闭2 h,蒸馏水清洗PVDF膜后加入AT1R一抗(1 ∶2 000),4 ℃孵育过夜,次日用TPBS洗3次,每次10 min,二抗(1 ∶10 000),室温孵育2 h后继续用TPBS洗净加入ECL显影液显影。ImageJ软件分析目的条带灰度值。

2 结果
2.1 RA患者人口学特征和临床信息及服用ARBs类药物情况本研究共收集53名RA患者和32名的健康体检人群作为对照,并收集所有参与者人口学特征和临床信息;其中53名RA患者中有10名长期服用ARBs类药物(ARBs组)。服用ARBs类药物的类型为:缬沙坦(5人),厄贝沙坦氢氯噻嗪(2人),氯沙坦钾(2人)以及替米沙坦(1人)。RA患者中67.7%为女性;对照(Control)组人群有68.8%为女性;服用ARBs药物的RA患者中女性占70%。数据表明,RA在女性中高发。同时,各组别间收缩压、白细胞数、红细胞数、单核细胞数以及血红蛋白含量存在差异。RA组和ARBs组的收缩压、白细胞数、单核细胞数,均明显高于对照人群(P<0.05);而红细胞数和血红蛋白含量RA组和ARBs组要低于对照人群(P<0.05)(Fig 1,Tab 1)。
2.2 口服ARBs类药物对RA患者外周血AngⅡ和CCP的水平的影响与control组相比,RA患者血浆中AngⅡ的含量明显高于control组;与此同时,服用ARBs药物的RA患者血浆中AngⅡ的含量明显低于RA组,但高于control组。同时,服用ARBs药物的RA患者的CCP水平显著低于RA组(Fig 2)。上述结果提示,RA患者体内AngⅡ含量的高低可能与疾病严重程度有关。
2.3 AngⅡ水平与临床生化指标的相关性通过对血浆中AngⅡ水平与患者临床指标进行相关性分析发现,AngⅡ水平与WBC、AST、CRE、UREA、ESR、eGFR、RF以及CRP浓度无相关性(Tab 2)。与此同时,血浆中AngⅡ含量与RBC和HGB含量成负相关;与ALT含量、单核细胞数以及CCP的含量成正相关(Fig 3)。
2.4 RA患者滑膜组织病理学改变HE染色显示,对照组滑膜由2~3层细胞组成。与此同时,RA滑膜表现为滑膜细胞异常增殖并且伴随大量炎症细胞浸润以及血管翳形成(Fig 4A,arrow a-c)。Masson染色显示,RA患者滑膜组织有大量胶原纤维形成(Fig 4A,arrow d)。IHC结果显示,RA患者滑膜组织中存在大量CD4+T细胞浸润,提示CD4+T细胞可能在RA病情发生和发展中发挥作用(Fig 4A,arrow e)。Western blot检测发现,RA患者滑膜组织中AT1R的表达水平要明显高于对照组滑膜组织(Fig 4B)。通过免疫荧光双染法进一步表明,AT1R在CD4+T细胞中高表达,提示AT1R可能参与调控CD4+T细胞功能(Fig 4C)。
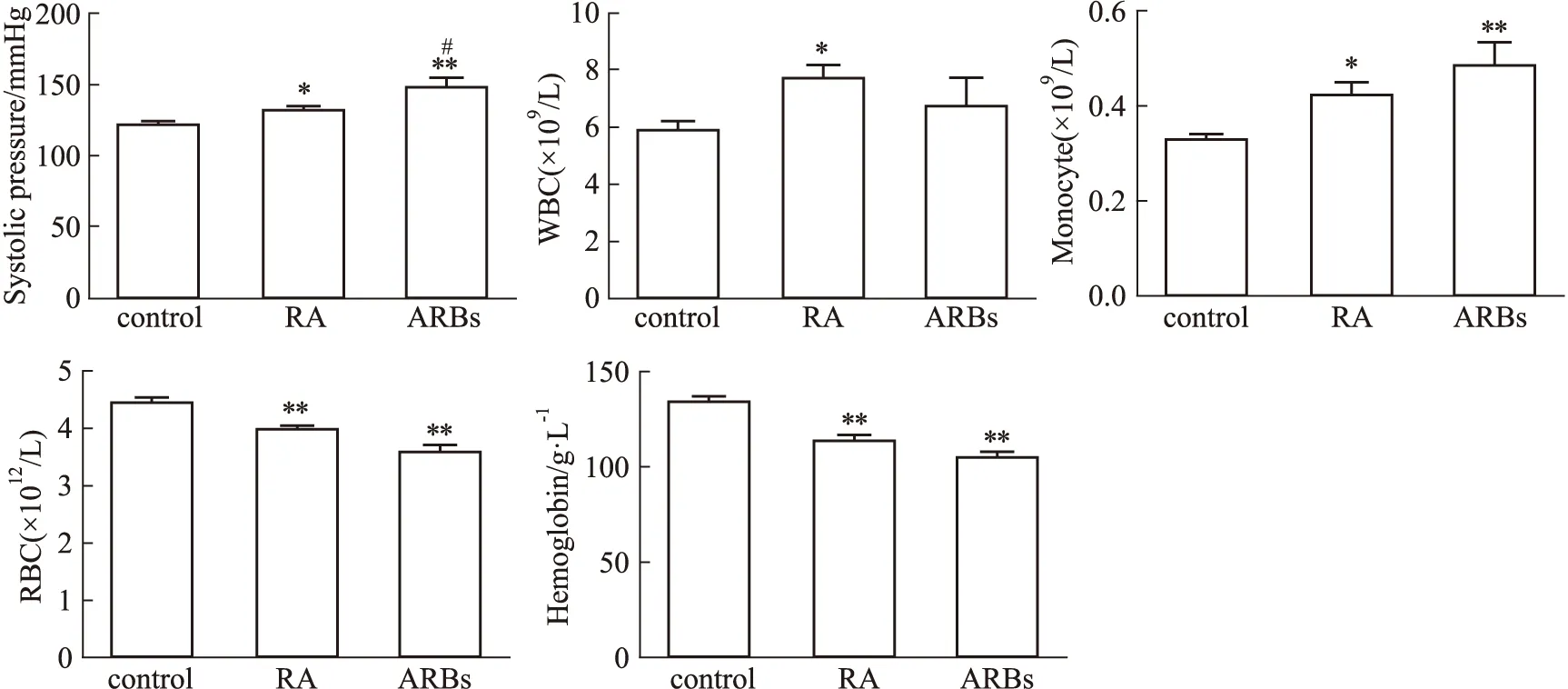
Fig 1 Difference in relative biochemical characteristics between control=32,RA=43,ARBs=10)

Tab 1 The relative biochemical characteristics in different groups

Fig 2 Level of AngⅡand CCP in different control=32,RA=43,ARBs=10)

Tab 2 Correlation analysis between plasma Ang Ⅱ and relative biochemical characteristics

Fig 3 Correlation analysis between plasma Ang Ⅱ and relative biochemical characteristics

Fig 4 The histopathological changes in RA patients′ synovial control=3,RA=8).
2.5 口服ARBs类药物对RA患者外周血CD4+T细胞及Th17细胞的影响在Fig 4中发现,在RA患者滑膜组织中CD4+T细胞浸润明显增加,且AT1R在CD4+T细胞中表达明显上调,推测AT1R可能参与调控T细胞功能。通过流式细胞术进一步检测发现,RA患者外周血CD4+T细胞数量明显升高。与RA患者相比,ARBs组患者CD4+T细胞数量没有影响(Fig 5A)。由于Th17 T细胞在炎症免疫反应中发挥重要促进作用,检测发现RA患者外周血中Th17细胞数量明显增多,而ARBs组患者Th17细胞数量明显下调(Fig 5B)。
2.6 缬沙坦对CIA的治疗作用给予ARBs类药物缬沙坦,以阐明缬沙坦对CIA模型的治疗作用。结果显示,与模型组相比,给予缬沙坦后能够显著降低足爪肿胀度,并且抑制CIA尾部结节的形成。MRI结果显示,模型组关节腔消失,滑膜组织异常增生,与此同时给予缬沙坦能够抑制滑膜组织异常增生并且对关节腔结构具有一定保护作用。HE结果显示,CIA滑膜组织重度增生,血管翳形成以及炎症细胞大量浸润由此导致严重的骨质和软骨的侵蚀,髌骨下脂肪垫消失。给予缬沙坦对CIA关节病理具有一定改善作用,能够抑制炎症细胞浸润,滑膜组织异常增生以及对于软骨、骨质以及髌骨下脂肪垫具有保护作用(Fig 6)。
3 讨论
长期的炎症环境和免疫系统异常活化使RA患者罹患的高血压等心血管疾病(cardiovascular diseases,CVD)风险显著升高。研究表明,CVD是导致RA患者死亡主要原因之一,人均寿命缩短5-10年,RA已被列为CVD一项独立的危险因素[7]。日前,RA主要治疗药物有非甾体抗炎药、糖皮质激素、改善病情的抗风湿药(disease-modifying anti-rheumatic drugs,DMARDs)和生物制剂等[8]。NSAIDs具有抗炎、镇痛、解热的药理作用,但该类药物只能延缓疾病进程。此外NSAIDs能通过多种非前列腺素依赖性调节机制上调患者血压[9]。鉴于多数的NSAIDs具有潜在提高CVD风险的可能性,FDA已要求药品生产厂家在其说明书中对此加入黑框警告。糖皮质激素是治疗多种自身免疫性疾病的一线用药,发挥强而快速的抗炎作用。长期应用糖皮质激素可导致水钠潴留和血酯升高继而引起高血压和动脉粥样硬化等CVD[10]。DMARDs药物来氟米特、肿瘤坏死因子受体融合蛋白以及利妥昔单抗等生物制剂具有快速强大的免疫抑制作用。但是上述药物说明书均注明高血压和充血性心力衰竭等CVD是其主要不良反应之一。综上所述,RA主要治疗药物不仅对RA继发的CVD无防治作用,甚至有些药物能够提高RA患者罹患CVD的风险。因此探寻RA病理机制,找寻兼具降低CVD风险的RA治疗药物靶点具有重要意义。ARBs作为一线的抗高血压药物能够降低血压、降低心肌交感神经活动、降低左心室射血分数从而明显降低人群不良心血管事件的发生率[11]。同时加拿大以及欧洲高血压治疗与管理指南均指出ARBs无论对单纯的收缩压升高还是收缩压和舒张压同时升高的高血压均具有治疗作用。同时ARBs对高血压患者所合并的心肌梗死、左室肥大、动脉粥样硬化、心力衰竭等不良心血管事件以及代谢性疾病如2型糖尿病均具有治疗作用。有证据表明,ARBs在控制血压的同时还可下调患者血沉的基线水平[12]。提示拮抗AT1R对RA患者体内炎症免疫反应可能具有抑制作用。此次研究发现,RA患者血浆中AngⅡ的含量明显高于对照组,服用ARBs类药物的RA患者血浆中AngⅡ的含量明显低于RA组。与此同时,服用ARBs药物的RA患者的CCP水平显著低于RA组。抗CCP抗体是一种抗角蛋白抗体,其靶抗原是环状聚丝蛋白的多肽片段。抗CCP抗体作为一种血清学指标,在RA诊断过程中特异度较高,并且在一定程度上对RA的骨质侵蚀具有预测作用。2010年,美国风湿病学会和欧洲抗风湿病联盟将抗CCP抗体滴度被纳入《2010类风湿关节炎分类标准》[13]。研究结果发现,血浆中AngⅡ的含量与患者抗CCP抗体成显著正相关结果提示,通过降低AngⅡ的含量可能对RA疾病病程具有延缓作用。由此推测,ARBs类药物通过阻断AngⅡ与AT1R的结合对RA可能具有潜在治疗作用。

Fig 5 Effect of ARBs on CD4+ T cell and Th17 cells in different
T细胞是细胞免疫中重要的组成部分,T细胞主要有两个亚型分别是:CD8阳性的细胞毒性T细胞和CD4阳性的辅助T细胞。CD8+T细胞仅识别组织相容性复合物Ⅰ所呈递的抗原,直接与破坏感染的肿瘤细胞和病毒相接触,对细胞进行杀伤。CD4+T细胞识别组织相容性复合物Ⅱ所呈递的抗原,通过释放多种细胞因子杀死细胞内病毒、微生物等异物,由于CD4+T细胞通过分泌多种细胞因子发挥作用,因此其在机体中与多种细胞发挥相互作用,调控作用更为广泛。
CD4+T细胞通过分泌如TNF-α、INF-γ、IL-17、IL-10等多种细胞因子,调控关节滑膜中单核细胞活化、巨噬细胞极化和成纤维样滑膜细胞增殖等一系列生理功能[14]。日前研究表明,RA患者慢性滑膜炎症主要以CD4+T细胞大量浸润为主,CD4+T细胞作为效应T细胞的重要组成部分,参与免疫应答过程的各个阶段,其介导的异常亢进的炎症免疫反应被认为是RA主要发病机制之一。CD4+T细胞在RA中可分化成多种的T细胞亚群,通过分泌不同的细胞因子进而发挥不同功能。其中Th17细胞是于2005年发现的CD4+T细胞的一个新亚群Th17细胞能分泌效应细胞因子IL-17,在防御宿主胞外细菌和真菌感染的炎症反应中发挥作用。
在RA 病人异常亢进的免疫环境下,IL-17在血清及关节液中的表达水平明显升高,上调破骨细胞活性参与了关节软骨和骨质破坏的进程[15]。异常活化的Th17细胞能够促进关节滑膜中炎症细胞浸润,刺激成纤维样滑膜细胞异常增殖、巨噬细胞M1性极化,同时Th17细胞还可以刺激上述细胞大量分泌IL-1β、IL-6和TNF-α等多种细胞因子从而上调机体炎症水平加重炎症免疫反应。与此同时这些异常上调的炎症细胞因子可进一步促进Th17细胞分化以及成纤维样滑膜细胞增殖。由此形成正反馈环路促进血管翳形成和关节软骨破坏,加重关节损伤[16]。本次研究发现,RA患者滑膜组织以及外周血中的CD4+阳性T细胞数量显著上升,提示CD4+T细胞可能参与RA的疾病进程。服用ARBs药物的RA患者与普通RA患者相比外周血中CD4+T细胞数量未发现显著差异,表明ARBs类药物的抗风湿作用可能并不是通过抑制CD4+T细胞分化发挥作用。虽然服用ARBs药物的RA患者CD4+T细胞数量未发生变化,但是其Th17亚型与普通RA患者相比显著下调。上述结果提示,抑制Th17细胞分化可能是ARBs类药物发挥抗炎抗风湿作用的潜在机制之一。
课题组前期研究表明,在RA动物模型血清中AngⅡ含量以及滑膜组织中AT1R表达均显著上调。ARBs类药物氯沙坦能够下调动物模型血浆中AngⅡ含量和AT1R表达、抑制滑膜增生和骨质囊状破坏,对RA动物模型具有治疗作用;其机制可能与下调MAPK-NF-κB通路活性有关[17]。同时,异常活化的RAS介导了佐剂性关节炎(adjuvant-induced arthritis,AIA)大鼠血管内皮细胞功能障碍并上调其氧化应激水平。拮抗AT1R可降低AIA大鼠主动脉中超氧化物水平及NADPH氧化酶的活性,改善AIA大鼠血管内皮细胞功能;在缓解关节炎症的同时对心血管系统具有保护作用[18]。此次研究选择一种临床常用的ARBs类药物缬沙坦作为实验药物,结果发现缬沙坦对CIA大鼠模型同样具有治疗作用,能够延缓RA动物模型关节病理进程。
本次研究揭示,RA患者体内AngⅡ的含量可能与患者病情严重程度成正相关;由此认为给予ARBs药物通过拮抗AngⅡ与其受体结合对RA具有潜在治疗作用。本次研究及前期研究分别证实,缬沙坦和氯沙坦作为目前主要的ARBs类降压药对RA动物模型具有治疗作用。因此,ARBs类药物用于RA伴高血压患者既能发挥降压作用控制RA患者异常升高的血压,又能延缓RA病情进展。本研究为ARBs类药物成为RA伴高血压患者首选的降压药提供理论和依据。
