利用深度学习实现CT图像上肾脏肿瘤径线自动测量的临床可行性
2022-03-21孙兆男刘佳崔应谱刘想张晓东王霄英林志勇张耀峰
孙兆男,刘佳,崔应谱,刘想,张晓东,王霄英,林志勇,张耀峰
近年来,因常规体检及腹部不适就诊的患者在行影像学检查时,肾脏肿瘤的检出率明显增加[1]。肾部分切除术(partial nephrectomy,PN)及根治性肾切除术(radical nephrectomy,RN)是局限性肾肿瘤临床干预的主要方案。因此与临床决策相关的可切除性评估、术式选择及围手术期结局预测需要综合肿瘤形态、位置、解剖关系等多种因素进行评估。长期以来,多种评分系统被相继提出。在R.E.N.A.L评分[2]、PADUA评分[3]、CI评分[4]及DAP评分[5]评分系统中,均将肾肿瘤直径或半径作为是否可行PN的重要评分变量,直径或半径测量值越大,评分越高,肿瘤切除相关的复杂性也就越高。2014年发布的EAU指南[6]推荐,对于cT1a期和部分cT1b期肿瘤患者,可首选行PN,对于较大的及较复杂的中心性生长的肾肿瘤,则多采取RN。
泌尿系多期增强CT在显示肾肿瘤及周围解剖结构有一定优势,是诊断、分期、评分的首选影像学检查[7]。目前临床实践中,肾脏肿瘤径线测量值可通过CT图像直接获得。影像医生对肿瘤测量时先逐层阅图寻找肿瘤最大层面,再通过多方向重组测量肿瘤的三维径线,虽然是简单的测量工作,仍需要投入一定的时间。且对于形态欠规则的肿瘤,医生难以准确寻找最大层面的位置,由于选取测量层面的不同、测量误差等导致医生之间乃至同一医生不同次测量间的一致性差。因此,亟需一种全自动的、准确性高及重复性高的肿瘤径线测量方法,以减轻影像医生测量肿瘤径线的时间成本,提高书写报告的效率。
计算机辅助诊断(computer-aided diagnosis,CAD)已被广泛用于肿瘤的影像学评估。其中以U-Net[8]为代表的卷积神经网络在医学图像分割任务中表现良好。目前,多项研究证实利用深度学习在CT图像上实现肾脏肿瘤分割结果较为准确[9-10]。本单位早期研究中,利用441名肾脏肿瘤患者的皮髓质期CT图像,基于两个级联的3DU-Net模型,实现肾脏区域的定位任务和肾脏肿瘤的精细分割任务,已完成肾脏肿瘤分割模型的训练,在测试集中,分割肾脏、肾肿瘤、肾囊肿的平均Dice系数分别为0.973、0.844、0.536[11],整体分割的准确性较好,并可实现肾脏肿瘤短径、中径、长径及肿瘤体积的自动测量。
本研究旨在验证肾脏肿瘤分割模型对肾肿瘤径线自动测量的准确性,探索测量结果自动植入报告的临床可行性。
材料与方法
1.数据收集
此研究属于回顾性研究,获得本院伦理审查委员会同意[伦理批件号2019(169)]。从本院影像科信息系统及病案系统中回顾性收集2019年5月1日-2019年11月29日经手术病理证实的肾肿瘤患者的影像图像及结构式报告进行分析。纳入标准为:影像报告诊断为肾肿瘤的全部数据。排除标准为:a)未在影像检查后1月内于本院行肾根治性切除术、部分切除术,无本院病理数据(n=116);b)病例资料不完整(n=10);c)CT图像无皮髓质期薄层图像(n=2);d)结构式报告信息不完整(n=15);e)扫描范围未包括全部肾脏,图像有伪影(n=1);f)既往肾脏相关手术史(n=4)。最终纳入154例肾肿瘤患者的影像图像及结构式报告进行分析,男94例,女60例,年龄16~86岁,平均55±13岁。
2.CT扫描方案
皮髓质期薄层图像来源于本科四台CT:GE Light Speed VCT、GE Discovery CT 750 HD、Philips ICT 256和Siemens Somatom Definition Flash CT。扫描方向为头足位,扫描范围从肾上腺到肾下级,管电压120 kV,管电流自动毫安秒,螺距0.600~0.984,扫描层厚5 mm,矩阵512×512,重建层厚1 mm,层间距1 mm,对比机采用非离子型碘对比剂(320 mg I/mL),剂量为每公斤体重0.5 g碘或90 mL碘佛醇加20 mL生理盐水冲管,注射流率3.0 mL/s。使用自动触发扫描方式时,触发点设置在胸12椎体水平腹主动脉处,触发阈值设置为100 HU。在达到触发阈值后延迟12 s开始扫描皮髓质期。如果使用固定时间延迟扫描模式,则在注射对比剂后25~40 s进行皮髓质期扫描。
3.获取肾脏肿瘤三维径线
①模型测量值:我科现已完成基于U-Net在皮髓质期CT图像上的肾脏肿瘤分割模型[10]。利用该模型自动分割本研究纳入的全部数据(图1a),并进一步利用最小体积包围盒算法(图1b),使模型自动输出肾脏肿瘤的三维经线,即长径、中径及短径(图1c)。
②医生测量值:医生测量值来源于本单位肾脏肿瘤结构式报告。测量方法参考图1d、e。结构式报告中肾肿瘤的三维径线为临床常用的左右径、前后径、上下径,进一步三组数据进行大小排序,转换为相对应的短径、中径、长径,此径线作为本研究的医生测量值。
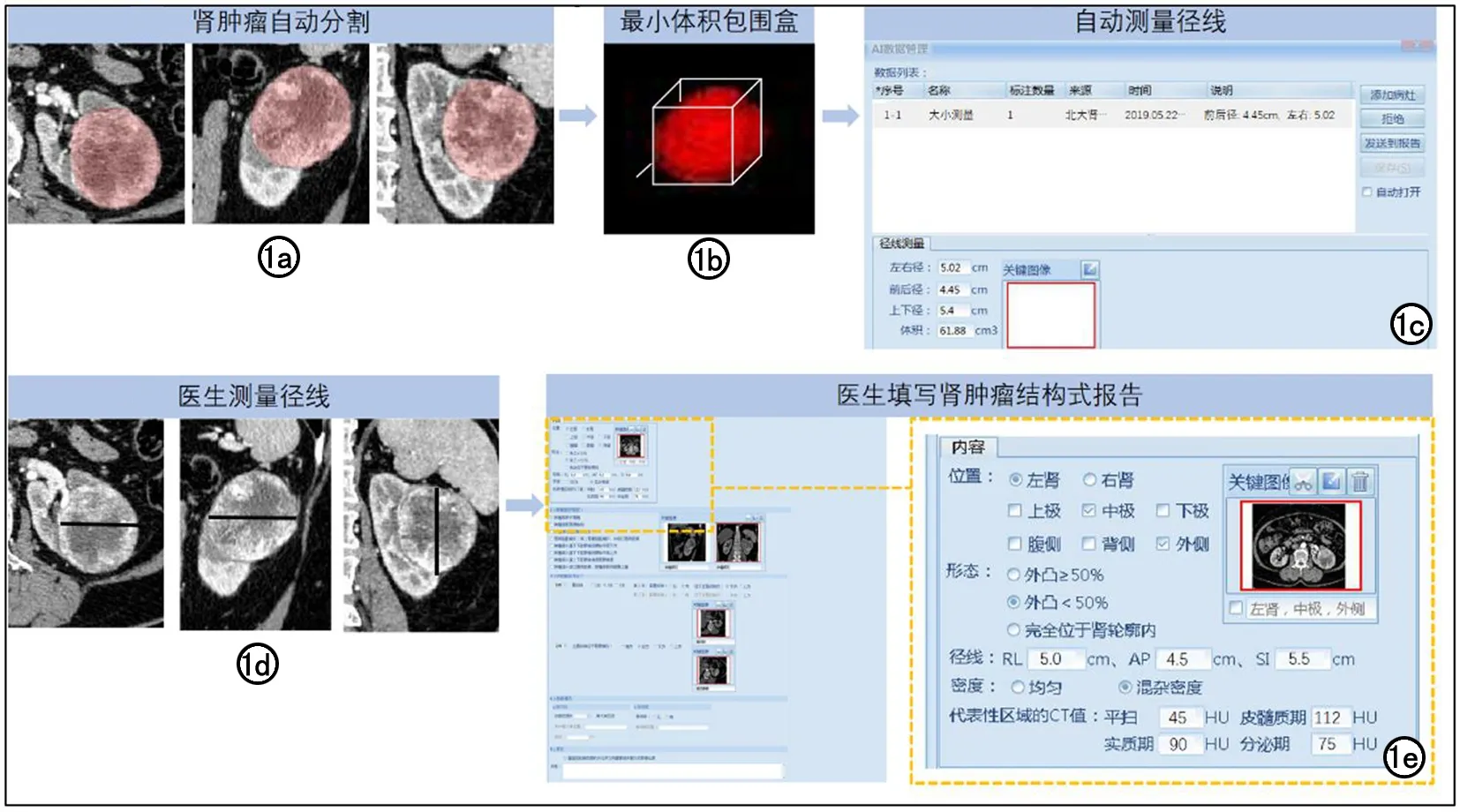
图1 肾肿瘤径线的测量方法示例。a~c为自动分割及测量,d~e为医生测量。a)U-Net模型在皮髓质期CT图像上分割得到的肾肿瘤区域;b)最小体积包围盒算法得到肾肿瘤的长径、中径、短径;c)测量结果自动填写到结构式报告;d)医生测量肾肿瘤左右径、前后径、上下径;e)医生填写至结构式报告。
③参考值:两位影像医生对本研究纳入的全部数据进行肾肿瘤标注,标注方法与既往研究相同[11],标注效果可参考图1a。采用最小体积包围盒算法,计算此肾脏肿瘤标签的三维径线,即长径、中径及短径,作为本研究肾脏肿瘤三维径线的参考值。
4.模型自动分割及径线测量的评价
①分割性能评价:Dice相似性系数(Dice similarity coefficient,DSC)[12]是用于评价两个数据集相似性的参数,目前最常用于分割图像的相似性评估,计算公式见公式(1)。X代表模型自动分割肾脏肿瘤区域的体素数量,Y代表医生标注的肾脏肿瘤区域的体素数量,X∩Y是以上二者间重叠部分的体素数量,DSC的取值区间为0~1,越接近1代表两个数据集的相似度越好。本研究计算了模型自动分割的肾脏肿瘤区域与影像医生标注的肾脏肿瘤区域的DSC,用于客观评价肾脏肿瘤分割模型的分割性能。
(1)
②肾肿瘤径线测量值的评价:对参考值、医生测量值、模型测量值三组数据进行统计学分析,以探讨模型自动测量替代医生手工测量的临床可行性。
5.统计方法
统计软件为Medcalc 15.8和SPSS 22.0。采用Kolmogorov-Smirnov (K-S)检验所有参数的正态性。符合正态分布的计量资料采用平均值±标准差表示,不符合正态分布的计量资料采用中位数(四分位间距)表示。采用非参数检验的Wilcoxon检验比较不同测量方法所得径线值,P<0.05代表差异具有统计学意义。采用Bland-Altman散点图进行医生测量参考值、模型测量值两组数据的一致性评价,置信区间设置为95%。
结 果
1.患者资料
本研究入组的154例肾脏肿瘤患者的详细临床资料见表1。肿瘤完全位于肿瘤内部17例,外凸<50%为52例,外凸≥50%为85例;肿瘤密度均匀41例,密度混杂113例;病理分型为透明细胞型肾细胞癌88例,乳头状肾细胞癌16例,嫌色细胞型肾细胞癌23例,肾嗜酸细胞腺瘤11例,乏脂肪型肾血管平滑肌脂肪瘤14例,其他少见病理类型的肾细胞癌2例;病理T分期为T1期99例,T2期6例,T3期26例,肾脏良性肿瘤23例。
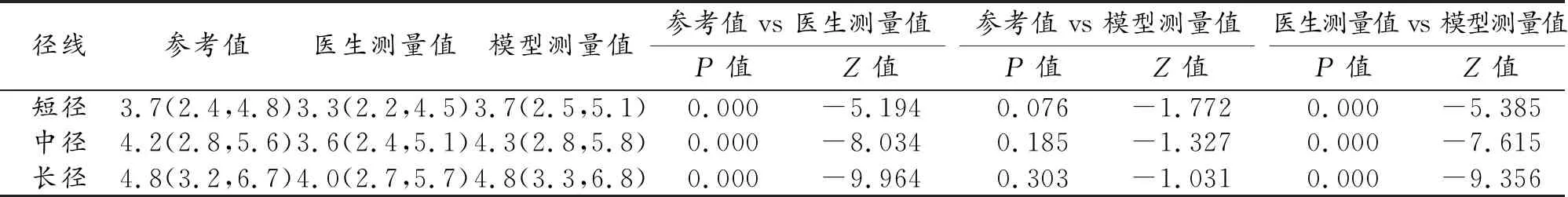
表1 三种测量方法所测肾肿瘤径线 (cm)
2.肾肿瘤分割结果
154个肾脏肿瘤病灶中,以肿瘤为单位的平均DSC值为0.91,DSC的分布盒型图见图2,有133(86%)个肿瘤分割DSC值在0.8以上,仅8(5%)个肿瘤分割DSC低于0.5。进一步按照肿瘤密度的均质性进行分类,分为密度混杂(113/154)、密度均匀(41/154)两组,图2b展示了两组肾肿瘤分割DSC值的分布盒形图,可见密度混杂组的分割效果优于密度均匀组。按照肾肿瘤相对于肾脏的外凸程度,将肿瘤分为三组,即外凸度≥50%(85/154)、<50%(52/154)及完全位于肾肿瘤内部(17/154),可见肾肿瘤外凸程度越高,分割的准确性越好。图3列举了本研究肾肿瘤分割结果。
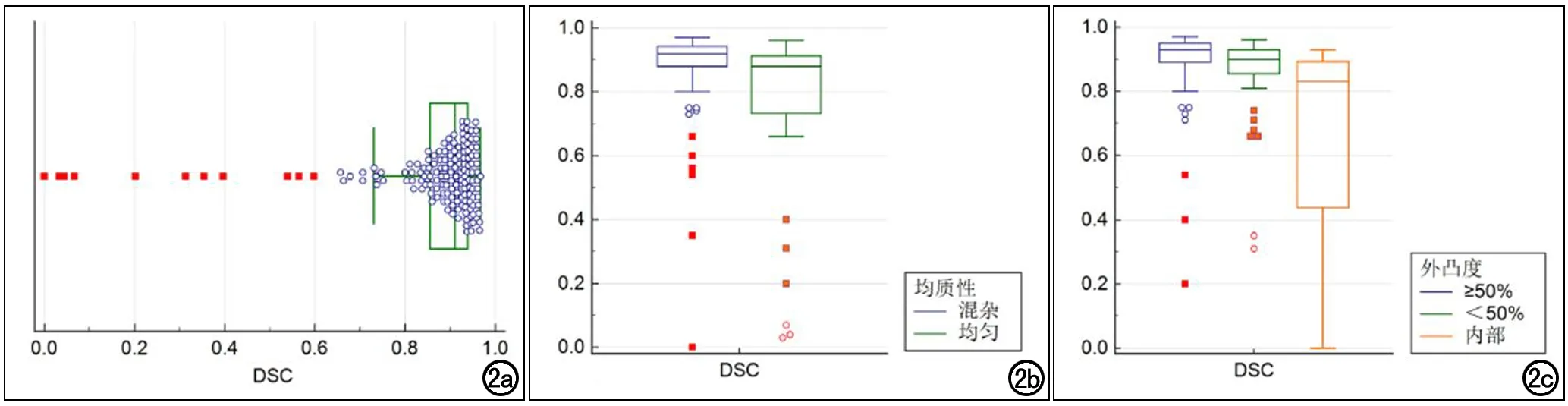
图2 肾肿瘤分割DSC值的分布盒形图。a)本研究所有肾肿瘤分割DSC值的分布盒形图;b)按肿瘤均质性分类,不同类别肾肿瘤分割DSC值的分布盒形图比较;c)按肿瘤外凸程度,不同类别肾肿瘤分割DSC值的盒形图比较。框表示中位数周围的四分位范围,延长线的长度为四分位间距的1.5倍。
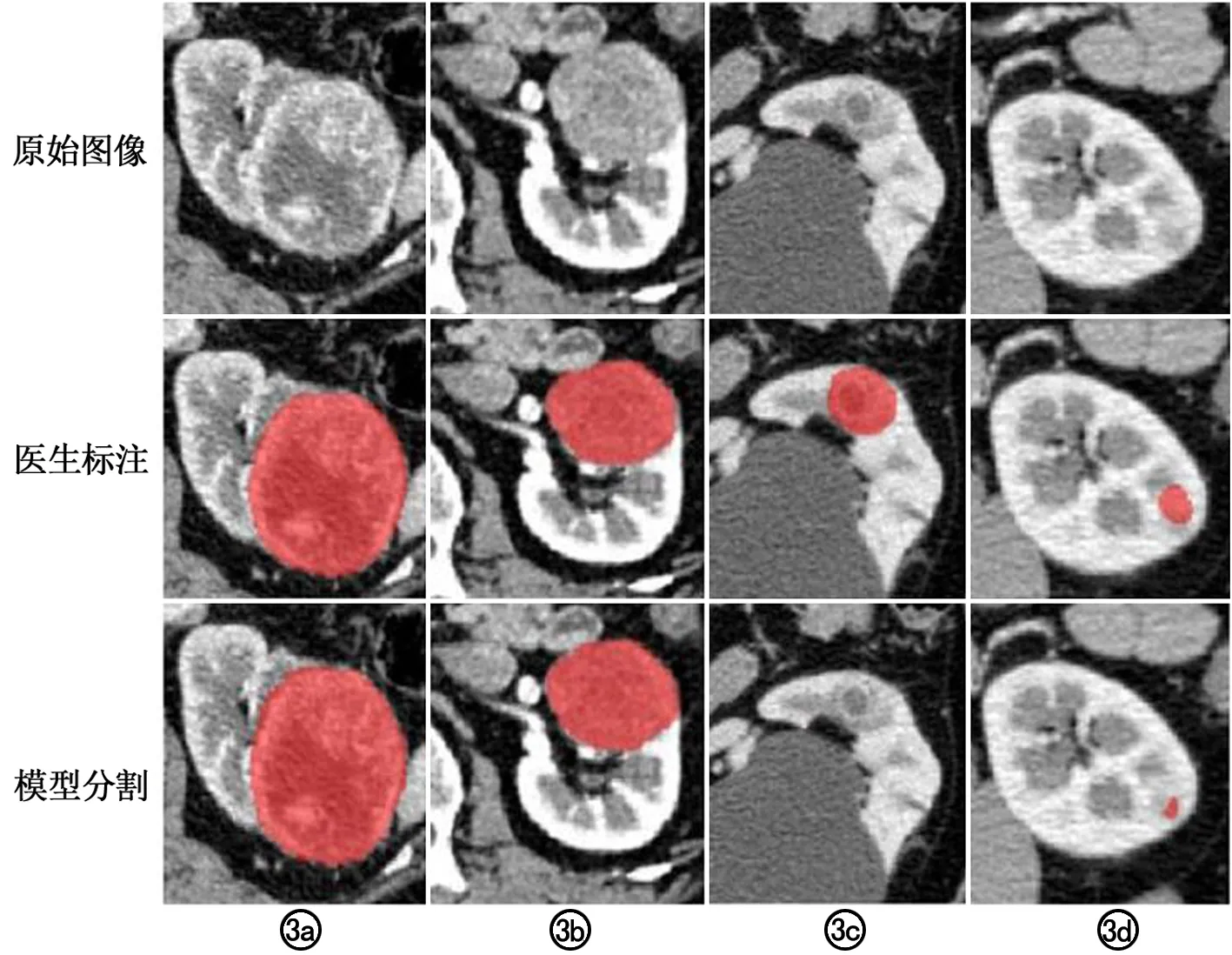
图3 CT皮髓质期周围图像上肾肿瘤的自动分割结果。a、b为分割效果好的病例。c、d为分割效果差的病例。a)肾肿瘤最大径为6.4cm,密度混杂,外凸度>50%,DSC值为0.97;b)肾肿瘤最大径为4.1cm,密度均匀,完全位于肾实质内,DSC值为0.96;c)肾肿瘤最大径为1.7cm,密度混杂,完全位于肾轮廓内,DSC值为0,模型未分割出肾肿瘤;d)肾肿瘤最大径为1.4cm,密度均匀,完全位于肾轮廓内,DSC值为0.04。
3.参考值、医生测量值、模型测量值分析结果
将三种测量方法进行两两比较,得到的肾肿瘤径线分析结果见表1。模型测量值与参考值相比,肾肿瘤短径、中径、长径之间的差异无统计学意义(P>0.05)。肿瘤各径线的医生测量值均小于参考值,差异均具有统计学意义(P<0.05)。肿瘤各径线的模型测量值大于医生测量值,差异均具有统计学意义(P<0.05)。
4.医生测量值与模型测量值的一致性分析
本单位训练肾肿瘤径线测量模型的最终目的是替代医生测量,因此进一步采用Bland-Altman散点图分析医生测量值与模型测量值的一致性。Bland-Altman分析结果显示(图4)两种测量方法所得肾肿瘤的中径、长径的一致性较好,分别有4.5%(7/154)、3.2%(5/154)的数据位于95%置信区间之外,其中长径的一致性最高。对于短径,两种测量方法的一致性欠佳,有5.8%(9/154)的数据位于95%置信区间之外。模型测量值和医生测量值相比,肾肿瘤短径差值为-1.02~1.47 cm,平均0.22 cm,肾肿瘤中径差值为-1.2~2.2 cm,平均0.5 cm,肾肿瘤长径差值为-1.1~2.7 cm,平均0.8 cm。

图4 模型测量值和医生测量值的肾肿瘤短径、中径、长径结果的Bland-Altman散点图。蓝色实线代表两种测量结果差值的平均数,极上、极下两条红色虚线代表95%置信区间的上下限。a)肾肿瘤短径平均值与差异值;b)肾肿瘤中径平均值与差异值;c)肾肿瘤长径平均值与差异值。
讨 论
肾肿瘤的大小对于术式选择及患者预后有重要意义,尤其是肿瘤最大径,是决定是否可行PN的主要参数之一,也是肾肿瘤分期的主要标准,因此对于肿瘤大小的测量是影像报告的重要价值体现,也是影像科医生的常规任务。本研究探索了U-Net肾肿瘤分割模型对于肿瘤三维径线测量的准确性,旨在为肾肿瘤大小测量提供准确、高效的衡量工具。研究结果证实,模型整体分割结果很好,且密度越不均匀、位置越外凸,分割的准确性越好。在分割结果很好的前提下,模型测量结果与参考值接近。其中,对于临床最关注的肿瘤最大径,即本研究的长径,模型测量值比医生测量值更接近于此研究定义的参考值,说明模型测量的径线值有很高的准确性,更接近肿瘤大小的真实值。在模型测量值与医生测量的一致性研究中,虽然模型测量值较医生测量值偏大,但二者的总体一致性很好,加之测量结果更接近于真实值,进一步说明模型自动测量有望替代医生手工测量,这也是目前人工智能(artificial intelligence,AI)辅助诊断软件投入临床实践的主要切入点之一。
本单位训练的肾肿瘤分割模型[11]是本研究的基石,采用的是经典的U-Net分割网络,模型训练过程及肾肿瘤检出率的分析已报道,此文不再赘述,主要集中于肾肿瘤径线测量的分析。最小体积包围盒算法(minimum volume bounding box algorithm)可以得到包含目标图像所有像素点的一个最小的范围,并可计算出径线、面积、体积等几何参数。本研究纳入分析肿瘤径线为长径、中径、短径,实际上还可以自动获取肿瘤体积,这是目前临床工作中医生难以轻松实现的。另外,本研究的一个创新点是将径线测量值对接到AI临床落地平台——结构式报告中[14-15],医生可参考分割结果决定是否接受径线值,可实现临床交互功能,优化影像报告流程[16],具体临床植入流程见图5。
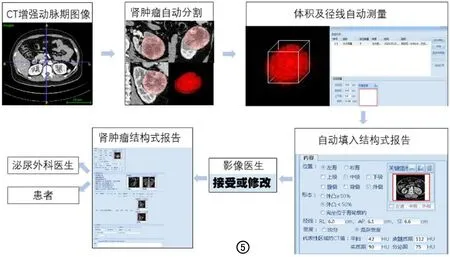
图5 肾肿瘤分割模型临床植入流程图。
本研究存在不足之处,此项研究的医生测量值是回顾性收集的本单位结构式报告中储存的左右径、前后径、上下径,经过大小排序后转换为长径、中径、短径,虽然不是完全对应的,但基于上述最小体积包围盒的原理以肿瘤大多为球形的形态特点,认为二者是存在可比性的,目前在很多其他肿瘤分割及测量的研究[17-22]中得到证实。其次,本研究样本量较少,仅属于方法可行性的探索研究,仍需多中心、大样本研究验证结果的可靠性。肾脏肿瘤病理类型多样[13],但临床可按密度分为囊性肾肿瘤和实性肾肿瘤,在囊性肾肿瘤中,发病率最高的是单纯性肾囊肿,属于肯定的良性病变,因此本单位研发肾肿瘤分割模型时,单纯性肾囊肿和其他有恶性潜能的肾肿瘤作为两个标签输入模型,模型的输出结果也是两种,考虑到临床意义,本研究仅关注有恶性倾向的肾肿瘤,未分析单纯性肾囊肿。另外由于本研究纳入的病例是于本院行CT检查诊断且行手术治疗的肾肿瘤,使得研究缺少Bosniak Ⅱ类、Bosniak ⅡF类乃至部分Bosniak Ⅲ类[23]的肾囊肿,数据存在一定偏倚,由于此类肿瘤本身是倾向良性或性质待定建议随访的,因此出于临床意义考虑,认为偏倚尚可接受。最后,本研究为回顾性收集的数据,缺少手术切除后肾肿瘤长径、中径、短径测量值的金标准,既往研究证实CT图像上肾脏体积测量值容易获得且接近体内真实值[24],关于径线测量值与金标准的对比,未来可通过前瞻性研究进一步证实。
总之,基于U-Net的自动分割模型对肾脏肿瘤径线测量结果是可靠的,且可通过肾肿瘤结构式报告这一信息化载体,植入真实临床工作场景中,优化影像工作流程。
