基于乳腺X线摄影的影像组学对乳腺肿块和钙化良恶性分类的研究
2022-03-21马明明崔应谱刘想杨洁瑾张耀峰李昌欣张晓东秦乃姗王霄英
马明明,崔应谱,刘想,杨洁瑾,张耀峰,李昌欣,张晓东,秦乃姗,王霄英
乳腺X线摄影是乳腺疾病初检筛查的首要方法,已被广泛应用于乳腺病变的良恶性鉴别[1]。乳腺癌在X线摄影中常见表现为肿块、钙化[2],鉴别肿块和钙化的良恶性是重要的影像学任务,与诊断者的经验相关。通常根据病灶特征给出乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分类,对BI-RADS 4、5类乳腺病变进行活检[3]。由于部分病灶的影像特征不典型,可能造成诊断困难以及诊断者的不一致。因此,需要更客观、准确的方法鉴别乳腺病变的性质。
影像组学(Radiomics)技术可用于乳腺图像的辅助诊断[4]。有研究探讨了利用影像组学特征在乳腺MR对乳腺癌分子亚型区分[5]和乳腺X线摄影图像上乳腺钙化良恶性病变鉴别的应用[6]。近年来深度学习在医学图像分割方面得到了广泛应用,尤其是病变自动分割不仅减轻医师工作强度、还能提高病变检出的一致性[7],本单位已训练了基于深度学习分割乳腺X线摄影图像中钙化和肿块的模型,对病变检出的效果较好,为进一步探索对乳腺肿块和钙化进行良恶性分类奠定了基础。本研究探讨基于乳腺X线摄影的影像组学在乳腺肿块和钙化良恶性鉴别中的应用价值,并将结果与有经验的放射科医生进行对比。
材料与方法
本研究经过伦理审查委员会的批准[批件号2019(168)],研究工作按照本单位影像组学项目研发规范来进行。
1.研究对象
回顾性收集本院PACS系统中2014年5月1日-2020年3月1日诊断性乳腺X线摄影检查(临床查体或超声检查有乳腺异常)的影像资料,从图像中提取乳腺肿块和钙化的影像组学特征用于鉴别良恶性病变。所有乳腺X线摄影检查均由Hologic Selenia数字化全视野乳腺X线机采集,采用标准内外斜位(medial lateral oblique,MLO)和头尾位(cranio caudal,CC)投照,选择自动曝光控制模式。以患者最终病理结果及临床随访结果(良性检查结果的患者)为金标准。
乳腺良恶性肿块影像组学模型的纳入标准:①由两名放射科医师(读者A和读者B,分别拥有5年、15年以上乳腺X线摄影诊断经验)明确图像中有乳腺肿块、且范围明确;②乳腺恶性肿块有已知病理结果,良性肿块有病理结果证实或随访一年期间未发现恶性结果。排除标准:①多发性肿块性病灶(难以确定病理穿刺病灶者);②失访患者。共纳入患者188例,均为女性,年龄29~91岁(58.9±12.1岁)。最终得到X线图像316幅(图1),将乳腺肿块数据集按7:3的比例随机分成训练集和测试集。
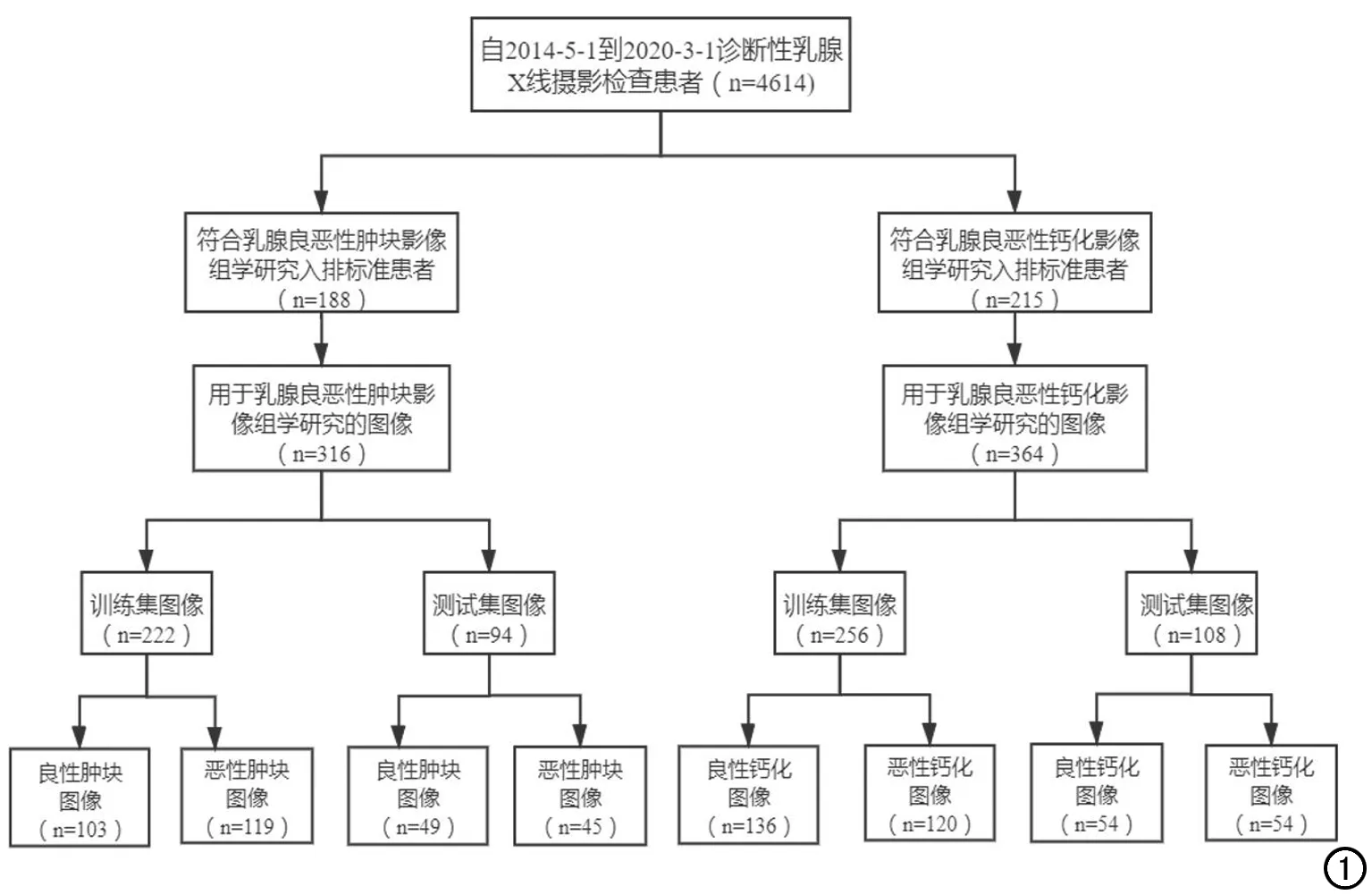
图1 乳腺肿块、钙化影像组学研究对象纳入流程图。
对于乳腺良恶性钙化影像组学模型的纳入标准:①由两名放射科医师(读者A和读者B)明确图像中有乳腺钙化、且显示清晰;②乳腺恶性钙化有已知病理结果,良性钙化有病理结果证实或随访一年期间未发现恶性结果。对于同时存在乳腺良恶性钙化、或多发不确定钙化的情况,基于病理证实结果,通常仅取乳腺钙化为恶性的区域入组。当同一图像上同时存在良性钙化或不确定钙化时,这些区域如未能获得病理证实,则不入组,如果获得了病理证实,则可以入组。排除标准:①乳腺钙化小于4个像素;②失访患者。共纳入患者215例,均为女性,年龄31~86岁(57.8±12.9岁)。最终得到X线图像364幅(图1),将乳腺钙化数据集按7:3的比例随机分成训练集和测试集。
2.乳腺病变分割
采用Ronneberger等提出 U-Net算法进行病灶分割[8],使用本院已经训练好的乳腺X线摄影中肿块和钙化的分割模型,输入乳腺X线摄影图像,输出肿块和钙化的分割结果。由两名放射科医师(读者A和读者B)对分割模型输出的分割结果进行评估及修改。乳腺肿块分割模型预测结果合格标准如下:①模型输出的肿块区域为穿刺病理结果证实的肿块,或随访一年以上的良性肿块;②模型输出的肿块边缘与腺体分界清晰且与人工判断的边缘一致。乳腺钙化分割模型预测结果合格标准:①模型输出的钙化区域为穿刺病理结果证实恶性或良性区域,或随访一年以上的良性钙化;②模型输出的钙化区域为每一个钙化点。
3.影像组学分析
影像组学模型构建和测试的所有过程在Python (v 3.6.0)的FeAture Explorer Pro (FAEPro,v.0.3.4)[9]开源平台上进行。建立影像组学模型主要步骤包括:①特征提取;②特征降维;③特征选择;④模型训练。基于分割模型预测结果作为图像分析兴趣区(region of interest,ROI),使用Python的PyRadiomics package[10]提取肿块和钙化的组学特征,训练了乳腺X线摄影肿块和钙化的影像组学模型。
4.模型效能判断
采用受试者操作特征(receiver operating characteristic,ROC)曲线并及计算ROC曲线下面积(area under curve,AUC)以定量评估影像组学模型对乳腺肿块和钙化良恶性二分类的鉴别效能。以影像组学模型鉴别乳腺病变良恶性的最佳截断值(cutoff value)来计算符合率(accuracy,ACC),敏感度(sensitivity,SEN)和特异度(specificity,SPE)。
5.放射科医师诊断效能
由一位高年资(7年以上乳腺X线摄影诊断经验)放射科医师以第5版BI-RADS标准[11]回顾性评估肿块及钙化性病变并分类。乳腺X线诊断BI-RADS 2~4a类定义为良性病变,BI-RADS 4b~5类定义为恶性病变,计算放射科医师的ACC、SEN、SPE。
6.统计学分析
采用SPSS 22.0进行统计学分析,绘制ROC曲线并计算AUC。选择cutoff值一般取约登指数最大时对应的值,约登指数为敏感度+特异度-1。采用配对卡方检验评估放射科医师和影像组学模型两种方法的诊断结果的一致性,以P<0.05为差异有统计学意义。
结 果
在乳腺肿块模型预测肿块区域绝大部分得到放射科医师认可,仅少数(10%)乳腺X线图像中肿块病变需要人工修改,而乳腺钙化分割模型预测结果完全覆盖乳腺X线图像中钙化区域。
乳腺肿块和钙化组学特征提取均为102个,对特征向量进行归一化、降维后选择模型达到最优效能的组学特征,分别为9个、13个。本研究两种影像组学模型建模流程见表1,描述了各自的归一化方法、降维方法、特征选择器、分类器。

表1 影像组学模型构建流程
影像组学模型对乳腺肿块和钙化区域分割模型预测的ROI分析结果见图2~5。影像组学模型鉴别乳腺肿块和钙化良恶性的ROC曲线见图6,训练集的AUC均达1,测试集的AUC分别为0.84、0.88,影像组学模型对肿块和钙化良恶性二分类的cutoff值分别为0.644、0.676。乳腺X线摄影肿块和钙化的影像组学模型和高年资放射科医师诊断能力评估见表2,影像组学模型的ACC、SPE、SEN与高年资放射科医师类似,肿块、钙化组学模型分别与放射科医师的诊断结果的一致性对比,差异无统计学意义(P=0.66、0.69)。
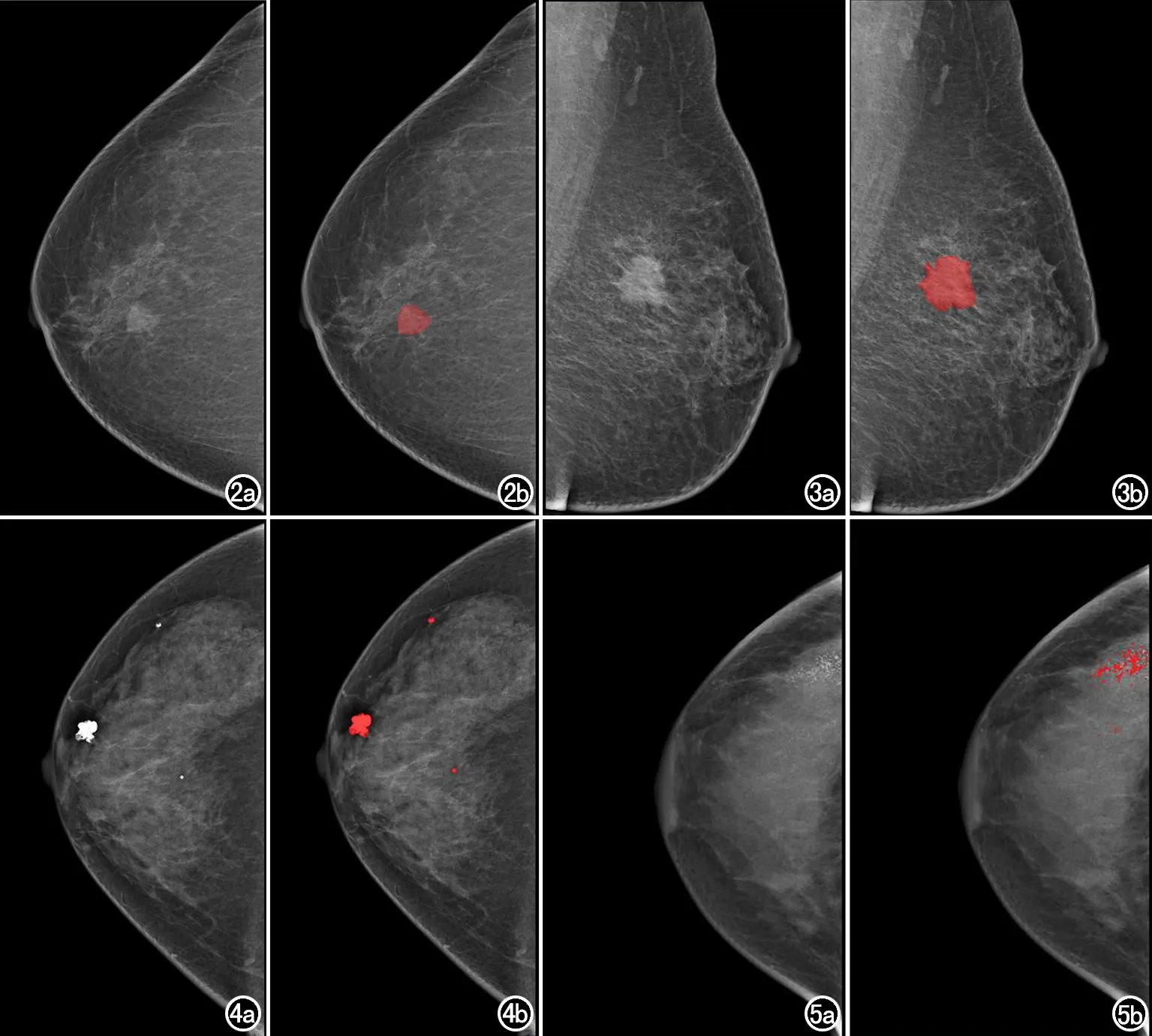
图2~5 乳腺X线摄影中常见病变的分割模型对乳腺肿块和钙化区域预测的ROI(红色区域)。 图2 女,56岁,右乳内上象限显示边界清晰、边缘光滑的稍高密度肿块,径线约1.5cm×2.1cm,高年资放射科医师诊断为BI-RADS 4a类,影像组学评分(Rad-score)为0.272,行手术切除,病理结果为纤维腺瘤。 图3 女,48岁,左乳外上象限显示边缘分叶状、短毛刺稍高密度肿块,径线约2.4cm×2.9cm,高年资放射科医师诊断为BI-RADS 5类,Rad-score为0.966,行手术切除,病理结果为浸润性导管癌。 图4 女,32岁,右乳散在点状、圆形、颗粒状钙化影,高年资放射科医师诊断为BI-RADS 2类,Rad-score为0.001,1年后随访乳腺超声及乳腺X摄影检查未见恶性结果。 图5 女,38岁,右乳外上象限显示砂砾样、不均质钙化,呈区域分布,高年资放射科医师诊断为BI-RADS 5类,Rad-score为0.997,行手术切除,病理结果为浸润性导管癌。
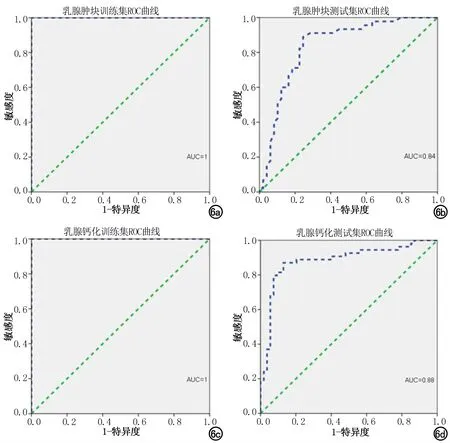
图6 a)乳腺肿块在影像组学模型在训练集的ROC曲线;b)乳腺肿块在影像组学模型在测试集的ROC曲线;c)乳腺钙化在影像组学模型在训练集的ROC曲线;d)乳腺钙化在影像组学模型在测试集的ROC曲线。
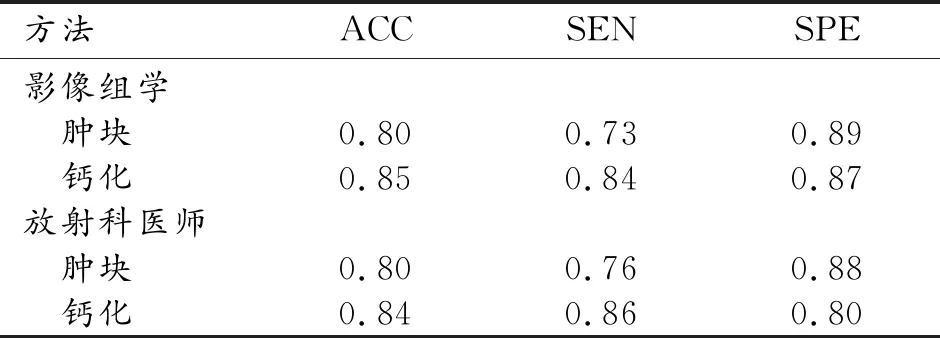
表2 影像组学模型和放射科医师在测试集中预测效能
讨 论
乳腺X线摄影检查已广泛应用于女性乳腺癌筛查检查中,乳腺癌在其中最为常见且直接的征象是肿块和钙化[12],依据病变特征(如径线、边缘、形态)进行BI-RADS分类,但是特征之间存在复杂的相互作用,因此对于放射科医师做出准确诊断仍是具有挑战性的。基于人工智能的影像组学是利用大量医学影像数据进行有效定量分析和预测的新兴技术,从临床医学图像中提取肉眼无法识别的定量特征,并利用影像组学特征与病理结果之间关联,建立个性化预测模型[13]。影像组学已成功应用于肿瘤学领域,包括肺癌[14]、前列腺癌[15]、乳腺[16]等,进行相关的病理类型、分子分型、肿瘤分期、疗效评估等研究。既往已有研究采用影像组学技术基于乳腺X线图像来鉴别乳腺癌[17]、钙化良恶性[18]以及预测淋巴结转移[19]等。
目前较少有针对乳腺X线图像中肿块和钙化良恶性鉴别的研究。Lei等[18]研发了基于乳腺X线图像的影像组学模型对于BI-RADS 4类钙化良恶性鉴别,在测试集中AUC为0.8。本研究探讨影像组学模型鉴别乳腺肿块和钙化的良恶性,结果显示,在测试集中乳腺肿块和钙化的影像组学特征有明确的预测价值,AUC分别为0.84、0.88;乳腺肿块和钙化组学模型和有经验放射科医师对比差异均没有统计学意义(P>0.05)。本研究与既往研究的不同之处有两点:第一,本研究输入的是全部钙化,而非仅BI-RADS 4类。BI-RADS定义了良恶性钙化的类型及表现,选择4、5类钙化进行分析,有可能帮助医生提高诊断符合率。但在实际场景中,如果模型仅识别4、5类病灶,则需要医生先检出钙化、行BI-RADS分类,如有4、5类病灶,则将这些区域输入模型预测,得到预测结果后,医生结合模型预测结果做出最终诊断。这个流程中医生参与了较多环节。笔者希望的场景是:摄片完成后,图像自动输入到模型中,模型针对所有钙化灶自动预测,全部结果返回后,医生结合模型预测结果做出最终诊断,医生打开报告即可见到已预测好的良恶性分类结果。在模型准确性较高的前提下,这个场景医生花费的时间较短。因此,笔者目前把所有钙化都输入组学模型进行训练。第二,本研究采用了半自动标注方法,这是影像组学研究的一个常用技术路线。通常人工标注的ROI虽具有较高的准确性、重复性,但也有耗时、费力的缺点,因此越来越多的研究试图使用自动或半自动方法完成标注。本单位既往大量研究中对乳腺钼靶病灶的分割技术已经非常成熟,基于AI分割病灶的精确性和可重复性高,本研究分割范围大部分得到专业医师的认可,仅有一小部分(10%)的病变需要修改,因此选择了以AI为基础的半自动标注方法。
本研究有一定局限性。第一,作为回顾性研究,纳入肿块病例均为边界相对明确者,存在一定选择偏倚。而实际临床中乳腺肿块性病变表现多种多样,如边界不清、肿块合并钙化等,因此需要增加样本量,入组复杂病例,必要时进行更多的亚组分析,最终应行前瞻性研究评估影像组学模型对乳腺肿块各种病变表现的良恶性鉴别。第二,本研究基于病灶进行数据分析。研究图像选择的原则是根据最终病理或随访结果:恶性病灶必须获得病理证实才能入组,良性病灶应随访至少一年以上。由于影像组学是研究病灶局部特征,因此获得病理或随访证实的图像,无论其位于CC还是MLO都可以入组,结果分析也是基于病灶,与摄片体位无关。在临床工作中,如CC或MLO上均有可见病灶,通常医生读片时会判断CC和MLO上的病灶是否为同一病灶,如为同一病灶则将二者特征综合考虑。本研究不涉及判断不同体位图像中病灶是否为同一病灶的内容,这是本研究的不足之一。第三,本研究中乳腺X线图像中高密度钙化病变评估有一定优势,但是对于敏感度相对较低的肿块病变,常联合乳腺超声检查图像,来提高诊断的符合率,今后研究中可联合乳腺X线片及超声图像建立乳腺病变的组学模型,进而增加研究结果的临床应用价值。最后,本研究仅是对乳腺病变良恶性鉴别,而在实际工作报告中BI-RADS分类对于病变有更明确的风险分层及临床建议,因此后续应探讨组学模型对乳腺常见病变的BI-RADS分类应用价值的研究,并与临床结构式报告对接、优化工作流程。
总之,本研究建立的影像组学模型可以提取并量化乳腺X线图像纹理特征,在鉴别乳腺边界清晰肿块和钙化的良恶性方面是可行的,有潜在的临床应用价值。但是,本研究依然有未完善之处,后续探索可在研究设计、图像纳入、病变分类方面更加符合临床场景,成为辅助放射科医师诊断的新技术。
