腹腔镜辅助D2根治性全胃切除术联合细胞免疫对胃癌患者肿瘤标志物水平的影响
2022-03-20孙宏建
孙宏建
(佳木斯市中心医院肿瘤科,黑龙江 佳木斯 154002)
胃癌是我国发病率最高的恶性肿瘤,主要的临床症状为食欲不振、恶心呕吐、消瘦乏力等,严重威胁患者的生命安全[1]。目前临床上治疗胃癌最有效的方式仍然是手术,其中腹腔镜辅助D2根治性全胃切除术应用较广泛,但是对于中晚期胃癌患者术后复发率较高,且预后较差。随着医学技术的快速发展,细胞免疫能够通过提高患者的非特异性细胞免疫水平,对肿瘤细胞开展直接杀伤作用,调节机体免疫水平,达到治疗的目的[2]。本研究探讨腹腔镜辅助D2根治性全胃切除术联合细胞免疫对胃癌患者肿瘤标志物水平的影响。
1 资料与方法
1.1一般资料:选择2018年5月~2019年12月本院收治的64例胃癌患者作为本次研究对象,应用双色球法随机分为手术组和联合组各32例。手术组男18例,女14例;年龄45~68岁,平均(56.61±10.08)岁;肿瘤直径2~10 cm,平均(4.82±1.02)cm;TNM分期:Ⅱ期21例,Ⅲ期11例。联合组,男19例,女13例;年龄45~70岁,平均(56.65±10.10)岁;肿瘤直径2~10 cm,平均(4.85±1.05)cm;TNM分期:Ⅱ期22例,Ⅲ期10例。两组临床资料差异无统计学意义(P>0.05)。
纳入标准:①依据《胃癌诊疗规范2018版》确诊为胃癌患者[3];②预计生存期在3个月以上者;③知情、同意并签署本次研究者。排除标准:①意识障碍者;②手术禁忌证者;③凝血障碍者;④合并有心肝肾肺等严重疾病者;⑤失访者。本次研究已经过本院医学伦理委员会同意。
1.2方法:手术组应用腹腔镜辅助D2根治性全胃切除术进行治疗。患者进行全身麻醉,取平卧位,首先进行脐孔穿刺,建立人工气腹压(术中维持在2.0 kPa左右)。然后从脐孔置入套管针和镜头,观察腹腔后在左侧腋前线肋缘下2 cm处作主操作口置入器械,接着在右侧锁骨中线2 cm处、脐横线交点偏上2 cm处、右侧前线肋缘下2 cm处分别作一个5 mm的辅助操作口;再利用超声刀切断胃结肠和脾胃韧带及大网膜,游离动静脉,依次切断肝胃韧带、胃部右动静脉,使得全胃游离;再接着确定肿瘤情况,清扫D2淋巴结;最后在腹部正中作长7 cm左右的辅助切口,切断十二指肠残端,切除远端胃,采取毕Ⅰ/Ⅱ式吻合术;清洗腹腔后置入引流管,关闭腹腔结束手术。
联合组在手术组基础上加用细胞免疫进行治疗。手术前抽取患者100 ml外周血,利用梯度离心机分离单核细胞,并放入RPMI1640 培养基(条件:5%CO2、37℃)中培养。第4天加入75 ng/ml粒细胞-巨噬细胞集落刺激因子(GM-CSF)、50 ng/ml重组人白细胞介素-4(rhIL-4)、40 μg/ml肿瘤抗原;第5天加入50 mg/ml肿瘤坏死因子-α(TNF-α);第7天收获抗原负载成熟的树突细胞(CD细胞)。然后收集非贴壁细胞,稀释至1×106个/ml,加入1 000 U/ml γ-干扰素、1 000 U/ml重组人白细胞介素-2(rhIL-2);每隔3 d加入2 500 U/ml rhIL-2;在第10天和第12天收获细胞因子诱导的杀伤细胞(CIK细胞)。CD细胞、CIK细胞均经过流式细胞术检测,注射前测试病毒、细菌、真菌和支原体为阴性。第1个疗程在腹股沟淋巴结周围区皮下注射1×1010个免疫细胞(DC-CIK细胞),12 d为1个疗程,共治疗3个疗程。
1.3观察指标:①T细胞亚群水平:利用美国Beckman Coulter生产的流式细胞仪测试两组患者治疗前、治疗后的外周血T细胞亚群水平,包括CD3+、CD4+、CD8+、CD4+/CD8+。②肿瘤标志物水平:利用罗氏诊断产品(上海)有限公司生产的Cobas e411型电化学发光全自动免疫分析仪通过电化学发光免疫法测试两组患者化疗前、化疗后的糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)水平。③随访1年生存状况:对两组患者治疗后进行随访1年,统计生存率,并利用Prizm软件绘制生存曲线。
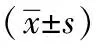
2 结果
2.1两组治疗前、治疗后T细胞亚群水平比较:两组治疗前CD3+、CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P>0.05)。治疗后CD3+、CD4+、、CD4+/CD8+均比治疗前显著上升且联合组比手术组更高,CD8+均比治疗前降低且联合组比手术组更低,差异均有统计学意义(P<0.05)。见表1。

表1 两组治疗前、治疗后T细胞亚群水平比较
2.2两组治疗前、治疗后肿瘤标志物水平比较:两组治疗前CA125、CA19-9、CEA水平差异无统计学意义(P>0.05);治疗后均比治疗前显著下降,且联合比手术组更低,差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗前、治疗后肿瘤标志物水平比较
2.3随访1年两组生存状况比较:手术组的生存率为71.88%(23/32),联合组的生存率为96.88%(31/32),两组比较差异有统计学意义(χ2=5.807,P<0.05)。见图1。

图1 生存曲线
3 讨论
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,致死率极高[4],并且该病早期临床症状不明显易被忽视,诊断时往往为中晚期,增加临床治疗难度[5]。目前临床上针对中晚期胃癌患者常采用腹腔镜辅助D2根治性全胃切除术进行治疗,但是术后复发率较高,且预后较差,生存率较低[6]。
免疫疗法是通过增强肿瘤细胞的免疫功能,诱导身体产生更强的抗肿瘤作用来发挥作用,即通过肿瘤患者自身的免疫力来达到治疗肿瘤的目的[7]。故免疫疗法能够改善胃癌患者免疫功能,进而改善胃癌患者T淋巴细胞亚群水平,治疗后联合组CD3+、CD4+、CD4+/CD8+明显高于手术组,CD8+明显低于手术组。
胃DC细胞能够通过呈递肿瘤抗原诱导机体产生抗原特异性细胞毒T细胞杀伤肿瘤细胞,CIK细胞能够通过分泌细胞因子杀死肿瘤细胞。而CA125是一种OC125结合的糖蛋白,CA19-9是一种低聚糖肿瘤相关抗原,CEA是一种复杂的含糖蛋白,均与胃癌的发生密切相关[8]。DC-CIK免疫疗法能够显著杀死胃肿瘤细胞,改善患者预后,降低CA125、CA19-9、CEA水平。本研究发现,联合组的CA125、CA19-9、CEA水平显著低于手术组。同时手术组生存率明显低于联合组。分析其原因,联合组患者通过DC-CIK免疫疗法在提高患者免疫力的同时有效杀伤肿瘤细胞,改善胃癌患者预后,延长生存周期。
综上所述,应用腹腔镜辅助D2根治性全胃切除术联合细胞免疫治疗胃癌患者能够显著改善T细胞亚群水平和生存状况,降低肿瘤标志物水平。
