小麦赤霉病菌拮抗菌的筛选及拮抗特性研究
2022-03-18李艳情翟焕趁薛晓雯覃雨良张帅兵吕扬勇马平安乙江岚胡元森
李艳情,翟焕趁,薛晓雯,覃雨良,张帅兵,吕扬勇,魏 闪,马平安,乙江岚,胡元森
(河南工业大学生物工程学院,河南 郑州 450001)
0 引言
【研究意义】禾谷镰刀菌(Fusarium graminearum)是小麦赤霉病的主要病原菌,该菌不仅使小麦产量减少,还会产生脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)等真菌毒素。近年来,受全球气候及农业秸秆处理方式变化的影响,小麦赤霉病在世界各地频发,毒素污染日趋频繁,严重影响了农产品的品质和食品安全(Zhang et al.,2014)。尽管种植抗病品种小麦是防治赤霉病的理想措施,但农作物的抗性改良难度大、进展缓慢,目前最常用的防治方法依然是使用化学杀菌剂,其长期使用必然会导致病原菌耐药性增强、环境污染等问题(Wegulo et al.,2015)。因此,筛选禾谷镰刀菌拮抗菌,开发生防菌剂是一条不可忽视的重要途径。【前人研究进展】国内外研究发现,真菌、放线菌和细菌等多种微生物对禾谷镰刀菌均具有抑制作用。有研究发现,酿酒酵母菌在室内和田野中均可使禾谷镰刀菌的生长受到抑制,降低赤霉病的发生率(Schisler et al.,2011);土壤中分离的木霉(Trichoderma gamsii)6085能减少水稻和小麦中赤霉病的发生(Matarese et al.,2012);Palazzini等(2017)发现放线菌中的链霉菌(Streptomycessp.)RC87B能防控小麦赤霉病及减少DON的产生。能拮抗禾谷镰刀菌的细菌研究报道较多,这些拮抗菌包括从不同材料中分离的不同种属的菌种,不同拮抗细菌具有各自的特性,以不同的机制抑制禾谷镰刀菌菌体生长或阻控DON毒素的产生,具有潜在的生防应用价值。一种分离于小麦根际土壤的铜绿假单孢菌(Pseudomonas aeruginosa)可通过产生抗菌物质吩嗪-1-甲酰胺(PCN)而抑制禾谷镰刀菌在小麦穗和籽粒上产生DON毒素(Sun et al.,2021);从小麦种子内分离的多粘类芽孢杆菌(Paenibacillus polymyxa)可通过形成生物膜、合成嗜铁素、吲哚乙酸等抗菌物质防控赤霉病的发生(Herrera et al.,2016);从田间土壤中分离的奇异变形杆菌(Proteus mirabilis)、枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)等对小麦禾谷镰刀菌的侵染有重要的防控效果(徐剑宏等,2013;冉军舰等,2016;周清等,2019;马东方等,2021)。也有研究表明,禾谷镰刀菌拮抗菌的存在并不限于在与小麦种植相关的土壤或植株中,在其他环境中分离到的一些拮抗菌可表现出某些独特的化学特性和生物学功能。Zhao等(2015)从丝瓜花粉囊中分离到一株枯草芽孢杆菌,其抗菌活性与菌株产生的几丁质酶和抗菌肽有关;从普通花生壳、高寒草甸牦牛牛粪中分离的解淀粉芽孢杆菌可通过产生伊枯草素等胞外脂肽类物质抑制禾谷镰刀菌生长和毒素产生(Shi et al.,2014;陈亮等,2017)。【本研究切入点】在不同地域、环境及广泛的基质中继续开展禾谷镰刀菌拮抗菌的分离、筛选,深入研究其生物学特性,是探索对日益严重的小麦赤霉病发生和DON污染的重要解决方案,是对现有防控手段研发的重要补充。【拟解决的关键问题】采用平板对峙法筛选对禾谷镰刀菌具有抑制作用的菌株,根据菌落形态、生理生化特性和16S rDNA系统发育分析对拮抗菌进行种类鉴定;通过PCR扩增抗菌脂肽基因、发酵条件试验、抑菌物质的抑菌特性分析进行拮抗菌的拮抗特性研究;通过接种小麦穗和小麦籽粒试验验证拮抗菌对小麦赤霉病的防治效果及对DON毒素的抑制作用,以期从小麦根际土壤中分离对小麦赤霉病菌具有拮抗作用的生防菌株,为防控小麦赤霉病和DON毒素污染提供科学依据。
1 材料与方法
1.1 试验材料
小麦根际土壤分别采自河南省郑州市西郊(东经113°27'53.2″,北纬34°49'18.0″)、濮阳市南乐县(东经115°5'41.8″,北纬36°8'9.0″)和商丘市柘城县(东经115°19'58.8″,北纬34°7'25.9″)等地,郑州的土壤为褐土,濮阳和商丘的土壤为潮土,连续多年种植小麦,赤霉病害偶有发生。禾谷镰刀菌野生型菌株PH-1由福建农林大学病原真菌与真菌毒素重点实验室惠赠;大肠杆菌菌株DH5α由河南工业大学粮油食品微生物危害防控创新实验室保存;小麦购买自河南省农业科学院种子中心。
1.2 试验方法
1.2.1 拮抗菌的分离鉴定
1.2.1.1 禾谷镰刀菌菌丝及其孢子培养 将保存在-80 ℃冰箱中的菌株PH-1活化,取菌落边缘的菌丝块接种到CM固体培养基(蔗糖10.0 g/L、酸水解干酪素6.0 g/L、酵母粉6.0 g/L、琼脂粉20.0 g/L)中,28 ℃培养3 d,用于抑菌试验;菌丝接种到CMC培养基(羧甲基纤维素钠16.0 g/L、硝酸铵1.0 g/L、磷酸二氢钾1.0 g/L、七水硫酸镁0.5 g/L、酵母粉1.0 g/L)中,28 ℃下150 r/min摇床培养3 d,过滤收集孢子,将孢子浓度调节为1×106CFU/mL,用于拮抗菌筛选及对孢子萌发、DON毒素合成的影响等试验。
1.2.1.2 拮抗菌的分离与筛选 将采集的小麦根际土壤采用梯度稀释法依次制备10-3、10-4和10-5稀释度的悬液,将不同稀释度的悬液100 μL涂布在LB培养基平板上,30 ℃培养2 d,挑取颜色、形态不同的细菌菌落进行纯化、保存。进一步对分离获得的菌株进行抑制试验:在距离CM培养基平板中心2 cm处接种待测细菌的菌液,28 ℃培养1 d后,将菌株PH-1的菌丝块接种在培养皿中心,28 ℃培养4 d后观察是否有抑菌圈出现,有抑菌圈出现的为拮抗菌,测量其抑菌圈直径(周清等,2019)。
1.2.1.3 拮抗菌鉴定 将拮抗菌在LB培养基上划线,37 ℃培养1 d,观察其菌落特征;对拮抗菌进行革兰染色,观察其个体细胞形态和颜色;对拮抗菌进行生理生化特性分析(东秀珠和蔡妙英,2001)。为明确拮抗菌株的属种,以DNA为模板,扩增菌株的16S rDNA 序列并进行测序,测出的序列在NCBI数据库进行比对,运用MEGA 7.0基于16S rDNA构建菌株的系统发育进化树;同时扩增脂肽合成基因以鉴定拮抗物质的特性,所需引物序列参考陈亮等(2017)的方法。16S rDNA和抗菌脂肽基因的PCR扩增体系25.0 μL:DNA模板1.0 µL,正、反向引物各1.0 µL,2×RapidTaqMaster Mix 12.5 µL,ddH2O 9.5 µL。PCR反应程序:(1)扩增16S rDNA序列的程序:95 ℃预变性3 min;95 ℃15 s,55 ℃15 s,72 ℃1 min,进行35个循环;72 ℃延伸5 min。(2)扩增抗菌脂肽相关基因的程序:表面活性素基因(sfp)、丰原素基因(fenB)和伊枯草菌素基因(ituD)扩增的退火温度分别为47、57和46 ℃,其他扩增条件与16S rDNA序列扩增的程序相同。
1.2.2 拮抗菌的拮抗特性测定
1.2.2.1 不同培养基对拮抗菌生长的影响 将过夜培养的拮抗菌发酵液按5%的接种量分别接种到含有100 mL CM、LB和PDA液体培养基的三角瓶中,37 ℃下180 r/min摇床培养,0~24 h内每2 h取样,此后每12 h取样,测定拮抗菌的OD600,观察不同培养基中拮抗菌的生长情况,找出最优发酵条件。
1.2.2.2 拮抗菌中抑菌物质的定位 将过夜培养的拮抗菌发酵液接种于100 mL CM液体培养基中,37 ℃发酵10 h,收集发酵液进行离心,上清液用0.22 μm滤膜抽滤后获得无菌上清液;离心后的沉淀通过无菌PBS洗涤2次,超声破碎30 min,12000 r/min离心25 min,取上清即为菌体破碎液。将菌株PH-1菌落最边缘的菌丝块接种在CM培养基中心,在距离平板中心2 cm处用打孔器打孔并弃去孔内培养基,在孔内分别加入150 μL不同浓度的无菌上清液或菌体破碎液,以无菌水为对照,28 ℃培养箱中静置3 d,观察拮抗效果(何露,2019)。
1.2.2.3 拮抗菌无菌上清液对禾谷镰刀菌菌丝生长和孢子萌发的影响 向融化并晾至55 ℃左右的100 mL CM固体培养基中分别加入4、8和16 mL无菌上清液,不加无菌上清液的CM培养基作对照,充分混匀后倒平板。在培养皿中央接种菌株PH-1的菌丝,28 ℃培养3 d,观察菌落形态和生长变化。分别将0.8、1.6和8.0 mL拮抗菌的无菌上清液加入到CM液体培养基(蔗糖10.0 g/L、酸水解干酪素6.0 g/L、酵母粉6.0 g/L)至总体积为16 mL,以不加无菌上清液的CM液体培养基为对照,于25 ℃下180 r/min 摇床培养,24 h时观察并记录菌株PH-1孢子的萌发情况。
1.2.2.4 拮抗菌无菌上清液及其粗提蛋白的稳定性分析 无菌上清液的稳定性用温度、酸、碱处理进行分析,参考朱明杰(2013)的方法,略有改动。将无菌上清液分别在40、50、60、70、80、90和100 ℃条件下处理30 min,以25 ℃下的无菌上清液为对照;取无菌上清液分别调节pH为3、4、5、6、7、8、9、10和11,处理24 h后再调节pH至中性条件;测定各种处理后的无菌上清液对菌株PH-1菌丝生长的抑制率。无菌上清液中的蛋白粗提液通过硫酸铵沉淀法制备,操作流程参考何露(2019)的方法,将胰蛋白酶、木瓜蛋白酶和蛋白酶K分别加入蛋白粗提液中,使其终浓度为1 mg/mL,37 ℃处理2 h,然后通过平板对峙抑菌试验分析粗提蛋白对3种酶的敏感特性。
1.2.2.5 拮抗菌无菌上清液对禾谷镰刀菌DON毒素的影响 灭菌后的50 g小麦中分别加入不同浓度无菌上清液,加无菌水为对照,然后接种菌株PH-1孢子液,28 ℃静置培养,21 d时测定小麦中的DON毒素,每组均设3个重复,分析无菌上清液对DON毒素的影响,具体操作参考孟瑶等(2019)的方法。
1.2.3 拮抗菌对小麦赤霉病的防治效果及对小麦生长的影响
1.2.3.1 拮抗菌无菌上清液对小麦赤霉病的防治效果 用菌株PH-1孢子液(浓度为1×105CFU/mL)和拮抗菌发酵后的无菌上清液制备接种液,调节无菌上清液的浓度分别为25%、50%和100%,以无菌水为对照,向扬花初期的小麦穗中接种,具体操作和结果分析参考武爱波(2005)的方法,分析拮抗菌的无菌上清液对小麦赤霉病的防控效果。
1.2.3.2 拮抗菌无菌上清液对小麦生长的影响用2%次氯酸钠对小麦进行表面消毒,再使用无菌水洗涤3次后转移至玻璃杯中,湿纱布进行保温培养至小麦种子露白,选择长势一致的种子用拮抗菌发酵液的无菌上清液处理24 h,无菌水、无菌CM培养基处理为对照,将处理过的小麦种子栽种于花盆中,22 ℃温室中培养21 d,观察小麦生长情况,测定小麦茎长、根长和湿重。
1.3 统计分析
试验数据运用SPSS 20进行单因素方差分析和配对样本T检验,使用Prism 8制图。
2 结果与分析
2.1 拮抗菌的分离与筛选结果
经稀释分离和平板培养分离从采集的多个小麦根际土壤样本中分离得到800多株细菌,经对峙法抗菌检测获得5株禾谷镰刀菌的拮抗菌;通过进一步的抗菌比较,发现5株菌株对禾谷镰刀菌的抑制效果存在差异(表1),其中以菌株XW-10的抑菌圈直径最大,拮抗效果最好(图1)。后续试验选择菌株XW-10进行拮抗特性研究。
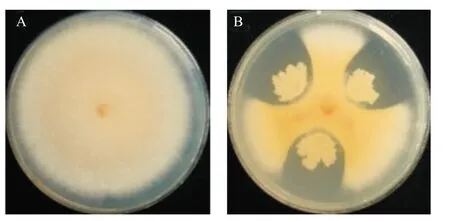
图1 菌株XW-10对禾谷镰刀菌的拮抗作用Fig.1 Antagonistic effect of strain XW-10 on F.graminearum

表1 拮抗菌对禾谷镰刀菌的拮抗活力Table 1 Antagonistic activity of antagonistic bacterial strains against F.graminearum
2.2 拮抗菌XW-10鉴定结果
拮抗菌XW-10在LB培养基上菌落呈白色,不透明,表面较干糙,为革兰氏阳性菌,杆状,能产生芽孢(图2)。对拮抗菌进行细菌学生理生化特性分析显示,接触酶、甘露醇、木糖、柠檬酸盐、淀粉水解、VP试验、葡萄糖、L-阿拉伯糖、酪蛋白水解和明胶液化等试验均为阳性,50 ℃生长、pH 5.7生长、7%氯化钠生长等为阳性,甲基红试验阴性,生理生化特性与解淀粉芽孢杆菌相符。进一步对拮抗菌进行分子生物学分析,16S rDNA克隆测序表明,其片段长度为1449 bp(GenBank序列号:ON326557.1),经NCBI比对获得与其同源性较高的菌株,利用NJ法构建系统发育进化树,结果(图3)显示,拮抗菌XW-10的16S rDNA序列与解淀粉芽孢杆菌(B.amyloliquefaciens)位于同一分支,相似性达100%,其他各分支的相似性均较低。基于拮抗菌的形态特征、生化特性和16S rDNA系统发育分析结果,确定拮抗菌XW-10为解淀粉芽孢杆菌。在该菌中扩增抗菌脂肽合成相关的关键基因,结果(图4)显示,可在菌株中扩增出1400 bp的fenB基因、1100 bp的sfp基因和1203 bp的ituD基因片段,表明拮抗菌XW-10具有合成抗菌脂肽的能力。

图2 菌株XW-10的形态特征Fig.2 Morphological characteristics of strain XW-10

图3 基于16S rDNA序列构建的菌株XW-10系统发育进化树Fig.3 Phylogenetic tree of strain XW-10 based on 16S rDNA sequences

图4 抗菌脂肽合成相关基因的PCR扩增Fig.4 PCR amplification of genes related to antagonistic lipopeptide synthesis
2.3 拮抗菌XW-10在不同培养基中的生长情况
分析拮抗菌在CM、LB和PDA等不同培养基中的生长情况,结果(图5)显示,拮抗菌在CM培养基中培养10 h时,菌液的OD600达最大,为1.91,细胞数目达最多,此后至48 h无明显变化;在LB培养基中培养24 h时虽然也能达到与CM培养基中同样的OD600,但时间较长;在PDA培养基中培养8 h时OD600达最高,但仍低于其他培养基,因此,在CM培养基中培养10~48 h为拮抗菌发酵的最佳时期。

图5 拮抗菌XW-10在不同培养基中的生长情况Fig.5 Growth of antagonistic bacterium XW-10 in different media
2.4 拮抗菌XW-10发酵液对禾谷镰刀菌菌丝生长的影响
分析拮抗菌XW-10的不同浓度发酵液对菌株PH-1生长的抑制情况,结果(图6)显示,菌株XW-10的发酵液浓度越高,菌株PH-1菌丝生长越慢,加入16%菌株XW-10发酵液时抑制率达45.00%。

图6 拮抗菌XW-10发酵液对禾谷镰刀菌PH-1菌丝生长的影响Fig.6 Effects of antagonistic bacterium XW-10 fermentation broth on mycelium growth of F.graminearum PH-1
2.5 拮抗菌XW-10拮抗物质的定位与拮抗作用测定结果
为进一步明确拮抗菌的拮抗物质在细胞内外存在的情况,将拮抗菌XW-10发酵后的无菌上清液和菌体破碎液进行抑菌分析,结果(图7)显示,拮抗菌的无菌上清液可显著抑制禾谷镰刀菌PH-1菌丝的生长,而菌体破碎液对禾谷镰刀菌菌丝生长无明显的抑制作用,表明拮抗菌的拮抗物质主要分泌在细胞外,即在发酵上清液中。显微镜下观察拮抗菌对禾谷镰刀菌菌丝形态的影响,结果(图8)显示,培养基中不加拮抗菌的无菌上清液时,禾谷镰刀菌的菌丝呈现长而直的形态,生长方向有序,分支均匀;但培养基中加有拮抗菌的无菌上清液时,禾谷镰刀菌的菌丝生长出现畸形,菌丝分支增多,菌丝中间出现“莲藕状”的节点,显示拮抗菌的无菌上清液对禾谷镰刀菌菌丝生长和菌丝形态均有显著影响。分析不同浓度的拮抗菌无菌上清液对禾谷镰刀菌孢子萌发的影响,结果(图9、图10)显示,在培养24 h时,未用拮抗菌的无菌上清液处理禾谷镰刀菌的孢子全部萌发;用不同浓度的拮抗菌无菌上清液处理禾谷镰刀菌的孢子时,孢子萌发受到影响,随无菌上清液浓度的增加,孢子萌发率下降,在无菌上清液浓度为100%时,禾谷镰刀菌的孢子萌发被完全抑制。
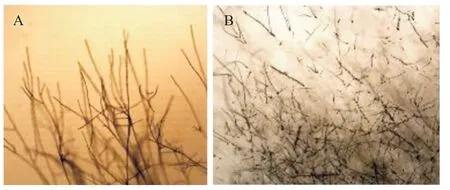
图8 拮抗菌XW-10的无菌上清液对禾谷镰刀菌菌丝形态的影响Fig.8 Effects of antagonistic bacterium XW-10 cell-free supernatant on F.graminearum mycelial morphology
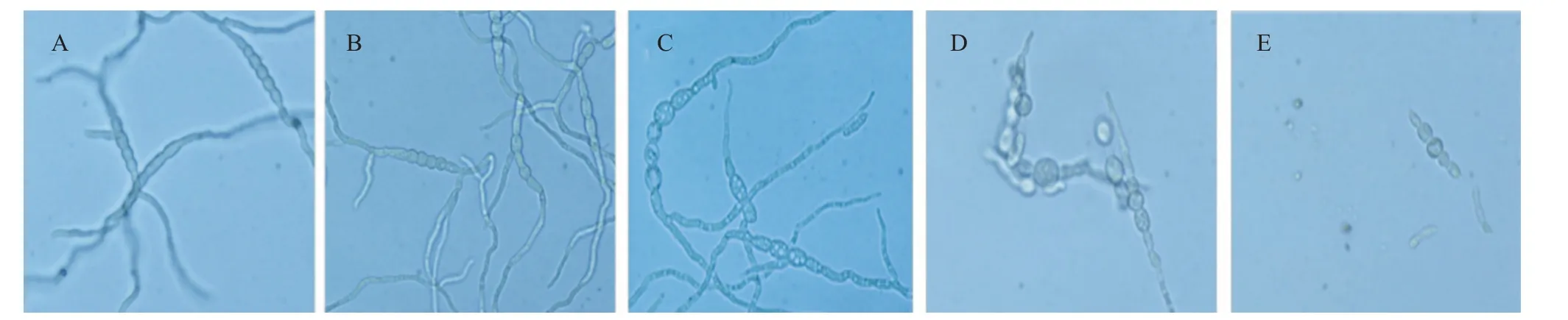
图9 拮抗菌XW-10无菌上清液对禾谷镰刀菌孢子萌发的抑制作用Fig.9 Inhibition effect of antagonistic bacterium XW-10 cell-free supernatant on F.graminearum spore germination

图10 拮抗菌XW-10的无菌上清液对禾谷镰刀菌孢子萌发的影响Fig.10 Effects of antagonistic bacterium XW-10 cell-free supernatant on F.graminearum spore germination
2.6 拮抗菌XW-10无菌上清液的稳定性测定结果
为明确拮抗菌XW-10发酵无菌上清液的稳定性,进一步分析不同温度和pH处理对拮抗菌的无菌上清液拮抗活性的影响,结果(图11)显示,在低于90 ℃处理时,拮抗菌的无菌上清液对菌株PH-1菌丝生长的抑制效果未受温度的影响,经100 ℃处理后则完全丧失抑菌活性。将拮抗菌的无菌上清液经过酸或碱处理后进行抑菌试验,结果(图12)显示,在pH为7时,拮抗菌的无菌上清液对菌株PH-1菌丝生长的抑制率最高,达48.38%,pH<4或pH>8时抑菌活性明显下降。稳定性测定结果表明,拮抗菌的无菌上清液在100 ℃时失活,拮抗物质适合在pH为中性条件下发挥抑菌作用。

图11 拮抗菌XW-10无菌上清液对温度的敏感性Fig.11 Sensitivity of antagonistic bacterium XW-10 cell-free supernatant to temperature
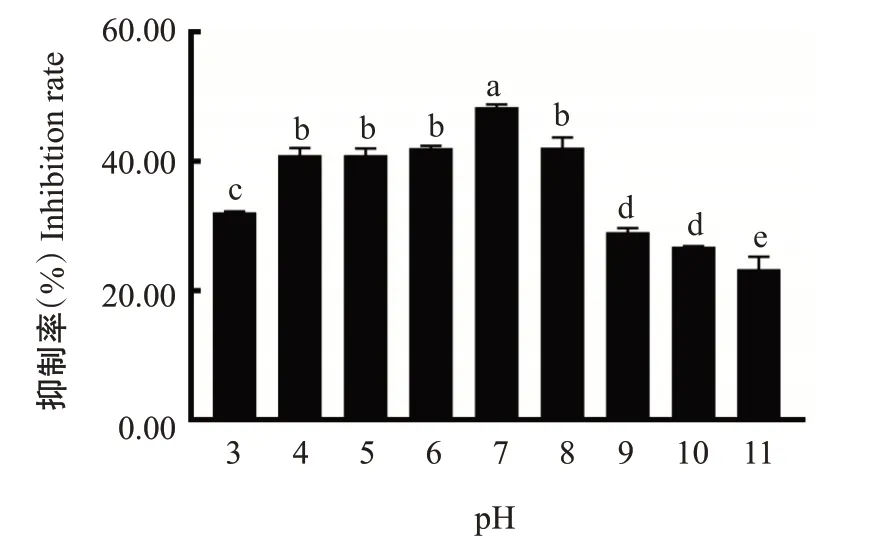
图12 拮抗菌XW-10无菌上清液对pH的敏感性Fig.12 Sensitivity of antagonistic bacterium XW-10 cell-free supernatant to pH
2.7 拮抗菌XW-10无菌上清液的粗提蛋白对蛋白酶的敏感特性
通过硫酸铵沉淀法提取拮抗菌XW-10无菌上清液中的粗蛋白并经过不同酶处理,分析粗蛋白对禾谷镰刀菌的拮抗作用。与对照相比,拮抗菌XW-10蛋白粗提液对禾谷镰刀菌的菌丝生长有明显的抑制作用;粗提蛋白经木瓜蛋白酶、胰蛋白酶和蛋白酶K处理后对禾谷镰刀菌生长的抑制效果与未处理的粗蛋白基本一致,说明拮抗菌XW-10无菌上清液中的粗蛋白对胰蛋白酶、木瓜蛋白酶和蛋白酶K均不敏感(图13)。

图13 拮抗菌XW-10粗提蛋白对3种酶的敏感性Fig.13 Sensitivity of crude antagonistic bacterium XW-10 protein to three enzymes
2.8 拮抗菌XW-10无菌上清液对禾谷镰刀菌DON毒素积累的影响
为解析拮抗菌对禾谷镰刀菌DON毒素积累的影响,将禾谷镰刀菌的孢子液和不同浓度的拮抗菌XW-10无菌上清液同时加入到小麦基质培养基中,21 d时测定小麦基质中DON毒素含量,结果(图14)显示,不加拮抗菌无菌上清液的小麦中DON毒素含量达2316.5 µg/kg,而添加拮抗菌无菌上清液比例分别为30%和50%时,小麦中DON毒素浓度分别为540.9和96.0 µg/kg,比对照组分别下降92%和94%;全部为拮抗菌无菌上清液时,产生的毒素仅为50.2 µg/kg,表明拮抗菌XW-10无菌上清液显著降低了DON毒素在小麦基质中的含量。

图14 拮抗菌XW-10无菌上清液对小麦基质中DON毒素合成的影响Fig.14 Effects of antagonistic bacterium XW-10 cell-free supernatant on DON toxin synthesis in wheat matrix
2.9 拮抗菌XW-10无菌上清液对小麦的促生长特性和对小麦赤霉病的防控效果
进一步通过盆栽试验分析菌株XW-10对小麦生长的影响。与对照组相比,用拮抗菌XW-10无菌上清液处理的小麦生长态势较好,小麦的茎长、根长、湿重均显著增加(P<0.05)(图15和表2),表明拮抗菌XW-10具有促进小麦苗生长的作用。将菌株PH-1孢子液接种到扬花期的小麦穗上,测验拮抗菌对小麦赤霉病的防病效果,结果(图16)显示,对照组小麦籽粒染病粒率超过95%,将麦穗分别用25%、50%和100%浓度的菌株XW-10发酵无菌上清液喷雾处理后再接种病菌,可观察到发病籽粒数目明显减少,喷雾100%发酵上清液的相对防效达51%,说明菌株XW-10发酵上清液对小麦赤霉病具有明显的防治效果。

图16 拮抗菌XW-10无菌上清液对小麦赤霉病的防控效果Fig.16 Prevention and control effect of antagonistic bacterium XW-10 cell-free supernatant on wheat scrab

表2 拮抗菌XW-10无菌上清液对小麦幼苗基本生长的影响Table 2 Effects of antagonistic bacterium XW-10 cell-free supernatant on basic growth of wheat seedlings

图15 拮抗菌XW-10无菌上清液对小麦生长的影响Fig.15 Effects of antagonistic bacterium XW-10 cell-free supernatant on wheat growth
3 讨论
生物防治具有次生危害小、环境友好等优势,可减少化学农药残留、病原菌产生耐药性等当前农业生产中存在的突出问题(Zhou et al.,2021),已成为农作物病虫害防控发展的方向。国内外有许多学者投入了农业病害拮抗微生物的研究,在菌株筛选、拮抗物质分离及作用机理解析等方面有许多新发现,并在不断丰富农业病害生物防治的知识库。本研究分离的菌株XW-10经16S rDNA和细菌学生理生化分析鉴定,确定为解淀粉芽孢杆菌,这是一类作物栽培土壤中常见的细菌。尽管该菌与已报道的拮抗菌在生物分类上隶属于同一种群,但从不同环境分离的菌株可能具有不同的抑菌活性。王军华等(2006)报道的解淀粉芽孢杆菌Q-12也分离自土壤,研究发现其产生的抗菌物质可抑制镰刀菌、曲霉、青霉等多种能引起食品腐败的病原菌生长,有很好的作为食品防腐剂的潜力;Fan等(2018)研究发现,解淀粉芽孢杆菌FZB42除次生代谢产物外,挥发性有机化合物在生物和非生物胁迫下均对作物病害有防控效果,并且具有广谱抗性,对小麦、草莓、生菜和马铃薯等多种植物病害均具有明显的防治效果。因此,在已有研究的基础上开展新分离的解淀粉芽孢杆菌的生物学特性分析及作物病害防控研究可进一步挖掘其实际应用价值。
本研究分离的拮抗菌XW-10经PCR扩增发现含有fenB、sfp和ituD等与抗菌脂肽合成相关的关键基因,因而具有合成抗菌脂肽的潜在能力。研究发现,菌株XW-10在胞外产生抑菌物质,因而有效成分主要在发酵上清液中,这一结果与张宝(2014)、叶景文(2017)等多数研究解淀粉芽孢杆菌拮抗作用的报道相同。本研究利用拮抗菌XW-10无菌上清液对禾谷镰刀菌进行菌丝生长和孢子萌发的影响试验,发现拮抗菌无菌上清液可使镰刀菌的菌丝形态发生明显畸变,孢子萌发率下降,与胡元森等(2013)报道的拮抗菌株Jc-07发酵滤液对禾谷镰刀菌的抑制作用相同。本研究也发现拮抗菌的无菌上清液中具有抑菌作用的可能是某种蛋白,对该抑菌物质的分离纯化及抑制机理研究有待进一步开展。
作物病害防控最终的目标是在田间开展应用,这对生防菌剂提出了较高要求,不仅需要保证菌剂对种植作物生长不产生有害影响(Huang et al.,2016;周清等,2019),还要求菌剂具有良好的稳定性和对不良环境的较强抗性(周鹏,2014;Palazzini et al.,2016;Awla et al.,2017)。通过小麦苗种植试验表明,菌株XW-10及其代谢产物对小麦苗的生长表现出一定的促进作用,呈现了该菌的良好应用潜质。拮抗菌对植物的促生长作用与很多因素有关,如产铁载体、产吲哚乙酸、解磷作用、固氮作用、拮抗作用等。周清等(2019)从小麦根际土壤分离出一株奇异变形杆菌DY05,马莉敏(2021)从芳香植物百里香根部分离出内生菌铜绿假单胞菌XBLGC3,这2种不同的菌株不但对禾谷镰刀菌有显著的拮抗作用,而且均能产生铁载体和吲哚乙酸,对小麦的生长有显著的促进作用。本研究分离获得的拮抗菌XW-10对小麦促生长的机制有待深入研究,但拮抗菌在控制病原菌的同时可促进植物生长的特性为拮抗菌在农业生产中的应用打下基础。
在有效成分的稳定性方面,解淀粉芽孢杆菌具有芽孢杆菌本身固有的抗热特性,菌株XW-10无菌上清液对90 ℃以下的高温均有良好的稳定性,这些特性对于实际应用具有重要意义。我国小麦产区赤霉病主要发生在5月份前后的小麦扬花期或乳熟期,该时期气温已逐渐升高,在强烈的阳光辐射下田间的温度更高,如果将发酵液直接在田间喷洒进行生防处理,则有效成分的耐热性成为直接影响作用效果的关键因素。如果需要将生防物质商品化,为了便于储藏、运输,通常可通过浓缩、添加载体等处理制成粉剂,在这些后处理环节,发酵液的加工工艺过程均对菌体及其有效成分的抗热性和稳定性提出较高要求。
4 结论
本研究从小麦根际土壤中分离获得的菌株XW-10经鉴定为解淀粉芽孢杆菌,在发酵无菌上清液中具有可抑制禾谷镰刀菌生长和DON毒素产生的拮抗物质;拮抗菌XW-10发酵无菌上清液对小麦苗生长有益,可明显减少麦穗中的赤霉病粒比例;产生的拮抗有效物质属于蛋白类化合物,其活性不被常规蛋白酶钝化,稳定性和耐热性良好,具有作为小麦赤霉病生防菌剂的潜质。
