H7N9亚型禽流感病毒血凝素蛋白在杆状病毒中的表达及其免疫效力评估
2022-03-16郭晓琴张谞霄马诚太欧杰李柏林李鑫
郭晓琴 张谞霄 马诚太 欧杰 李柏林 李鑫




摘要: 旨在利用杆状病毒表达系统构建1株对高致病性H7N9亚型禽流感病毒(A/Chicken/Huizhou/HZ-3/2016)攻击后的家禽提供保护的候选疫苗株。用同源重组的方法构建1株表达H7N9亚型禽流感病毒(A/chicken/Shaoxing/5201/2013株)血凝素(Hemagglutinin, HA)蛋白的重组杆状病毒。用PCR技术鉴定重组杆状病毒rBac-SX5201HA的遗传稳定性,用间接免疫荧光方法和Western Blotting方法鉴定HA蛋白的表达情况,用血凝试验检测HA蛋白的体外活性,继而对重组疫苗在无特定病原体(Specific pathogen free, SPF)鸡上进行免疫效力试验,并对免疫后21 d的SPF鸡血清进行抗体检测,对攻毒5 d后的鸡咽喉和泄殖腔棉拭子进行病毒分离。结果显示,重组杆状病毒rBac-SX5201HA在昆虫细胞中生长良好,且可稳定高效表达H7 HA蛋白,血凝效价可达26;重组疫苗免疫SPF鸡21 d后可诱导28.4血凝抑制(Hemagglutinin inhibition, HI)抗体效价并能抵抗高致病性H7N9亚型禽流感病毒的攻击,免疫组SPF鸡群均未发病或死亡,仅有17%的SPF鸡在攻毒后第5 d出现排毒。可以看出,重组疫苗对高致病性H7N9亚型禽流感病毒攻击后的SPF鸡提供了100%的保护,且可有效抑制病毒在SPF鸡体内的复制。
关键词: H7N9亚型禽流感病毒;重组杆状病毒;血凝素;免疫原性
中图分类号: S852.65+7 文献标识码: A 文章编号: 1000-4440(2022)01-0143-08
Abstract: The aim of this study is to construct a candidate vaccine strain for protection against highly pathogenic H7N9 subtype avian influenza virus (A/Chicken/Huizhou/HZ-3/2016) in poultry using baculovirus expression system. A recombinant baculovirus (rBac-SX5201HA) expressing H7N9 (A/chicken/Shaoxing/5201/2013) hemagglutinin (HA) protein was constructed. Genetic stability of rBac-SX5201HA was confirmed by PCR. Expression of HA protein was identified by indirect immunofluorescence assay (IFA) and Western blotting. The activity of HA protein in vitro was detected by HA assay. Immunogenicity and efficacy of recombinant vaccine were studied by animal trial on specific pathogen free (SPF) chickens. Antibody titer of chicken serum collected at 21 days after immunization was tested, and virus isolation was performed for chicken oropharyngeal and cloacal cotton swabs at five days post-challenge. The results showed that recombinant baculovirus (rBac-SX5201HA) stably and efficiently expressed H7 HA protein in insect cells, and HA titer could reach 26. The recombinant vaccine induced 28.4 hemagglutinin inhibition (HI) antibody titer in SPF chickens, and could resist the attack of highly pathogenic H7N9 subtype avian influenza virus. The SPF chickens in the immunized group did not get sick or die, and shedding was found from 17% SPF chickens at five days post-challenge. Recombinant vaccine provides protection against highly pathogenic H7N9 subtype avian influenza virus and effectively inhibits virus replication in SPF chickens.
Key words: H7N9 subtype avian influenza virus;recombinant baculovirus;hemagglutinin;immunogenicity
禽流感(Avian influenza, AI)是一种禽类烈性传染病,会严重危害家禽养殖业的发展和人类的健康,从而引起社会的广泛关注。2013年春季,重组H7N9亚型禽流感在中国暴发,造成不同程度的人群感染和死亡[1]。之后,每年冬春季节均有H7N9流感疫情出现[2]。截至2020年,中国已陆续暴发6波人感染H7N9亚型禽流感的疫情。对2017年出现的H7N9变异毒株进行基因序列分析发现,其血凝素蛋白裂解位点处存在4个连续的碱性氨基酸插入,属于高致病性流感病毒[3]。2013年2月到2020年5月,联合国粮食及农业组织已报道出现1 568例人感染H7N9亚型禽流感病毒病例,其中616例死亡。为了人类的健康和家禽养殖业的可持续发展,疫苗免疫是防御H7N9亚型禽流感病毒的有效措施。因此,研制針对H7N9亚型禽流感病毒的疫苗具有重要意义。
传统的鸡胚苗存在鸡胚供应不稳定、外源病毒污染风险大、浪费量大等缺点[4]。禽流感DNA疫苗则存在免疫原性弱、表达效率低等缺点[5]。昆虫杆状病毒表达系统摆脱了鸡胚的限制,具有生产成本低、安全性高、表达的蛋白质生物活性高、免疫原性好及可快速生产等优点[6-9]。昆虫细胞的培养无需血清,不易受外源病毒和支原体污染,且无需纯化。有报道显示,杆状病毒自身有一定的免疫佐剂效应,可以增强疫苗的免疫反应[10]。
本研究通过杆状病毒表达系统构建了1株rBac-SX5201HA疫苗候选株,并对其在昆虫细胞中的复制能力、血凝素(HA)蛋白的体外活性,HA蛋白的表达水平及其在无特定病原体(Specific pathogen free, SPF)鸡上的免疫效力等进行了一系列评估,以期为H7N9重组杆状病毒疫苗的进一步研究和生产提供依据。
1 材料与方法
1.1 质粒、细胞
PVL1393质粒、昆虫Sf9细胞、昆虫SF+细胞均由勃林格殷格翰公司提供。
1.2 主要试剂
高保真限制性内切酶Bam H I和Eco R I、T4 DNA连接酶、PCR扩增的相关试剂均购自New England Biolabs (NEB)公司;TOP10感受态细胞购自天根生化科技(北京)有限公司;质粒抽提试剂盒、DNA抽提试剂盒、胶回收试剂盒均购自QIAGEN公司;用于Sf9细胞培养的EXcell 420培养基购自Sigma公司;转染试剂盒、Alexa FluorTM 488羊抗鸡抗体购自Invitrogen公司;杆状病毒DNA购自Expression Systems公司;禽流感H7亚型(H7-Re1)标准抗原和标准血清购自哈尔滨维科生物技术开发公司;山羊抗鸡IgY H&L(HRP)购自Abcam公司;4%鸡红细胞购自南京森贝伽生物科技有限公司。
1.3 质粒PVL1393-SX5201HA的构建
选取GenBank中公布的A/chicken/Shaoxing/5201/2013株的血凝素(HA)基因序列(登录号:AJJ91725.1)作为供体基因,并根据昆虫细胞表达系统密码子偏好性进行碱基优化,由金斯瑞生物科技有限公司合成HA基因。合成的HA基因用Eco R I和Bam H I雙酶切后连接到经相同酶切后的PVL1393载体上,在TOP10感受态细胞上转化并进行氨苄抗性筛选。然后挑取单克隆培养,抽提质粒后经双酶切鉴定条带正确后送到生工生物工程(上海)股份有限公司对HA基因进行测序验证,阳性重组质粒命名为PVL1393-SX5201HA。
1.4 重组杆状病毒的遗传稳定性鉴定
基于同源重组的原理,将PVL1393-SX5201HA质粒和线性化的苜蓿银纹夜蛾多角体病毒(AcMNPV)基因组DNA利用Lipofectamine 3000脂质体在Sf9细胞上进行共转染,4 d后收集上清液,得到rBac-SX5201HA-P1,保存于-80 ℃冰箱中。同时在室温下对上述转染后的Sf9细胞用等体积甲醇、丙酮混合溶液进行固定,进行间接免疫荧光(IFA)鉴定。经过3轮空斑纯化后,纯净的rBac-SX5201HA-P4在SF+细胞上得到了传代扩繁,扩繁条件如下:细胞密度为1 ml 1×106个细胞,感染复数(MOI)=0.01, 4 d后收获上清液并保存在-80 ℃冰箱中。将病毒连续扩繁至P9代,测定每代病毒的半数组织培养物感染剂量(TCID50)。与此同时,提取P1、P8、P9代重组病毒DNA,对重组HA基因片段进行PCR扩增,将其HA序列与原始HA序列进行比对。PVL1393-F引物序列:5′-AAATGATAACCATCTCGC-3′;PVL1393-R引物序列:5′-GTCCAAGTTTCCCTG -3′。
1.5 间接免疫荧光试验(IFA)
将重组杆状病毒rBac-SX5201HA-P1、rBac-SX5201HA-P8、rBac-SX5201HA-P9接种Sf9细胞培养5 d后,弃去上清,在室温下用等体积甲醇、丙酮混合溶液固定细胞20 min后,去掉固定液,于通风橱内晾干,以H7-Re1亚型阳性血清为一抗(1∶500),以Alexa FluorTM 488羊抗鸡抗体为二抗(1∶500),在荧光显微镜下观察。
1.6 Western Blotting试验
将P7~P9代重组杆状病毒按感染复数为0.1接种SF+细胞,5 d后收获细胞悬液。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,以H7-Re1亚型阳性血清为一抗(1∶1 000),以山羊抗鸡IgY H & L(HRP)作为二抗(1∶2 000),进行Western Blotting试验。
1.7 重组病毒HA基因编码蛋白质的表达条件优化
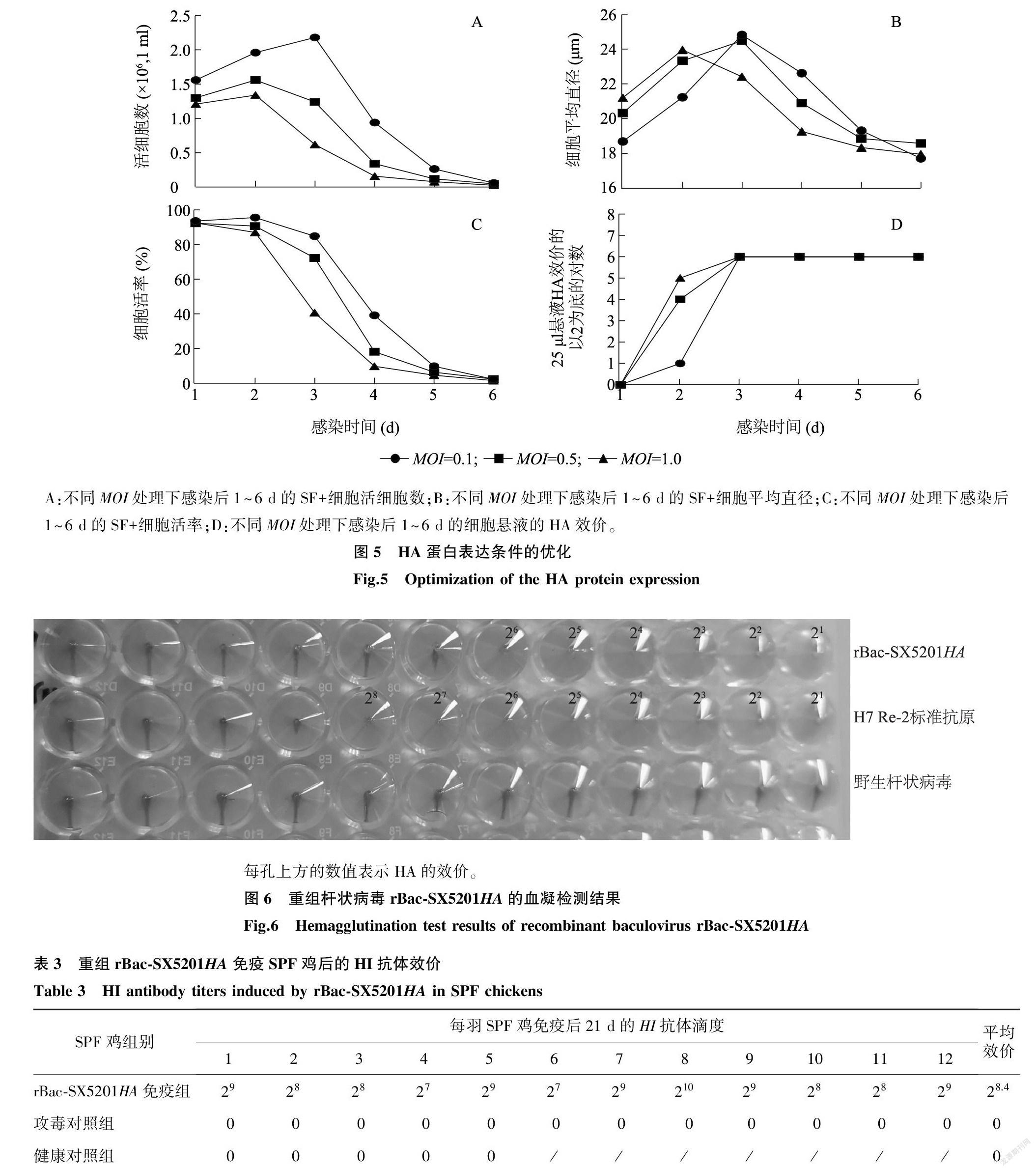
将重组杆状病毒按MOI=0.1、0.5、1.0分别接种于密度为1 ml 1×106个细胞的悬浮SF+细胞中,在感染后1~6 d对细胞的活率、活细胞数、细胞直径和细胞悬液的HA效价进行检测。按照《中华人民共和国兽药典》(2015年版)[11]附录中的HA试验方法进行HA效价检测。
1.8 抗原的准备
准备密度为1 ml 1×106个的SF+细胞,将重组杆状病毒rBac-SX5201HA-P8按MOI=0.1接种至悬浮SF+细胞中,5 d后收获细胞悬液。
1.9 疫苗的制备
将矿物油与抗原(方法1.8中的细胞悬液)按2∶1的体积比使用小型乳化机进行乳化,于16 000 r/min乳化3 min,对乳化后的抗原进行无菌和物理性状检验。
1.10 SPF鸡免疫效力试验
本试验在华南农业大学ABSL-3动物实验室中进行且经过实验动物使用与管理委员会批准(编号:AUP-18-53),不同组别的鸡配置不同的隔离器。选取高致病性的H7N9亚型禽流感病毒的HZ-3(A/Chicken/Huizhou/HZ-3/2016)毒株作为本试验的攻毒株。选取29羽健康的10日龄SPF鸡并随机将其分成3组,其中12羽鸡经颈部皮下免疫rBac-SX5201HA-P8(免疫剂量为0.5 ml),12羽鸡作为攻毒对照组,另外5羽鸡作为空白对照组,免疫效力试验的具体安排见表1。免疫后21 d采集血液样本,离心后取血清,用商品化H7-Re1作为标准抗原,并按照《中华人民共和国兽药典》(2015年版)附录方法中的HI试验方法检测鸡群的HI抗体效价。
免疫后第21 d,对第1组、第2组所有鸡经滴鼻进行H7N9病毒A/Chicken/Huizhou/HZ-3/2016(HZ-3)株攻毒,攻毒剂量为5×106.0 EID50/ml。攻毒后,每天观察、记录鸡的临床症状,持续14 d。攻毒后,若鸡出现精神沉郁、羽毛粗乱、呼吸和神经症状等任何异常症状或特异性死亡,即可判定该鸡为高致病性禽流感发病。
攻毒后第5 d[12-13],采集试验鸡的咽喉、泄殖腔棉拭子,每个样本接种3枚9~11日龄SPF鸡胚,于37 ℃孵育72 h,收集鸡胚尿囊液后进行HA效价测定。攻毒后第14 d,将所有存活鸡进行安乐死。
2 结果与分析
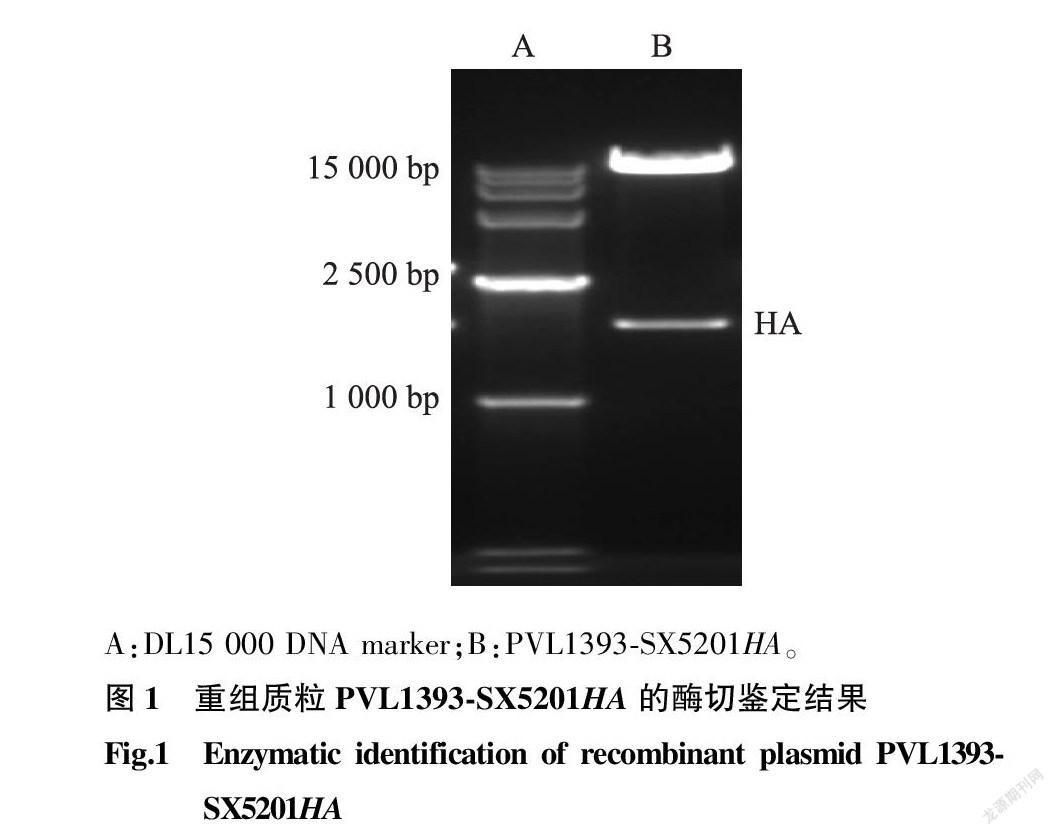
2.1 重组质粒PVL1393-SX5201HA的双酶切鉴定
重组质粒PVL1393-SX5201HA经Eco R I、Bam H I双酶切后,经电泳鉴定,发现在1 700 bp左右有1个特异性条带(图1),与目的条带大小一致。测序后经序列比对分析发现,插入基因的序列与原始合成序列完全一致,无任何基因突变,表明重组质粒PVL1393-SX5201HA构建成功。
2.2 重组杆状病毒rBac-SX5201HA的遗传稳定性鉴定
PCR结果表明,P1、P8、P9代重组杆状病毒rBac-SX5201HA DNA均可扩增出大小为1 900 bp左右、含目的HA基因的条带(图2)。测序后进行序列比对发现,P1、P8、P9代重组杆状病毒rBac-SX5201HA的HA基因序列与合成的HA基因序列完全一致。同时对P5~P9代病毒的滴度进行测定发现,随着重组杆状病毒rBac-SX5201HA在SF+细胞上的传代,重组杆状病毒rBac-SX5201HA的滴度不断提高,P8代病毒的滴度达到最高值,为1 ml 108.47 TCID50(表2)。因此,选择P8代病毒用于蛋白质表达优化试验和抗原制备。
2.3 rBac-SX5201HA的间接免疫荧光鉴定
被重组杆状病毒rBac-SX5201HA-P1、rBac-SX5201HA-P8、rBac-SX5201HA-P9感染的Sf9細胞可见特异性绿色荧光,对照组均未见荧光,表明本试验成功拯救了重组杆状病毒rBac-SX5201HA,并且其在Sf9细胞中可有效表达H7 HA蛋白。rBac-SX5201HA的间接免疫荧光鉴定结果见图3。
2.4 HA蛋白的表达及鉴定
Western Blotting鉴定结果(图4)显示,在重组杆状病毒rBac-SX5201HA感染的SF+细胞悬液中可以检测到1条相对分子质量为70 000左右的条带,表明重组rBac-SX5201HA的HA蛋白在SF+细胞中获得成功表达。
2.5 HA蛋白表达条件的优化
由图5可以看出,感染后的活细胞数先增加,当MOI=0.1时,在感染后第3 d活细胞数达到峰值;当MOI=0.5、1.0时,在感染后第2 d活细胞数达到峰值,随后活细胞数急速下降,在感染后第6 d细胞几乎全部死亡。从感染后第1 d开始,SF+细胞的平均直径先不断变大,当MOI=1.0时,在感染后第2 d细胞平均直径达到峰值;当MOI=0.1、0.5时,在感染后第3 d细胞平均直径达到峰值,然后细胞平均直径不断变小。感染后的细胞活率不断下降,并在感染后第5 d降到15%以下。血凝活性检测结果表明,在感染后第3~6 d,不同MOI感染组的HA效价均可保持在26(25 μl细胞悬液)的水平。为了便于后期大规模生产,最终选取MOI=0.1、感染后第5 d收获细胞悬液进行动物试验用抗原的制备。
2.6 疫苗的准备及检验
将rBac-SX5201HA-P8按MOI=0.1的感染复数接种至SF+细胞中,感染后5 d收获细胞悬液,25 μl细胞悬液的HA效价为26(图6)。对乳化后的rBac-SX5201HA抗原进行质量检验,从疫苗检验结果可以看出,本研究制备的抗原为均一的乳白色乳剂,无明显分层或破乳,瓶底无水相析出;剂型为油包水(W/O);滴水检验结果显示,除第1滴外,其余5滴在10 s内无明显扩散;3 000 r/min离心结果显示,管底无水相析出;黏度为44.2 cP;粒径为0.7 μm;无菌检测结果显示无细菌和霉菌生长。由此可见,疫苗质量合格。
2.7 免疫效力评估
HI检测结果表明,免疫组鸡血清HI抗体平均效价可达28.4,而未免疫组鸡群中均未检测到HI抗体,表明疫苗免疫可诱导较高的HI抗体水平(表3)。以高致病性H7N9亚型禽流感病毒HZ-3株作为攻毒株,攻毒后4 d内攻毒对照组鸡群全部发病死亡,其他鸡群在临床观察期间均未有发病死亡的情况(图7)。攻毒后5 d,病毒分离结果表明,免疫组1羽鸡发现咽喉排毒,另1羽鸡发现泄殖腔排毒,总体排毒率为17%;免疫组其他鸡和健康对照组鸡的咽喉、泄殖腔均未检测到排毒。由此可见,重组杆状病毒rBac-SX5201HA可对H7N9亚型禽流感病毒HZ-3株攻击后的SPF鸡提供保护,且可有效抑制病毒在鸡体内的复制。
3 讨论
目前一般多用杆状病毒表达禽流感的HA、NA、M1和M2等蛋白质和病毒样粒子。2013年,由Protein Sciences Corporation利用杆状病毒表达系统(BEVS)研制的第1支禽流感重组三价疫苗FluBolk成功上市[14],FluBolk四价流感疫苗于2016年获批上市,该疫苗与鸡胚源四价流感疫苗相比,具有免疫效果好、成本低等优点[15]。除此之外,Novavax公司利用杆状病毒表达的病毒样颗粒流感疫苗正处在临床阶段[16-17]。HA蛋白是决定禽流感病毒免疫原性的主要蛋白质。孙一等[18]成功构建的重组杆状病毒rBac-GD15HA、张雪花等[19]成功构建的表达H5亚型禽流感病毒 HA 蛋白共有序列的杆状病毒、Lin等[20]成功构建的BV-Dual-HA都可对禽流感病毒攻击后的动物提供很好的保护作用,这为利用杆状病毒表达系统研制理想的禽流感疫苗提供了重要的试验依据。
禽流感病毒随着HA基因突变而不断变异。为了获得1株具有广谱保护效果的禽流感疫苗,笔者对H7 HA基因序列进行了比对,选取了与保守基因序列相似性较高的H7N9亚型禽流感病毒(A/chicken/Shaoxing/5201/2013株)HA基因作为供体基因。本研究对供体HA基因在昆虫细胞表达系统中的密码子偏好性进行了碱基优化,成功构建了重组杆状病毒rBac-SX5201HA,发现其可在培养(无血清)的昆虫悬浮细胞系SF+中稳定表达具有良好免疫原性的HA蛋白,且对高致病性H7N9亚型禽流感病毒攻击后的SPF鸡提供了100%的保护,可有效预防H7N9亚型禽流感病毒感染家禽。病毒分离结果显示,攻毒5 d后,免疫组SPF鸡仅出现17%的排毒,显著抑制了禽流感病毒在SPF鸡体内的复制。HI效价被广泛用于评估禽流感疫苗的免疫原性和保护效力。本研究构建的重组杆状病毒rBac-SX5201HA免疫组鸡血清HI抗体平均效价可达28.4,与Hu等[21]构建的重组杆状病毒rBac-JX148HA相比,免疫剂量低且可以诱导更高的HI抗体水平。本研究为利用杆状病毒表达系统在悬浮培养(无血清)的昆虫细胞系中表达无需纯化的HA蛋白的禽流感亚单位疫苗研发提供了实践依据。
在重组杆状病毒rBac-SX5201HA表达的HA蛋白产量方面,后续本研究团队将尝试用其他昆虫细胞培养基及不同的SF+细胞密度进行蛋白质表达水平的优化。对于该疫苗的交叉保护性、该疫苗株在不同品种鸡中的免疫应答反应、不同免疫途径的保护效果、最小免疫剂量及免疫程序的确定等仍需要进一步探究。
致谢: 诚挚感谢勃林格殷格翰动物保健(中国)有限公司上海分公司对本试验的资助和华南农业大学对本试验提供的大力帮助!
参考文献:
[1] TANG R B, CHEN H L. An overview of the recent outbreaks of the avian-origin influenza A (H7N9) virus in the human[J].Journal of the Chinese Medical Association,2013,76(5):245-248.
[2] WANG X L, JIANG H, WU P, et al. Epidemiology of avian influenza A H7N9 virus in human beings across five epidemics in mainland China, 2013-17: an epidemiological study of laboratory-confirmed case series[J].The Lancet Infectious Diseases,2017,17(8):822-832.
[3] CHU K W, LIN Q, LIU J, et al. Human infection with highly pathogenic avian influenza A (H7N9) virus, China[J].Emerging Infectious Diseases,2017,23(8):1332-1340.
[4] PLOTKIN S, ORENSTEIN W, OFFIT P, et al. Plotkin’s vaccines[M]. Seventh edition. Netherlands: Elsevier, 2017.
[5] 馮亚亚,郭 晶,李玉保,等.禽流感DNA疫苗研究进展[J].中国畜牧兽医,2020,47(11):3667-3675.
[6] PARTRIDGE J, KIENY M P. Global production of seasonal and pandemic (H1N1) influenza vaccines in 2009-2010 and comparison with previous estimates and global action plan targets[J]. Vaccine,2010,28(30): 4709-4712.
[7] 吕 让,毛雅元,杨国辉,等.禽流感新型疫苗研究进展[J].中国畜牧兽医,2015,42(6):1608-1612.
[8] 查国飞.禽流感疫苗的研究进展[J].当代畜禽养殖业,2018(9):4-5.
[9] 周赛赛,贡 嘎,钱雯娴,等.禽流感病毒疫苗研究进展[J].甘肃畜牧兽医,2019,49(10):17-22.
[10]ABE T, TAKAHASHI H, HAMAZAKI H, et al. Baculovirus induces an innate immune response and confers protection from lethal influenza virus infection in mice[J].Journal of Immunology,2003,171(3): 1133-1139.
[11]中国兽药典委员会. 中华人民共和国兽药典[M].北京:中国农业出版社,2020:3403-3404.
[12]XIE X T, YITBAREK A, KHAN S U, et al. A within-host mathematical model of H9N2 avian influenza infection and type-I interferon response pathways in chickens[J].Journal of Theoretical Biology, 2020,499:110320.
[13]LIU K T, GAO R Y, WANG X Q, et al. Pathogenicity and transmissibility of clade 2.3.4.4 highly pathogenic avian influenza virus subtype H5N6 in pigeons[J].Veterinary Microbiology,2020,247:108776.
[14]COX M M J, PATRIARCA P A, TREANOR J. FluBlok, a recombinant hemagglutinin influenza vaccine[J]. Influenza Other Respir Viruses,2008,2(6):211-219.
[15]DIVINO V, KRISHNARAJAH G, PELTON S I, et al. A real-world study evaluating the relative vaccine effectiveness of a cell-based quadrivalent influenza vaccine compared to egg-based quadrivalent influenza vaccine in the US during the 2017-18 influenza season[J].Vaccine,2020,38(40):6334-6343.
[16]SMITH G, LIU Y, FLYER D, et al. Novel hemagglutinin nanoparticle influenza vaccine with Matrix-MTM adjuvant induces hemagglutination inhibition, neutralizing, and protective responses in ferrets against homologous and drifted A(H3N2) subtypes[J].Vaccine,2017,35(40):5366-5372.
[17]LPEZ-MACíAS C, FERAT-OSORIO E, TENORIO-CALVO A, et al. Safety and immunogenicity of a virus-like particle pandemic influenza A (H1N1) 2009 vaccine in a blinded, randomized, placebo-controlled trial of adults in Mexico[J].Vaccine,2011,29(44):7826-7834.
[18]孙 一,李如梦,李 军,等.表达高致病性H7N9亚型禽流感病毒血凝素蛋白的重组杆状病毒疫苗候选株的构建与免疫效果评估[J].中国家禽,2019,41(18):18-23.
[19]张雪花,陆吉虎,华 涛,等.通用型H5亚型禽流感病毒亚单位疫苗抗原表达和免疫效力研究[J].病毒学报,2019,35(6):864-872.
[20]LIN W Y, FAN H Y, CHENG X L, et al. A baculovirus dual expression system-based vaccine confers complete protection against lethal challenge with H9N2 avian influenza virus in mice[J].Virology Journal, 2011,8:273.
[21]HU J, LIANG Y Y, HU Z L, et al. Recombinant baculovirus vaccine expressing hemagglutinin of H7N9 avian influenza virus confers full protection against lethal highly pathogenic H7N9 virus infection in chickens[J].Archives of Virology,2019,164(3):807-817.
(責任编辑:徐 艳)
1183501186244
