野蔷薇内源多胺的HPLC测定方法及其组织变化规律
2022-03-15陈金萍杨雯翔邓致运程文翰
陈 锐,陈金萍,杨雯翔,邓致运,程文翰*
(1.荆楚理工学院 生物工程学院,湖北 荆门 448000; 2.特色花卉生物育种湖北省工程研究中心,湖北 荆门 448000;3.新疆农业大学 农学院,新疆维吾尔自治区 乌鲁木齐 830052)
多胺(polyamines, 简称PAs)存在于几乎所有生物体内,多胺分为腐胺(putrescine, 简称Put)、亚精胺(spermidine, 简称Spd)、精胺(spermine, 简称Spm)及热精胺[1].多胺在植物体内被认为像“第二信使”般发挥重要作用,如调节保卫细胞质膜中依赖电压的内向K+通道,并调节气孔孔径[2].研究表明,多胺是一种植物生长调节剂[3],能参与高等植物体内的许多生理过程,诸如形态发生、根系形成、花发育、果实发育以及衰老等.多胺可在外植体成花过程中积累,是成花的物质基础[4].多胺的合成从鸟氨酸的合成开始,腐胺是合成途径的中心产物.腐胺是精氨酸经两条不同途径形成的:一条是由鸟氨酸通过鸟氨酸脱羧酶脱羧直接形成腐胺,另一条是由精氨酸经过精胺酸脱羧酶的催化形成鲱精胺,鲱精胺水解成N-氨甲基腐胺后再形成腐胺.腐胺再经连续加入氨丙基残基生成亚精氨和精氨,而氨丙基是由S-腺苷甲硫氨酸脱羧酶催化S-腺苷甲硫氨酸(SAM)脱羧产生的脱羧SAM而来.脱羧S-腺苷甲硫氨酸除了作为甲基的供体外,也是多胺和乙烯合成的共同前体.多胺经由二胺氧化酶(DAO)和多胺氧化酶(PAO)代谢产生过氧化氢,而过氧化氢是一种重要的信号分子,参与调控各种生物过程.此外,多胺合成上游的前体精氨酸,在一氧化氮合成酶作用下可以合成一氧化氮(NO),而NO也是生物体内最重要的信号分子之一,具有很重要的生物学功能[5-6].在玉米幼胚的离体培养中,外源添加适量多胺,可有效提高根系活力,促进再生,再生苗株高、叶长、叶宽、鲜重均有显著增加[7].棉花的相关研究表明,外源多胺可改变内源多胺代谢,使内源多胺水平增加;在陆地棉体细胞胚胎发生过程中,多胺可提高诱导成苗率,表现为促进下胚轴产生愈伤组织、胚性愈伤组织分化、早期胚状体形成、成熟胚分化,最后形成再生植株,在不同时期,发挥主要作用的多胺不同[8].伏令夏橙的胚性愈伤组织中多胺含量较非胚性愈伤组织高,多胺对其体细胞胚发生表现为正调控[9].前人在对棉花[8]和伏令夏橙[9]的研究中还发现,腐胺有利于体细胞胚胎发生,随着体胚发生过程,腐胺逐渐转化为亚精胺和精胺,在胚状体时期,亚精胺和精胺的水平显著增加并达到最大值.在枸杞[10]中,腐胺含量先升后降,最后再升至最高,亚精胺只在胚性细胞分化早期出现,精胺只在胚状体发育晚期出现.此外,多胺可增强植物对环境的适应性,提高不同胁迫下植物的抗性,促进生长[11-17].
野蔷薇(RosamultifloraThunb.)是蔷薇科蔷薇属双子叶植物,用途广泛,具有广阔的开发应用前景,但植株的高效再生是前提,而关于野蔷薇体细胞胚胎发生的报道较少,且体细胞胚诱导率较低[18].多胺在野蔷薇组织培养方面的作用目前未见报道,野蔷薇不同器官和不同培养时期的组织多胺含量尚不清楚,多胺提取的方法及测定体系也鲜见报道.关于其他植物组织多胺提取的报道较多,如茶叶[19]、水稻[20]、棉花[21]等均采用高效液相色谱法,以苯甲酰氯做衍生化反应剂,以甲醇为溶剂.但多胺含量受基因差异表达影响,不同种植物、不同器官,多胺含量也不尽相同[22],因此,多胺的提取方法也可能不同,需针对不同植物材料建立不同的方法体系.笔者参照程文翰等[21]的方法,以野蔷薇为材料,初步探索野蔷薇组织多胺的提取方法及高效液相色谱(HPLC)测定方法,并用该法测定野蔷薇组培不同阶段愈伤组织及茎、叶、花等器官游离多胺的含量,探索野蔷薇体细胞胚胎发生过程中内源多胺的变化规律.
1 材料与方法
1.1 植物材料
试验所有样品材料均为当地野蔷薇,于荆楚理工学院内取样.分别取花瓣、花蕊、花苞、茎、叶片,培养3 h,3 d,5 d后的叶片,培养25 d的愈伤组织为材料,上述材料摘取后立即用液氮冷冻,后置于-70 ℃超低温冰箱中保存,备用.
1.2 植物组织培养
在野蔷薇生长期(4月初)摘取新鲜幼嫩叶片,流水冲洗尽表面尘土后,移到超净工作台内,用乙醇和升汞消毒灭菌,即得到处理好的无菌野蔷薇叶片.灭菌流程如下:先用70%~75%乙醇浸泡30~60 s,立即用无菌水清洗3~5次,再用0.1%~0.2%的升汞浸泡10 min,再次用无菌水清洗3~5次.
将上述无菌叶片切成边长为0.5 cm × 0.5 cm的小四方块,接种于愈伤组织诱导培养基中,每皿均匀接种6片,接种时,应使叶片背面接触培养基,叶片正面朝上.完成接种后,放置于无菌组培室培养,培养条件为:温度28 ℃、光照周期16 h光照/8h黑暗、光照强度2 000~3 000 lx.
1.3 试剂与仪器
多胺标准品均购自Sigma公司,纯度≥99%;甲醇为色谱纯;高氯酸、氢氧化钠、氯化钠、苯甲酰氯、乙醚均为国产分析纯;水为超纯水,电阻率为18.25 MΩ·cm;高效液相色谱仪型号为Waterse2695型,色谱柱型号为Waters C18 20 cm;低温离心机型号为湘仪TGL-16.
1.4 试验方法
1.4.1 多胺标准品测定
参考程文翰等[21]的方法,标准品测定:将多胺(Put, Spd, Spm)标准品配置成1 mmol·L-1的混合贮液,取40 μL混合液进行苯甲酰化反应及测定,绘制标准曲线.
1.4.2 野蔷薇器官及组织多胺的提取与测定
分别称取0.2 g各野蔷薇材料,用液氮研磨成粉末,转入2 mL离心管中,立即加入1.5 mL 5%预冷的高氯酸,涡旋2 min,冰浴浸提1 h后12 000 r·min-14 ℃离心20 min,取300 μL上清液于新的2mL离心管中,加入4 μL苯甲酰氯、300 μL 2 mol·L-1NaOH,涡旋30 s,37 ℃水浴衍生化反应25 min后,加入400 μL饱和NaCl 、500 μL乙醚,涡旋1 min, 5 000 r·min-14 ℃离心5 min,小心吸取上层300 μL乙醚相于1.5 mL离心管中,打开管盖,4 000 r·min-125 ℃离心,待乙醚完全挥发后,加入300 μL甲醇,涡旋5~10 min,静置溶解1 h,最后8 000 r·min-14 ℃离心1.5 min以去除提取过程中可能含有的少量杂质,收集苯甲酰多胺的甲醇溶解液至样品瓶,再加甲醇定容至500 μL,待HPLC检测.每个野蔷薇样品生物学重复2次,技术重复3次.数据采用Excel 2019版、SPSS 26.0软件处理,origin 9.6.5软件绘图.HPLC检测参数:流动相为V(甲醇)∶V(水)(60∶40);进样量15 μL;流速1 mL·min-1;柱温30 ℃;检测波长254 nm;保留时间15 min.
1.5 方法设计
1.5.1 苯甲酰化反应温度
参照刘俊等[23]对苯甲酰氯衍生化反应时不同温度的探索,试验设置30,37,40 ℃ 3个不同温度,以探索野蔷薇苯甲酰化反应的最佳温度.
1.5.2 冰浴浸提液取用量
探索不同冰浴浸提液取用量对多胺提取的影响,比较200,300,400 μL 3个不同体积取用量,以确定最终的反应体系.
1.6 回收率测定
试验采用梯度加标回收的方法,随机选取花苞和叶片为样品材料进行回收率试验.取不同体积的样品和标准品冰浴浸提液,按照2∶1 , 1∶1 , 1∶2的配比混合,然后按照1.4.2的流程反应、提取分离多胺并测定其含量,每个处理重复3次.
2 结果与分析
2.1 多胺标准品HPLC测定
将3种多胺标准品反应液按比例加入甲醇,以此推算标准品浓度.经HPLC检测后,对测定结果以浓度为横坐标,峰面积为纵坐标作图,得到标准曲线(如图1所示).标准曲线的线性方程:腐胺Puty=0.003 9x+0.001 2(R2=0.994 5);亚精胺Spdy=0.003 9x+0.000 8(R2=0.998 2);精胺Spmy=0.000 9x+0.002 7(R2=0.996 8).
3种多胺混合液经HPLC测定,分离出单个多胺的色谱峰,峰型良好无重叠,可得到单个多胺标准品的出峰时间(保留时间),以此确定待测样品中的色谱峰为何种多胺.由于氨基酸数目不同,Put(二胺)、Spd(三胺)、Spm(四胺)苯甲酰化反应后3种多胺的极性差异较大,在分离过程中,3种多胺依次出峰,未出现峰重叠现象(如图2所示).
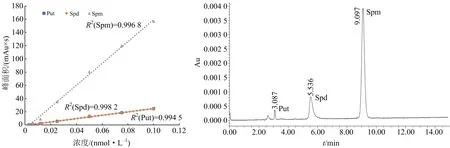
图1 多胺标准曲线 图2 多胺标准品测定色谱图
2.2 野蔷薇内源多胺的提取及测定
试验以叶片为材料,比较了苯甲酰化反应温度(30, 37,40 ℃)、不同冰浴浸提液用量(200,300,400 μL)对野蔷薇多胺提取的影响,HPLC检测结果表明(如表1所示):3个不同温度对提取结果无显著性差异;冰浴浸提液为300 μL时,精胺峰面积最大,显著大于取400 μL浸提液的峰面积,而亚精胺峰面积无显著差异,300 μL为冰浴浸提液最佳反应用量.综合3种多胺的提取效果,最终选择37 ℃作为反应温度,300 μL为最佳体系.
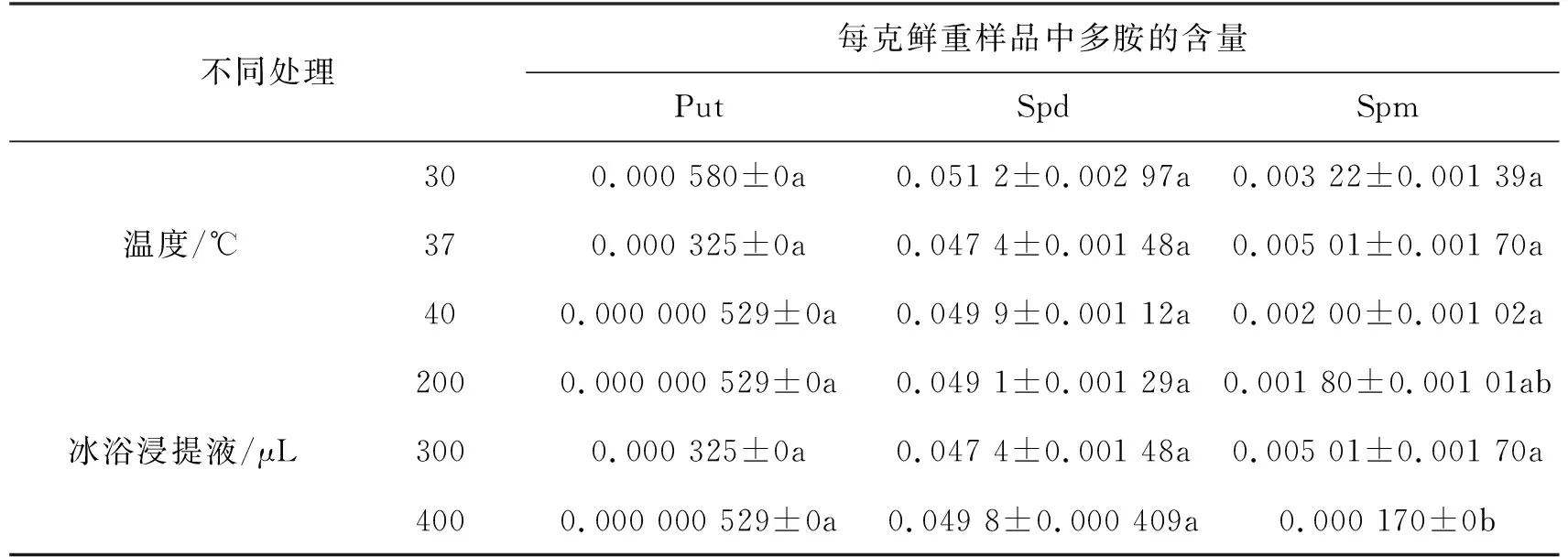
表1 不同处理下多胺的相对含量 mg·g-1
2.3 野蔷薇组织培养物HPLC测定
按照1.4.2方法中所列参数,对野蔷薇组织做HPLC检测.样品中3种多胺的出峰时间分别为:腐胺(Put)3.5 min,亚精胺(Spd)5.5 min,精胺(Spm)9.1 min,色谱图如图3所示,3种多胺依次出峰,无重叠,峰型良好,峰高、峰宽适宜,出峰时间与多胺标准品一致.
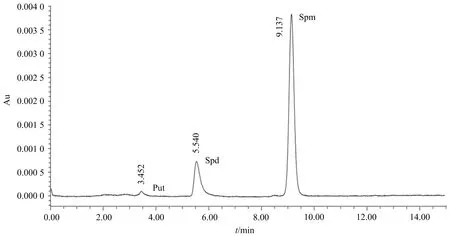
图3 野蔷薇组织多胺测定色谱图
2.4 回收率测定
回收率是检验提取方法是否可靠的依据.较高的回收率说明提取方法具有较高的准确性.实验测定结果如表2所示:回收率为87.17%~103.64%,标准差为1.71~4.60,表明方法可靠.

表2 加标回收率
2.5 野蔷薇不同组织内源游离多胺含量
试验取自然生长的野蔷薇花瓣、花蕊、花苞、茎、叶片,培养3 h,3 d,5 d后的叶片,培养25 d的愈伤组织为材料(如图4所示),测定内源多胺含量,测定结果如图5所示.

(a)3 h 叶片;(b)3 d叶片;(c)5 d叶片;(d)25 d愈伤组织;(e)叶片;(f)花瓣和花蕊;(g)花苞;(h)茎.图4 野蔷薇组织与器官
在野蔷薇体细胞胚胎发生过程中(3 h,3 d,5 d,25 d callus),内源多胺总量呈现出先逐渐上升,再逐渐下降的变化趋势,在培养3 d后达到最大值0.295 mg·g-1(FW),培养25 d的愈伤组织中多胺含量显著下降,在野蔷薇器官(花瓣、花蕊、花苞、叶、茎)中,花蕊的多胺含量最高,野蔷薇体胚发生过程多胺总含量是野蔷薇器官的2.5倍(如图 5(a));体胚发生过程中Put相对含量先升高后降低,在3 d时达到最高相对含量0.259 mg·g-1(FW),与其他时期以及其他组织相比均有极显著差异,其他组织Put含量无显著性差异(图 5(b));Spd在各组织中含量最高,其中,5 d时含量最多,达到0.265 mg·g-1(FW),花蕊其次,含量为0.050 4 mg·g-1(FW),体细胞胚胎发生过程中,Spd含量变化趋势与多胺总量变化趋势一致,不同组织间Spd含量差异为5 d>花蕊>3 d>3 h>25 d>叶>花瓣>茎>花苞(图5 (a),(c));野蔷薇组织中Spm含量较少,在5 d时达到最高,并且显著高于花、茎、叶、愈伤,其相对含量为0.006 36 mg·g-1(FW),Spm含量变化趋势与腐胺含量变化趋势一致(图5(b),(d)).以上结果表明,多胺可能对野蔷薇体细胞胚胎发生有调控作用.
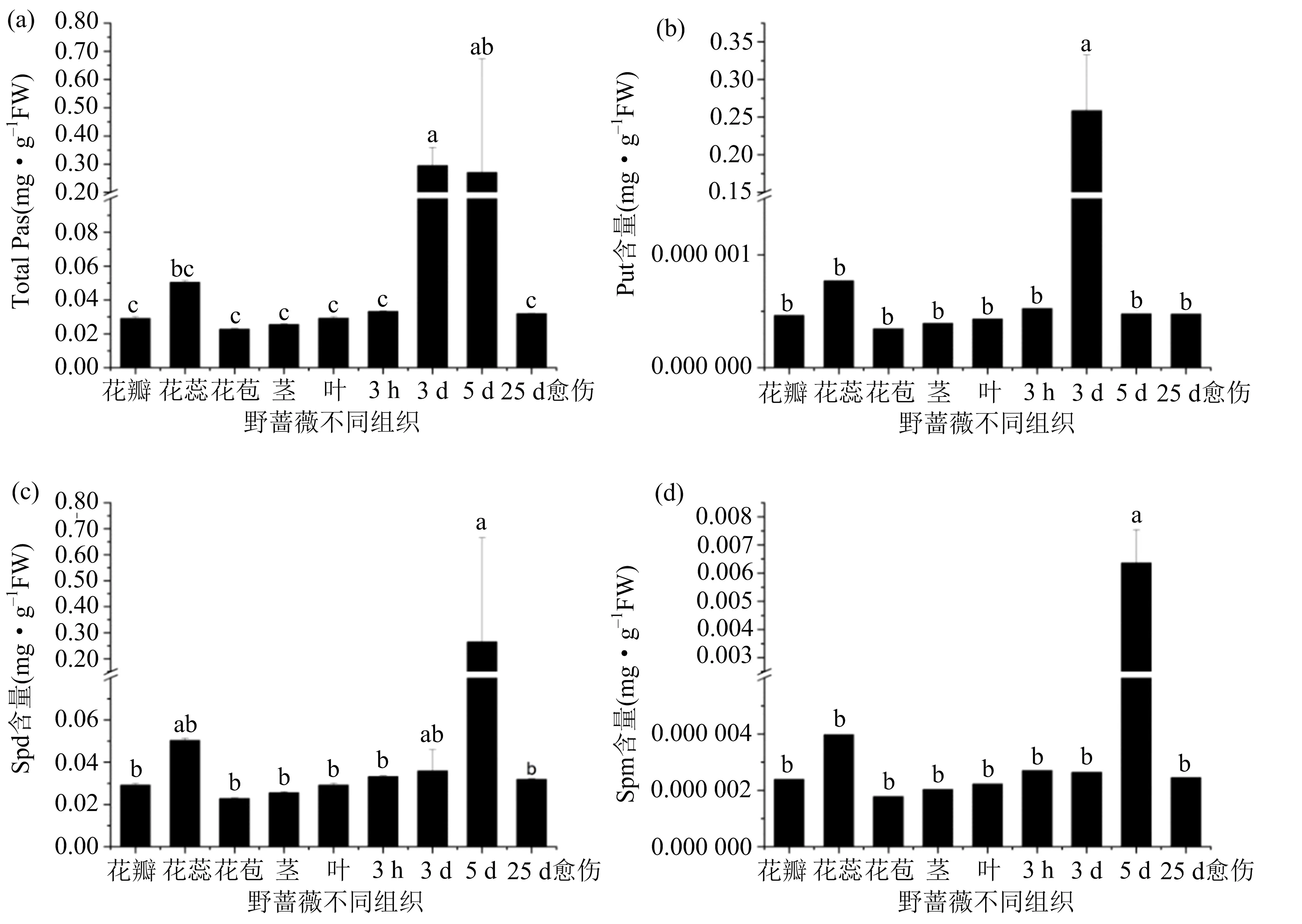
(a)多胺总量;(b)腐胺含量;(c)亚精胺含量;(d)精胺含量.数据是平均值±标准偏差(n = 3);条形上方的不同小写字母表示根据LSD多重比较在p< 0.05处存在显著差异,相同小写字母表示根据LSD多重比较在p< 0.05处无显著差异.图5 野蔷薇不同组织多胺含量
3 讨 论
多胺性质不稳定,易分解,直接测定难度较大且结果不准确[24].过去检测多胺的方法有氨基酸分析仪、纸电泳和荧光比色等, 但这些方法的样品回收率低、灵敏度不高[25].现在主要采用HPLC法检测植物内源多胺,该方法较为成熟、灵敏、迅速[23].该试验采用高效液相色谱(HPLC)法检测野蔷薇花瓣、花蕊、花苞、茎、叶,以及组织培养过程不同阶段(3 h,3 d,5 d,25 d callus)的内源多胺(腐胺、亚精胺、精胺)含量,15 min内3种多胺可完全分离,通过对标品的线性分析,相关系数均大于0.99,可用得到的回归方程计算样品中的多胺含量.通过多次方法和技术重复试验,得到样品多胺的HPLC色谱图及数据分析柱形图,样品出峰时间与标准品基本一致,峰型适宜,该方法能很好地测定野蔷薇组织内源多胺含量.在提取样品多胺时,取0.2 g样品材料、300 μL冰浴浸提液、苯甲酰氯衍生化反应37 ℃,多胺可被充分提取,经HPLC检测结果较好.由于苯甲酰多胺不宜长期保存,在-70 ℃时避光环境下贮存1周后, 亚精胺就会开始发生变化, 高于-70 ℃则3种多胺均会发生不同程度的分解, 在24 h 内,多胺衍生物不会发生明显分解[26],故须在提取后尽快检测,以免误差太大影响测定结果.通过预实验得知,苯甲酰衍生化反应的时间不宜过短,会造成反应不完全,苯甲酰氯残留,影响测定结果;也不宜过长,可能会使多胺分解,造成出现多个色谱峰的情况.提取多胺过程中,冰浴浸提和衍生化反应的温度、时间长短,对多胺含量测定有重要影响.程文翰等[21]的研究中,冰浴浸提3 h、37 ℃衍生化反应30 min,棉花组织多胺溶解量达到最大值;刘俊等[23]对苯甲酰衍生化反应温度及时间做了研究,发现 37 ℃反应20~25 min,峰面积最大且副反应少,室温(30 ℃左右)反应 30~40 min也可获得十分接近的结果,随着温度升高(< 37 ℃),Put的反应更加完全,而Spd与Spm的面积变化无显著差异.笔者所采用的方法为冰浴浸提1 h、37 ℃苯甲酰化反应25 min,峰面积较大.在12.2 min左右,检测样品出现一个色谱峰,峰面积较小,推测可能是热精胺(五胺),需要做质谱法进一步检测.目前提取多胺多采用10 mL体系,如程文翰等[21]取棉花组织培养物0.4 g,胡文等[20]取籼稻愈伤组织1 g,蒋学美等[25]取荔枝叶片2.0 g,对样品材料的用量较大.笔者参照程文翰等[21]的方法,并对提取体系做了优化,用2 mL体系即可提取出野蔷薇内源多胺,可减少样品及试剂的用量,简化操作.
在植物组织离体培养过程中,多胺能发挥诸多生理效应[27],如代谢、发育调控以及非生物胁迫反应[28].该研究表明:在野蔷薇花瓣、花蕊、花苞、茎、叶中,花蕊的多胺总含量及3种多胺含量均高于其他器官,暗示多胺可能与植物受精及性别分化有关.野蔷薇是雌雄同花植物,由于采集花蕊时,未将雌蕊与雄蕊分开,无法得知雌雄蕊多胺含量的规律.相较于野蔷薇器官,在野蔷薇的体胚发生过程中,内源多胺含量较高,不同培养阶段其含量变化较大,则多胺很可能参与了野蔷薇体细胞胚胎发生过程,在不同时期对体胚发生的作用不同.腐胺向下游产物亚精胺和精胺转化,使它们含量增加,说明在体细胞胚胎发生初期腐胺可能发挥着重要作用,腐胺向亚精胺和精胺的转化,可能有利于野蔷薇体细胞胚胎发生.在野蔷薇愈伤组织增殖阶段,精胺作用可能不显著,根据前人的研究结果[8-10],精胺可能会在体细胞胚胎发生后期胚状体及再生苗阶段发挥作用.目前对多胺在野蔷薇体内的代谢通路还未见报道,阐明多胺如何影响野蔷薇体细胞胚胎发生和多胺作用机制尚需探究.
