青萝卜游离小孢子培养体系优化
2022-03-12张胜雪范伟强王超楠张红黄志银李梅刘晓晖尹婧张斌
张胜雪 范伟强 王超楠 张红 黄志银 李梅 刘晓晖 尹婧 张斌







摘 要:以12份不同基因型青萝卜品种为供试材料,采用游离小孢子培养技术,研究基因型、培养基类型、激素浓度配比、4 ℃冷处理时间及32.5 ℃热激处理时间对青萝卜小孢子胚诱导的影响,为青萝卜高频胚诱导提供参考依据,从而完善青萝卜游离小孢子培养技术体系。结果显示,在相同培养条件下,只有SX1、SX8与SX11三份材料获得了胚状体,其余材料未获得胚状体,且不同供试材料间小孢子胚诱导率差异显著,表明基因型是决定青萝卜小孢子胚诱导成功的关键因素之一;利用1/2NLN-13型培养基配套指定激素配比(0.2 mg·L-1 6-BA+1 mg·L-1 NAA)培养时,材料SX1、SX8与SX11小孢子出胚率最高,基本确定了青萝卜小孢子培养的最适培养基类型及最佳激素浓度组合;此外,4 ℃冷处理1 d和32.5 ℃热激处理2 d,材料SX1与SX11小孢子出胚率最高,确定了小孢子胚诱导最佳冷处理和热激处理条件。
关键词:青萝卜;小孢子培养;胚状体;优化
中图分类号:S631.1 文献标志码:A 文章编号:1673-2871(2022)02-034-05
Optimization of isolated microspore culture system in green radish
ZHANG Shengxue1, FAN Weiqiang2, WANG Chaonan3, ZHANG Hong2, HUANG Zhiyin2, LI Mei3, LIU Xiaohui3, YIN Jing1, ZHANG Bin3
(1. College of Life Sciences, Tianjin Normal University, Tianjin 300387, China; 2. State Key Laboratory of Vegetable Germplasm Innovation/Tianjin Key Laboratory of Vegetable Genetics and Breeding Enterprises/Tianjin Kerun Vegetable Research Institute, Tianjin 300381, China; 3. Vegetable Research Institute, Tianjin Academy of Agricultural Sciences, Tianjin 300381, China)
Abstract: Twelve genotypes of Green Radish were tested for isolating microspore culture technology. The effects of genotype, medium type, growth regulator, 4 ℃ cold treatment and 32.5 ℃ heat shock treatment on the embryo induction from microspores were studied to improve isolated microspore culture technology system for green radish. The results showed that under the same culture conditions, only three materials SX1, SX8 and SX11 produced embryos, and the embryos induction rate from microspores was different among materials tested. Genotype is one of the key factors determining the success of embryo induction from green radish microspores; When 1/2 NLN-13 medium supplemented with 0.2 mg·L-1 6-BA+1 mg·L-1 NAA genotypes SX1, SX8 and SX11 produced highest number of embryos. In addition, of 4 ℃ cold treatment for 1 d and 32.5 ℃ heat shock treatment for 2 d SX1 and SX11 had the highest embryo rate from microspores. Our research generated an optimized protocol of generating embryos from isolated microspores of green radish.
Key words: Green radish; Microspore culture; Embryoid; Optimization
蘿卜(Raphanus sativus L.)为十字花科萝卜属二年或一生作物,在我国蔬菜作物中占据重要地位。2017年,我国萝卜播种面积达到130万hm2,占蔬菜总播种面积的5.6%,总产量达4.501×1010 kg,位居十字花科蔬菜种植面积的第二位[1]。青萝卜为萝卜中的绿皮萝卜类型,其皮薄肉细、色泽翠绿、口感脆嫩,深受大众喜爱。
萝卜的杂种优势非常明显,市面萝卜品种多以杂交种为主[2]。利用常规育种手段选育纯合、稳定的优质亲本需要进行5~7年的多代自交,费时费力,而且材料的多代自交也可能导致优良性状的衰退。游离小孢子培养是快速获得纯合材料的有效手段之一[3-4],利用小孢子培养可以快速获得单倍体,加倍后就可以获得纯合且遗传稳定的双单倍体(DH)植株,从而缩短育种年限,提高育种效率[5]。自从1982年Lichter[6]首次通过甘蓝型油菜(Brassica napus)培育出胚状体并建立再生植株体系以来,游离小孢子培养技术已广泛应用于白菜、甘蓝、菜心、油菜等多种十字花科蔬菜作物单倍体育种研究中[7-9]。在十字花科作物中,萝卜是最难成功培养出小孢子的作物之一[10]。Takahata等[11]对仅获得的58个萝卜胚状体进行再生植株培养,仅成活6株;张丽[12]对20份基因型不同的萝卜品种进行游离小孢子培养,仅1份品种形成胚状体。近年来,多位学者在萝卜小孢子培养方面做了大量的工作[13-14],但出胚率和植株再生率仍旧很低。
目前,还未有针对青萝卜小孢子培养的系统研究报道,笔者以12份基因型不同的青萝卜品种为供试材料,对青萝卜小孢子培养过程中的培养基类型、激素浓度配比、4 ℃冷处理时间及32.5 ℃热激时间进行研究,为青萝卜高频胚诱导提供参考依据,以期进一步完善青萝卜游离小孢子培养技术体系。
1 材料与方法
1.1 材料
笔者在本研究中选取12份市场主流并具备优良性状的青萝卜品种(材料)作为试材,其具体品种编号、名称与来源如下(表1)。供试材料于2020年12月上旬播种于天津科润农业科技股份有限公司蔬菜研究所武清试验基地,常规田间管理,2021年3月底至6月初取花蕾进行游离小孢子培养。
1.2 方法
1.2.1 游离小孢子培养 小孢子培养方法参考张丽等[13]的方法,进行改良。摘取无裂蕾的花序,4 ℃冷处理0、1、2、3 d;75%酒精处理35 s、10%次氯酸钠处理12 min、无菌水处理4 min 3次;B5培养基(含13%蔗糖);32.5℃热激处理0、1、2、3 d;转绿的胚状体接种至B5固体培养基内培养(16 h光/8 h暗、温度25 ℃、光照度2000 lx)。
1.2.2 单因素试验设计 以基因型、激素类型及浓度配比、4℃冷处理时间和32.5℃热激处理时间5个因素,利用单因素控制变量法设计单因素试验,试验设计情况如表2。
1.3 数据处理及分析
利用Excel 2019軟件对试验数据进行统计分析,利用SPSS 22.0软件进行单因素ANOVA方差分析,利用邓肯氏新复极差法进行差异性显著分析。
2 结果与分析
2.1 基因型对青萝卜小孢子胚诱导的影响
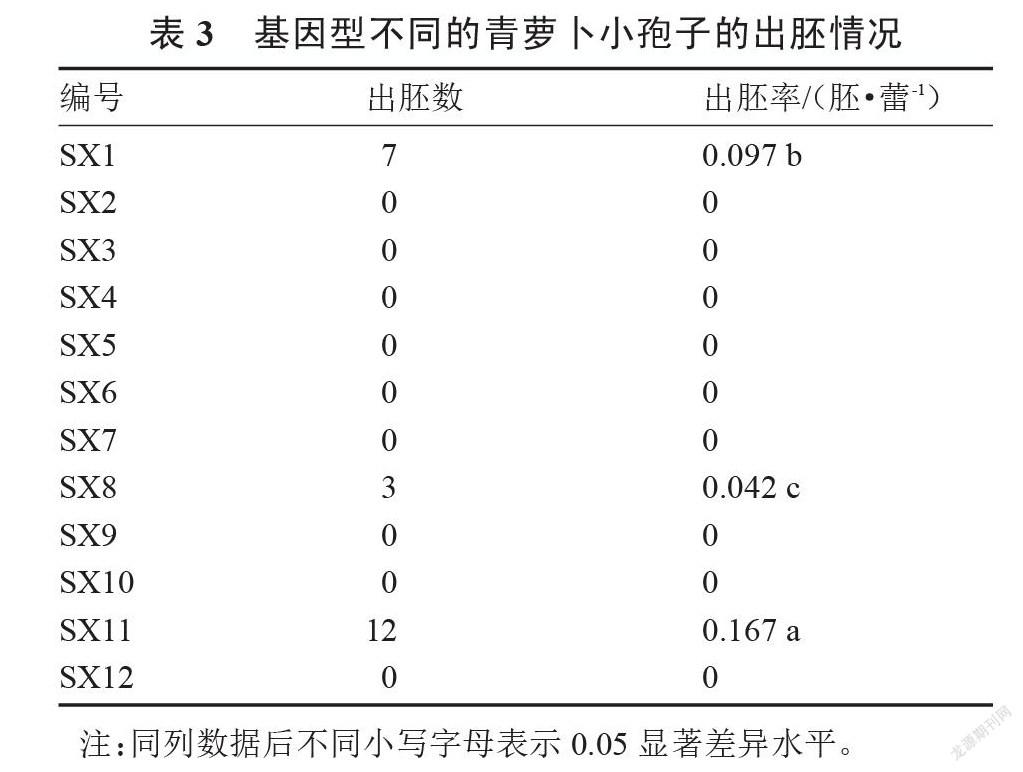
选取的青萝卜品种代表12种不同基因型,以1/2 NLN-13培养基培养,供试材料出胚情况如表3。
由表3可以看出,用相同的培养条件对12份不同基因型的青萝卜小孢子进行培养,其中只有SX1、SX8与SX11三份材料获得了胚状体,SX2、SX3、SX4、SX5、SX6、SX7、SX9、SX10与SX12未获得胚状体,其中SX11获得胚状体最多,出胚率最高,可达0.167胚·蕾-1;而SX8获得胚状体最少,出胚率仅为0.042胚·蕾-1。因此可见,不同基因型的青萝卜材料间小孢子胚诱导率差异较大,且在完全相同的培养条件下,不同材料的小孢子胚诱导发生能力受基因型影响较大。
2.2 培养基类型及激素浓度配比对青萝卜小孢子胚诱导的影响
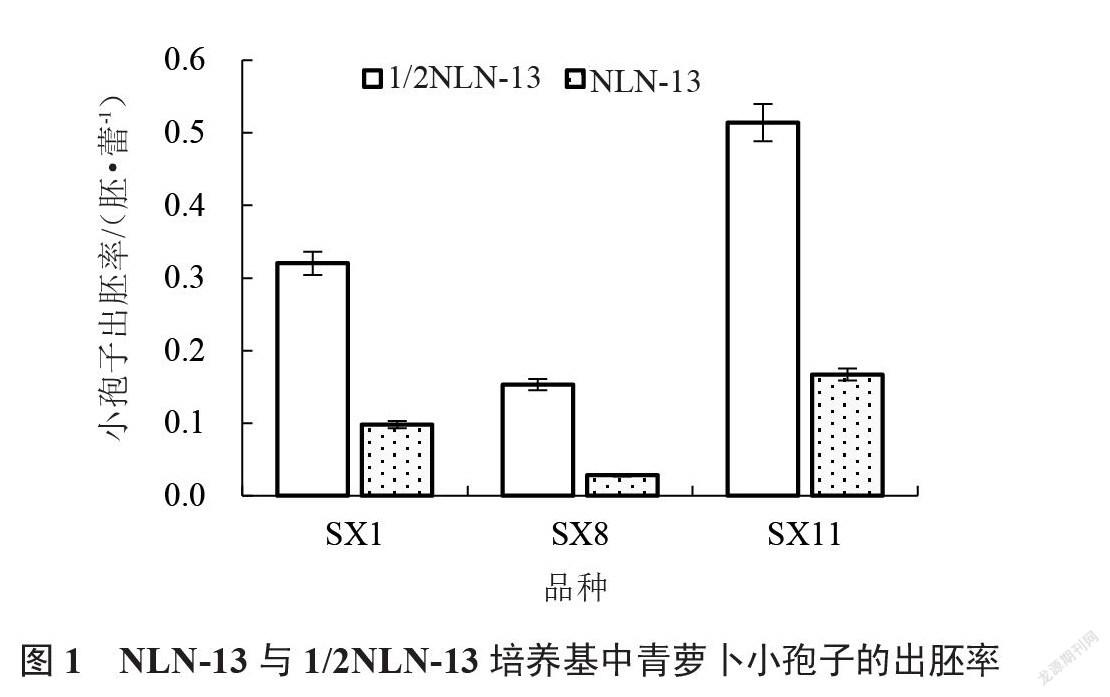
由图1可以看出,激素浓度配比相同时,以1/2 NLN-13培养基培养时,SX1、SX8与SX11三份材料小孢子的出胚率较高,说明1/2 NLN-13培养基为供试青萝卜小孢子培养的最适培养基类型。由表4~5可以看出,与对照组1相比,加入适量的6-BA和NAA有利于青萝卜小孢子胚诱导的发生,且6-BA和NAA的浓度不同对小孢子胚诱导发生能力的影响不同。其中配比7条件下SX1、SX8与SX11三份材料小孢子的出胚率最高,在1/2 NLN-13培养基中分别为0.181、0.083、0.222胚·蕾-1;在NLN-13培养基中分别为0.056、0.014、0.069胚·蕾-1。因此说明,0.2 mg·L-1 6-BA+1.0 mg·L-1 NAA为供试青萝卜小孢子培养的最适激素质量浓度组合。
2.3 冷处理时间对青萝卜小孢子胚诱导的影响
由图2可以看出,4 ℃冷处理后材料SX1与SX11小孢子出胚率均有明显的提高,且冷处理1 d时,两份青萝卜材料的小孢子出胚率最高,分别为0.306胚.蕾-1和0.347胚.蕾-1;随着冷处理时间的增加,材料SX1与SX11小孢子出胚率逐渐下降,尤其冷处理3 d时,小孢子出胚率已经接近0 d。因此,4 ℃冷处理对供试青萝卜小孢子胚诱导的发生有显著影响,且不同冷处理间小孢子出胚率差异显著,其中最佳冷处理时间为1 d。
2.4 热激处理时间对青萝卜小孢子胚诱导的影响
由图3可以看出,32.5 ℃热激处理后,材料SX1与SX11小孢子出胚率均有明显的提高,且热激处理2 d时,两份青萝卜材料的小孢子出胚率最高,分别为0.278胚·蕾-1和0.347胚·蕾-1;热激处理3 d时,小孢子出胚率明显下降,说明热激时间延长不利于小孢子出胚。因此可见,32.5 ℃热激处理对供试青萝卜小孢子胚诱导的发生有显著影响,且不同热激处理间小孢子出胚率差异显著,其中最佳热激处理时间为2 d。
2.5 青萝卜小孢子胚状体培养及植株再生的过程
小孢子经过离体培养发育成胚状体(图4-A)一般需要15~26 d。胚状体接种到分化培养基(B5固体培养基+2%蔗糖+0.8%琼脂+0.2 mg·L-1 6-BA)上,置于光照培养室(16 h光/8 h暗、温度25 ℃、光照度2000 lx)培养。其中子叶胚(图4-B)1周后逐渐转绿(图4-C),经过3~5周继代培养后分化成苗(图4-D);球形胚接种后不会转绿,逐渐发生褐化死亡(图4-E)。获得的苗接种至生根培养基(MS固体培养基+2 %蔗糖+0.1 g·L-1活性炭+0.8 %琼脂+0.2 mg·L-1 NAA)培养1~2周后逐渐生根(图4-F)。
3 讨论与结论
萝卜成功获得小孢子培养非常困难,基因型是制约其成胚的关键。笔者在本试验中以相同的培养条件对12份基因型不同的青萝卜小孢子进行培养,只有3份成功诱导出胚,且不同基因型的青萝卜材料间小孢子胚诱导率差异较大,表明基因型是决定青萝卜品种小孢子胚诱导成功的关键因素之一,这一结果与王春丽等[15]研究结果相一致,在白菜[16]、菜心[17]等十字花科作物中也有此结论。张凤兰等[18]研究表明,在甘蓝型油菜小孢子培养中,高胚发生能力受显性核基因控制,与胞质无关。因此可以利用杂交手段,将胚发生能力高的品种与胚发生能力低的品种进行杂交,扩大后代基因型范围,提高胚发生能力低的品种的胚诱导率[19]。
NLN和1/2NLN培养基是十字花科作物小孢子培养常用的培养基类型。陈文辉等[20]研究了培养基类型对萝卜小孢子出胚率的影响,结果发现仅1/2 NLN培养基可以诱导萝卜小孢子产生胚状体;赵艳玲[21]研究发现NLN与1/2 NLN培养基均可诱导萝卜小孢子产生胚状体。本试验中,在培养基内物质含量完全相同下,1/2 NLN培养基培养时,SX1、SX8与SX11小孢子出胚率较高,说明1/2 NLN培养基更有利于提高萝卜胚状体的诱导率,这个结果与王超楠等[22]研究结果相一致。
目前,激素对不同作物小孢子胚诱导的影响尚未得到一致结果。王康[23]认为培养基内加入0.05 mg·L-1 6-BA对萝卜小孢子胚诱导有促进作用;李丹[2]对萝卜小孢子胚诱导体系进行优化,培养基内最佳激素组合是0.1 mg·L-1 6-BA+1.0 mg·L-1 NAA;施柳等[24]认为培养基内加入0.3 mg·L-1 6-BA有利于白菜小孢子胚诱导的发生。本试验中,在培养基内添加0.2 mg·L-1 6-BA和1.0 mg·L-1 NAA可以显著提高SX1、SX8与SX11小孢子的出胚率。
冷处理和热激处理可以改变小孢子的分裂方式和发育途径,使第2次有丝分裂进行对称分裂,从而促进小孢子由配子体途径向孢子体途径发展,利于产生胚状体[25]。付传翠等[26]认为4 ℃冷处理3 d,萝卜小孢子出胚率最高,延长冷处理时间,出胚率逐渐下降;唐兵等[27]认为4 ℃低温预处理l d、33 ℃高温热激2 d有利于白菜小孢子胚的形成。本试验结果表明,4 ℃冷处理1 d和32.5 ℃热激处理2 d可以提高青萝卜小孢子胚诱导的发生能力,但其出胚率与材料基因型及处理时间密切相关,这与李丹[2]的研究结果一致。
综上所述,笔者通过对青萝卜游离小孢子培养体系的优化,发现除了基因型是决定青萝卜小孢子培养的关键因素外,培养基类型、培养基成分以及温度胁迫处理等同样是影响青萝卜小孢子培养的重要因素,本研究的结果可以进一步为青萝卜小孢子培养提供可靠的参考依据和试验基础。
参考文献
[1] 崔志超,杨雅婷,刘先才,等.我国萝卜机械化生产现状及发展建议[J].中国蔬菜,2020(8):1-8.
[2] 陈宝刚,鲁建斌,梁玉芹.萝卜育种研究进展[J].河北农业科学,2012,16(1):65-68.
[3] 李丹.萝卜游离小孢子培养技术研究[D].北京:中国农业科学院,2008.
[4] 李晓梅,冉茂林,杨峰.萝卜游离小孢子成胚诱导影响因素研究进展[J].长江蔬菜,2016(14):41-44.
[5] 庞强强,周曼,蔡兴来,等.菜心小孢子胚再生体系优化及植株倍性鉴定[J].分子植物育种,2021,19(14):4745-4751.
[6] LICHER R.Efficient yield of embryoids by culture of isolated microspores of different Brassicaceae species[J].Plant Breeding, 1989,103:119-123.
[7] CORRAL-MARTÍNEZ P,CAMACHO-FERNÁNDEZ C,SEGUÍ-SIMARRO J M.Isolated microspore culture in Brassica napus[M]. New York:Humana,Methods in Molecular Biology ,2020:269-282.
[8] DONG Y Q,GAO Y H,ZHAO T,et al.Influencing factors and physiochemical changes of embryogenesis through in vitro isolated microspore culture in Brassica species[J].Biologia,2021,76(9):2629-2654.
[9] DARIA S,DMITRY K,ELENA D,et al.Effects of genotype and culture conditions on microspore embryogenesis and plant regeneration in Brassica rapa ssp.rapa L.[J].Plants,2020,9(2):278.
[10] 張丽,王庆彪,郑鹏婧,等.萝卜小孢子培养再生植株及其性状表现[J].西北农业学报,2016,25(9):1386-1391.
[11] TAKAHATA Y,KOMATSU H,KAIZUMA N.Microspore culture of radish (Raphanus sativus L.): influence of genotype and culture conditions on embryogenesis[J].Plant Cell Reports,1996,16(3/4):163-166.
[12] 张丽.萝卜游离小孢子培养技术初探[J].园艺学报,2004,31(5):676-678.
[13] 张丽,王庆彪,王艳萍.利用离体小孢子培养技术培育心里美萝卜新品系[J].中国蔬菜,2020(8):53-56.
[14] KOZAR E,DOMBLIDES E.Protocol of european radish(Raphanus sativus L.)microspore culture for doubled haploid plant production[M]// SEGUI-SIMARRO J M. Doubled haploid technology. New York:Humana Press,2021:217-232.
[15] 王春丽,姚延兴,彭玲.萝卜游离小孢子培养及胚再生植株研究[J].安徽农业科学,2013,41(27):10919-10922.
[16] 陈丽潇,王跃华,刘鑫,等.抗根肿病大白菜小孢子培养及分子鉴定[J].江苏农业科学,2019,47(10):141-143.
[17] 赵艳艳,牛刘静,原玉香,等.菜心小孢子培养体系优化[J].中国瓜菜,2020,33(7):34-38.
[18] 张凤兰,高田义人.甘蓝型油菜小孢子培养胚发生能力的遗传分析[J].华北农学报,2001,6(1):27-32.
[19] 魏云晓,李菲,张淑江,等.菜薹(菜心)-芥蓝杂交亲和性分析及后代性状表现[J].中国蔬菜,2017(11):21-27.
[20] 陈文辉,方淑桂,曾小玲,等.萝卜游离小孢子培养研究初报[J].福建农业学报,2006,21(4):338-341.
[21] 赵艳玲.萝卜小孢子培养与核型分析[D].南京:南京农业大学,2008.
[22] 王超楠,冯辉,姜凤英,等.小白菜小孢子胚狀体诱导影响因素研究[J].华北农学报,2007,22(S1):204-206.
[23] 王康.萝卜游离小孢子培养与同源四倍体创制研究[D].南京:南京农业大学,2011.
[24] 施柳,王雅琼,李云龙,等.不同基因型大白菜小孢子胚状体诱导及植株再生[J].北方园艺,2014(6):101-104.
[25] ZORINIANTS S,TASHPULATOV A S,HEBERLE-BORS E,et al.The role of stress in the induction of haploid microspore embryogenesis[M]//PALMER C E,KELLER W A,KASHA K J, eds.Biotechnology in agriculture and foresry 56 in haploids in crop improvement Ⅱ. Springer, 2005:35-52.
[26] 付传翠,张丽,宫国义,等.不同预处理方式对萝卜小孢子活力的影响 [J].华北农学报,2006,21(6):45-48.
[27] 唐兵,陶莲,卢松,等.白菜游离小孢子培养高频胚诱导技术体系优化[J].热带作物学报,2017,38(10):1913-1920.
