转基因大豆MON87751品系特异性实时荧光定量PCR检测方法建立
2022-03-11刘二龙郑冠津王毅谦李志勇魏霜关丽军卢丽蒋湘刘金华王振华
刘二龙 郑冠津 王毅谦 李志勇 魏霜 关丽军 卢丽 蒋湘 刘金华 王振华





摘要 [目的]为完善我国转基因检测方法体系,建立转基因大豆MON87751品系特异性实时荧光聚合酶链式反应(real time polymerase chain reaction,PCR)检测方法。[方法]根据MON87751的3′端邻接区序列设计特异性引物和探针,建立MON87751品系特异性实时荧光PCR检测方法,并测定该方法的灵敏度、特異性及可重复性。[结果]灵敏度测试显示,其定量下限为40拷贝;重复性试验显示其相对标准偏差在可接受范围内。[结论]该研究建立的MON87751品系特异性实时荧光PCR检测方法特异性良好,灵敏度高,有良好的可重复性,适合对转基因大豆MON87751品系进行检测鉴定。
关键词 实时荧光PCR;转基因大豆MON87751;品系特异性
中图分类号 S 565.1文献标识码 A
文章编号 0517-6611(2022)04-0102-04
doi:10.3969/j.issn.0517-6611.2022.04.027
开放科学(资源服务)标识码(OSID):
Establishing an Event-specific Real-time Polymerase Chain Reaction Detection Method for Genetically Modified Soybean Event MON87751
LIU Er-long1,ZHENG Guan-jin1,WANG Yi-qian2 et al (1.Huangpu Customs Technology Center,Guangzhou,Guangdong 510730;2.Animal Plant and Food Inspection Center of Nanjing Customs,Nanjing,Jiangsu 210019)
Abstract [Objective]In order to improve the genetically modified detection method system in China,a real-time polymerase chain reaction (PCR) detection method specific to the genetically modified soybean MON87751 was established.[Method]The specific primer pairs and probe based on the sequence of the 3' adjacent region of MON87751 were designed and then the real-time PCR detection method was established.The specificity,sensitivity and repeatability were analyzed.[Result]The real-time PCR method was specific for detecting MON87751.The limit of quantification (LOQ) was 40 copies MON87751 genomic DNA.Repeatability of the established event-specific real-time PCR method was assessed and the relative standard deviation (RSD) was within the acceptable range.[Conclusion]The established event-specific quantitative real-time PCR method of MON87751 has good specificity,high sensitivity and good reproducibility,and is suitable for the identification of soybean MON87751.
Key words Quantitative real-time PCR;Genetically modified soybean MON87751;Event-specificity
基金项目 广东省科技计划项目(2017B020207008);广州市科技计划项目(201704030125);国家重点研发计划(2018YFF0215605);南京海关科技计划项目(2021KJ18)。
作者简介 刘二龙(1978—),男,湖南郴州人,高级兽医师,硕士,从事动植物分子鉴定研究。*通信作者,博士,从事食品安全快速检测技术研究。
收稿日期 2021-04-06;修回日期 2021-05-24
大豆是一种富含蛋白与脂肪的粮食及油料作物。我国是世界大豆第一消费国和进口国,国产大豆难以满足国内市场消费需求,故而大豆贸易逆差大,2019年大豆进口量为8 851万t[1]。
转基因大豆MON87751由孟山都公司研发,其含有稳定整合的cry1A.105和cry2Ab2表达盒[2],主要产生Cry1A.105和Cry2Ab2两种针对鳞翅目害虫的杀虫蛋白。MON87751于2014年在美国上市,目前在欧盟、澳大利亚、新西兰、加拿大、日本、韩国、中国台湾和美国等国家或地区获得批准允许用作食品、饲料或种植。为完善我国转基因产品检测技术体系,为转基因产品的监管提供强有力的技术支持,笔者采用实时荧光PCR技术平台,根据MON87751 3′端邻接区序列设计引物、探针,建立了MON87751品系特异性检测方法,以期为实现高通量的检测提供科学依据。
1 材料与方法
1.1 材料和试剂
转基因油菜MON88302、转基因棉花MON88913、转基因油菜DP-073496-4、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因甜菜H7-1、转基因玉米MON810、转基因玉米NK603、转基因玉米BT11、转基因玉米MIR162、非转基因大豆為黄埔海关技术中心购置及保存;大豆内源基因植物凝集素基因(Lectin基因)和MON87751品系特异性外源基因双基因阳性质粒为黄埔海关技术中心构建。
主要试剂:Primex Ex Taq(2×) for qPCR(TAKARA);引物和探针工作液的终浓度为10 μmol/L(上海闪晶生物);DNA提取试剂盒DP-305(北京天根)。
主要设备:实时荧光PCR仪ABI7500fast、ABI7500(美国应用生物系统公司);研磨机Tube Mill 100 control(德国IKA);微量分光光度计 nanodrop2000c(美国Thermo公司)。
1.2 方法
1.2.1 DNA的提取。称取100 mg研磨成粉末状的样品提取样品中的基因组DNA,测定DNA浓度并于4℃保存备用。
1.2.2 引物组和探针设计。根据转基因大豆MON87751品系3′端邻接区序列(品系特异性片段),应用Primer Primer 5.0 软件设计引物和探针。选用内源基因Lectin用于样本核酸提取质量监测及定量分析。
1.2.3 实时荧光PCR反应体系退火温度及引物探针配比的优化。采用TAKARA RR390酶系对不同体积的引物探针进行优化(25 μL体系)。A组:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.5 μL,10 μmol/L探针MON87751-P 1.0 μL,模板2.0 μL和ddH2O 8.3 μL。 B组:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.4 μL,10 μmol/L探针MON87751-P 0.8 μL,模板2.0 μL和ddH2O 8.7 μL。C组:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.2 μL,10 μmol/L探针MON87751-P 0.4 μL,模板2.0 μL和ddH2O 9.5 μL。
退火延伸温度分别设置为60和58 ℃,反应程序为95 ℃ 30 s;95 ℃ 5 s、60 ℃(58 ℃) 34 s,40个循环,于60 ℃(58 ℃)收集荧光信号。
1.2.4 特异性测试。用“1.2.1”的方法提取“1.1”中样品DNA为模板,阳性对照为Lectin-MON87751质粒,阴性对照为非转基因大米DNA,进行特异性测试。
1.2.5 灵敏度测试。
将提取的Lectin-MON87751DNATE缓冲液稀释至4 000000、400000、40000、4000、400、40和20拷贝/μL进行转基因大豆MON87751实时荧光PCR检测,进行灵敏度测试。
1.2.6 可重复性测试及建立标准曲线。
将提取的Lectin-MON87751质粒DNA溶液加入TE缓冲液稀释至4 000 000、400 000、40 000、4 000、400、40和20拷贝/μL,每个样品进行3次重复试验,进行实时荧光PCR检测线性范围测试及可重复性测试。
2 结果与分析
2.1 方法的建立及优化
2.1.1 实时荧光PCR引物和探针设计。
通过分析转基因大豆MON87751 3′端邻接区序列设计的多组引物和探针,分析引物与探针的反应效率、扩增效果,最终选择表1中的引物和探针建立MON87751品系特异性检测方法。
2.1.2 PCR反应体系优化。
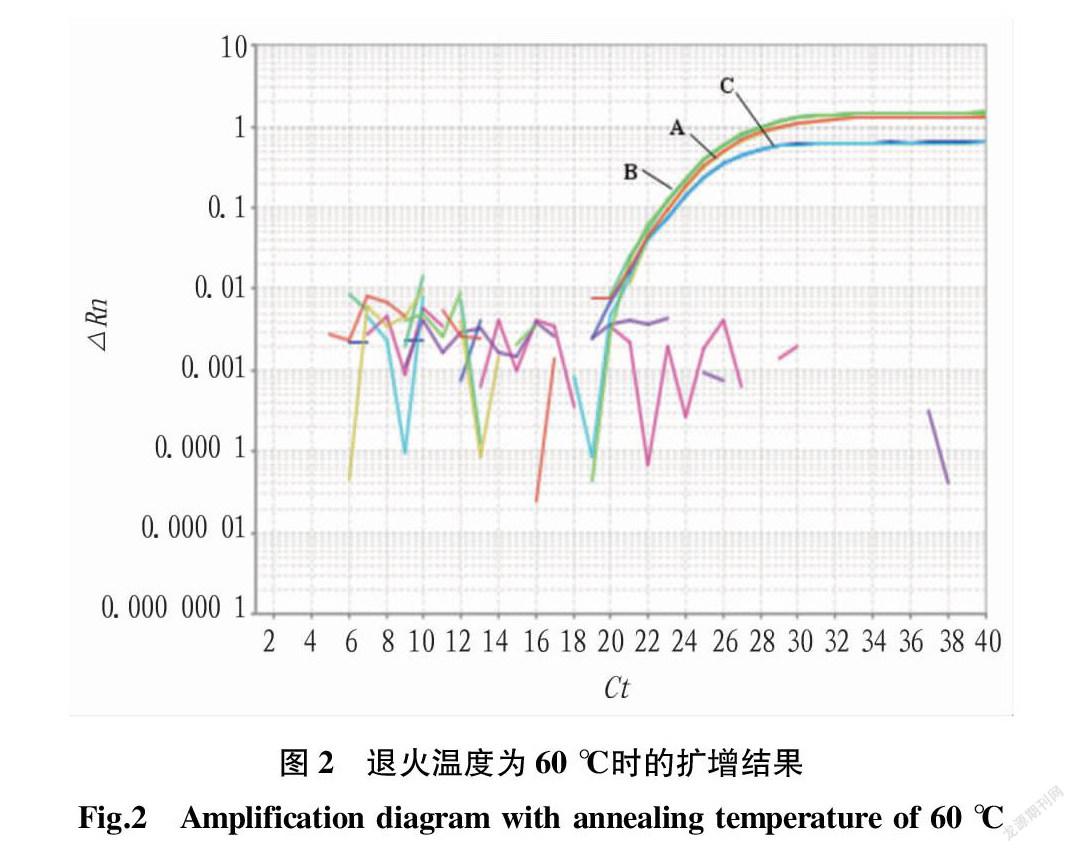
在扩增体系的退火温度为58 ℃时,3组引物探针组B、A和C的扩增曲线均扩增良好,其中Ct值最小为B组(图1);温度为60 ℃时,B、A和C 3组均扩增良好,A和B组Ct值接近,C组Ct稍高,但3组引物探针Ct值较退火温度为58 ℃时Ct值高(图2)。因此,基于扩增效率和经济性,考虑选择B组体积配比、58 ℃作为退火温度引物探针配比。
2.2 特异性测试 由图3可知,采用MON87751品系特异性MON87751-F/R/P引物和探针进行实时荧光PCR时,其他农作物材料DNA为模板的反应均无典型荧光扩增曲线,只有阳性样品MON87751的DNA模板有典型荧光扩增曲线,表明该研究的检测方法特异性良好。
2.3 灵敏度测试、可重复性测试及标准曲线建立
按“1.2.5”进行7个浓度梯度扩增,其最低检测浓度为20拷贝/μL。扩增曲线见图4。
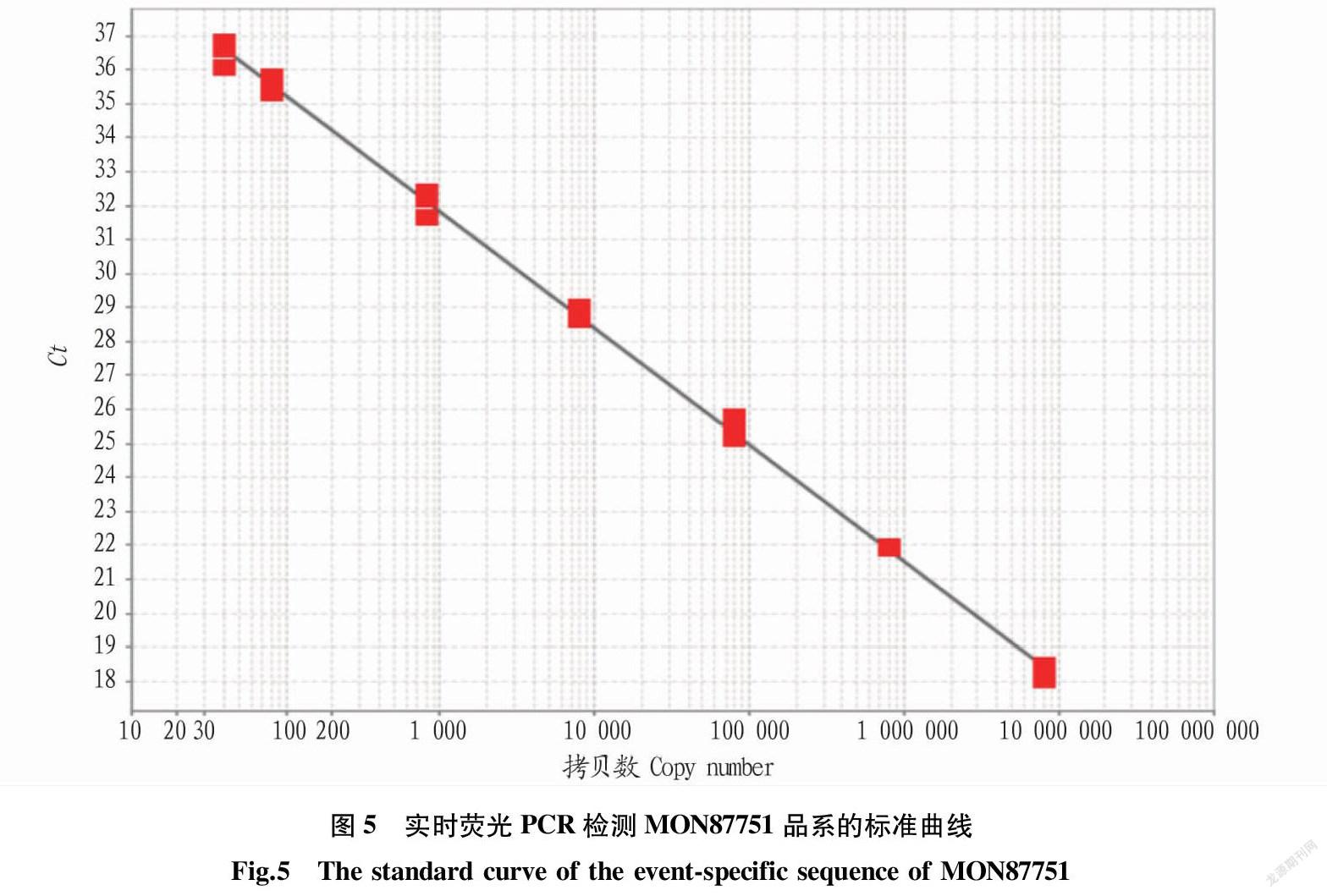
2.4 标准曲线制备 按“1.2.6”进行转基因大豆MON87751品系实时荧光PCR检测,测试结果的Ct值见表2。根据表2中Ct值数据与拷贝数对数值建立线性回归方程为y=-3.43x+42.12,扩增效率95.55%(90%~110%),R2为0.99,表明该方法的线性相关性良好,扩增效率满足定量检测标准的要求(图5),且在线性范围内,Ct值的SD为0.04~0.39,RSD为0.20%~1.27%(表2)。最低模板量40拷贝时,其RSD远小于25%,设定该方法的定量限为40拷贝。
3 讨论
目前对转基因产品多数国家均采用相应的标识管理制度,转基因产品标识需要检测方法的支撑。欧盟转基因食品和饲料基准实验室有建立MON87751 5′边界序列的PCR检测方法[4],但国内尚缺乏该检测方法及相关标准。实时荧光定量PCR技术在转基因检测中应用广泛,被誉为“金标准”,其可监测PCR进程中探针发光基团的信号,从而实现定性或定量分析[5-7] 。
品系特异性PCR(Event-specific PCR)检测方法检测的目标序列是外源基因与植物基因组间边界序列,甚至可以区分相同质粒转化的转基因品系[8],品系特异性检测方法报道较早见于Bt11品系检测方法的建立[9],目前在转基因品系鉴定中应用广泛[10-15]。
该研究针对转基因大豆MON87751 3′端边界特异性序列,基于实时荧光PCR平台,设计引物和探针建立MON87751品系特异性检测方法,定量下限为40拷贝,扩增效率为95.55%,重复性测试显示,各平行间样品所得Ct的RSD均远小于25%,表明该方法特异性良好,灵敏度较高,具有良好的稳定性,可为相关部门鉴定检测转基因大豆MON87751提供方便快捷的方法。
参考文献
[1]
王红蕾.浅谈中国2020年度大豆行业市场状况与区域竞争格局[J].山西农经,2021(4):104-105.
[2]ISAAA GM Approval DatabaseGM Crop Events ListMON87751 [EB/OL].(2013-01-12) [2020-03-31].https://www.isaaa.org/ gmapprovaldatabase/event/default.asp?EventID=370.
[3] SAVINI C,MARETTI M,MAZZARA M,et al.Event-specific method for the quantification of soybean MON 87705 using real-time PCR validation report[R].2012.
[4] European Union Reference Laboratory for GM Food and Feed(EURL GMFF),Joint Research Centre(JRC),European Commission.Event-specific Method for the Quantification of Soybean MON 87751 Using Real-time PCR-Validation Report and Validated Method[R].2016.
[5]MARMIROLI N,MAESTRI E,GULL M,et al.Methods for detection of GMOs in food and feed[J].Anal Bioanal Chem,2008,392(3):369-384.
[6]COTTENET G,BLANCPAIN C,SONNARD V,et al.Development and validation of a multiplex real-time PCR method to simultaneously detect 47 targets for the identification of genetically modified organisms[J].Anal Bioanal Chem,2013,405(21):6831-6844.
[7]ANKLAM E,GADANI F,HEINZE P,et al.Analytical methods for detection and determination of genetically modified organisms in agricultural crops and plant-derived food products[J].Eur Food Res Technol,2002,214(1):3-26.
[8] WU G,WU Y H,XIAO L,et al.Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J].Food Chem,2009,112(1):232-238.
[9]ZIMMERMANN A,LTHY J,PAULI U.Event specific transgene detection in Bt11 corn by quantitative PCR at the integration site[J].LWT Food Sci Technol,2000,33(3):210-216.
[10] 雷水娟,劉二龙,卢丽,等.转基因棉花MON88701品系特异性实时荧光PCR检测方法的建立[J].生物安全学报,2019,28(3):225-229.
[11] 袁俊杰,魏霜,龙阳,等.转基因大豆MON87701和MON87708双重实时荧光PCR检测技术的建立与应用[J].农业生物技术学报,2020,28(2):342-348.
[12] 鲁军,李刚,赵建宁,等.5种转基因油菜转化体特异性多重PCR检测方法[J].生物安全学报,2017,26(3):244-250.
[13] 刘二龙,卢丽,吕英姿,等.转基因苜蓿草J163品系特异性实时荧光PCR检测方法的建立[J].食品安全质量检测学报,2015,6(1):272-278.
[14] 刘二龙,卢丽,吕英姿,等.转基因甜菜GTSB77品系特异性实时荧光聚合酶链式反应检测方法建立[J].中国食品卫生杂志,2020,32(1):49-52.
[15] 汪秀秀,杨捷琳,宋青,等.转基因棉花GHB119品系特异性定量PCR检测方法的建立[J].农业生物技术学报,2014,22(3):380-388.
3523500338244
