耐低温降解玉米秸秆复合菌剂的构建及其降解效果评价
2022-03-11陈世珩吕兆丰王道武王楠肖丹
陈世珩 吕兆丰 王道武 王楠 肖丹








摘要 为解决严寒地区低温条件下农业废弃物自然处理效率下降的问题,从长白山典型静水水底污泥筛选优势低温降解纤维素菌并进行26S rRNA PCR测定菌种,明确其分类地位。通过全組合构建菌株多样性为1~5的复合菌系,分别检测复合菌系的秸秆相对降解率及其滤纸酶、纤维素内切酶和木聚糖酶活性,利用方差分析和相关性分析等方法研究菌株多样性和组成对复合菌系玉米秸秆降解效果及其纤维素酶活性的影响。结果表明,筛选得到5株可在15 ℃时纤维素水解能力强且可降解玉米秸秆的菌株。经26S rRNA序列鉴定和系统发育分析,5株降解菌分别为链霉菌(Streptomyces)、棘孢木霉(T.asperellum)、钩状木霉(T.asperellum)、曲霉(Aspergillus)和青霉(Penicillium),与NCBI数据库的序列相似度均超过99.95%。抽样效应分析发现,不同菌株对复合菌系的秸秆降解效果、滤纸酶和纤维素内切酶活性的影响不同。全组合复配结果表明,以编号为AX1、AX3和AM4的组合对玉米秸秆降解效果最佳、酶活性最高,复合菌系的秸秆降解能力和纤维素酶活力均高于单一菌株,且随着菌株多样性水平的增加而提高。试验表明该复合菌剂可以在15 ℃下有效降解纤维素类物质,提高玉米秸秆的降解效率效果。
关键词 玉米秸秆;低温降解;复合菌剂;构建;降解效果
中图分类号 X 172文献标识码 A文章编号 0517-6611(2022)04-0064-05
doi:10.3969/j.issn.0517-6611.2022.04.018
开放科学(资源服务)标识码(OSID):
Construction of Complex Microbial Agent Resistant to Low Temperature Degradation of Corn Stalk and Evaluation of Its Degradation Effect
CHEN Shi-heng,L Zhao-feng,WANG Dao-wu et al
(College of Chemical Engineering, Changchun University of Technology,Changchun,Jilin 130000)
Abstract In order to solve the problem of the decline in the efficiency of natural treatment of agricultural waste under low temperature conditions in severe cold areas, the dominant low-temperature degrading cellulose bacteria were screened from the typical still water bottom sludge of Changbai Mountain, and 26S rRNA PCR was performed to determine the bacterial species to clarify its classification status.The compound strain with a strain diversity of 1 to 5 was constructed through the entire combination,the relative degradation rate of the straw of the composite strain and its filter paper enzyme, endocellulose and xylanase activities were detected respectively,the effect of strain diversity and composition on the degradation effect of composite strains of corn stalk and its cellulase activity were studied by methods such as variance analysis and correlation analysis.The results showed that 5 strains that could hydrolyze cellulose at 15 ℃ and could degrade corn stover were selected.After 26S rRNA sequence identification and phylogenetic analysis, the 5 strains of degrading bacteria were Streptomyces, T. asperellum, T. asperellum, Aspergillus and Penicillium, the sequence similarity with NCBI database was more than 99.95%.Sampling effect analysis showed that different strains had different effects on straw degradation, filter paper enzyme and cellulose endonuclease activities. The results of the full-combination combination showed that the combination numbered AX1, AX3 and AM4 had the best degradation effect on corn stalks and the highest enzyme activity.The straw degradation ability and cellulase activity of the composite strain were higher than that of a single strain, and it increased with the increase of strain diversity.The experiment showed that the composite microbial agent could effectively degrade lignocellulose at 15 ℃, and improve the degradation efficiency of corn stalks.
Key words Corn stalk;Low temperature degradation;Complex microbial agent;Construction;Degradation effect
作者简介 陈世珩(1996—),男,湖北恩施人,硕士研究生,研究方向:废弃物生物降解。*通信作者,讲师,博士,从事废弃物生物降解研究。
收稿日期 2021-05-07;修回日期 2021-07-02
吉林省是我国的农业大省,农作物秸秆资源丰富,是尚未得到充分利用的可再生资源。秸秆中含有丰富的纤维素、半纤维素、木质素等物质,在自然状态下降解率不高,降低了秸秆的再利用水平[1]。尤其是吉林省因处高寒地区气候原因,在农作物秸秆应用方面受到极大限制[2],如简单的秸秆堆肥技术因秋季温度过低而限制降解[3]。获得具有高效降解能力的低温微生物,是打破高寒地区低温气候条件制约农作物秸秆资源化利用的有效路径,具有一定的实际意义[4]。
秸秆中纤维素类物质的降解过程需要多种降解微生物和多种酶的参与[5]。因此,复合菌系具有更丰富的纤维素酶系,可通过菌株间相互协同,使其降解效果优于单一菌株[6]。如张晨敏[7]从玉米秸秆还田土壤中筛选和组成对玉米秸秆具有较高降解效果的复合菌系,其降解效果显著优于单一菌株。然而也有研究发现,菌株种类和数量过高不仅不会促进降解,反而有抑制作用。因此如何构建效果好、稳定性强的复合菌系是提高其在秸秆降解中应用的重要手段[8]。该研究从长白山天然低温静水水体污泥中通过连代培养和分离纯化筛选出5株低温(15 ℃)优势纤维素降解菌,全组合构建菌株丰富度为1~5的复合菌系,探究不同丰富度下玉米秸秆的降解率和酶活性,实现低温区玉米秸秆快速降解回馈农田的目标,对低温环境下农作物秸秆加速降解有重要的应用意义[9]。
1 材料与方法
1.1 试验材料
玉米秸秆,由长春市某农户提供。污泥,取自长白山静水水体的污泥(128.0°E、41.9°N,海拔2 467 m,年平均气温-2 ℃);污泥经吉林省农业科学院试验检测,有机质含量高达500 g/kg,总氮含量高达7.7 g/kg;污泥中的重金属(汞、铬、铅、镉、砷)含量亦达到了《农用污泥中污染物控制标准》(GB 4284—84)的要求[10]。基因组DNA提取试剂盒(天根生化科技有限公司)。
细菌培养基:牛肉膏5 g、蛋白胨10 g、氯化钠5 g、去离子水1 000 mL,pH 7.2,121 ℃灭菌20 min[11]。
刚果红-羧甲基纤维素钠固体培养基:K2HPO4 0.5 g、MgSO4 0.25 g、纤维素粉1.88 g、刚果红0.20 g、琼脂20 g。将上述各成分混合溶解,加蒸馏水至800 mL,调整pH为7.0,补充到1 000 mL,高压灭菌(121 ℃,15 min)[10]。温度降至40 ℃时,无菌操作台制作平板。
霉菌培养基:CMC 5.0 g、蛋白胨3.0 g、KH2PO4 4.0 g、Mg2SO4·7H2O 0.03 g、H2O 1 000 mL,pH 5.5~6.0[12]。
放线菌培养基:蛋白胨3.0 g、酵母膏0.5 g、KNO3 0.2 g、KH2PO4 4.0 g、MgSO4·7H2O 0.5 g、微晶纤维素10.0 g、H2O 1 000 mL,pH 7.0~7.2。
1.2 试验方法
1.2.1 试验秸秆预处理。农作物玉米秸秆在吉林省农业科学院玉米基地采集玉米秸秆晾干,用小型粉碎机分别将秸秆粉碎为不同的粒径,经1.5%的NaOH浸泡预处理48 h后,用PBS反复洗净至pH中性,在自然状态下烘干。
1.2.2
低温降解玉米秸秆菌株的筛选。取10 g长白山污泥样品至装有200 mL无菌水的三角瓶中,在150 r/min摇床振荡3 h后,静止30 min,吸取10 mL上清液加至90 mL刚果红-羧甲基纤维素钠固体培养基中,置于室温下连续培养5 d,初步筛选出降解玉米秸秆的菌系[13]。將初步筛选出的菌株分别接种于细菌培养基、放线菌培养基上,将平板置于15 ℃的恒温培养箱中培养,挑选单菌落;然后再分别接种单菌落于细菌培养基、霉菌培养基、放线菌培养基,再一次进行分离。进行重复操作试验3~5次,以选择培养基是否显示为指示标准得到较纯菌株[14]。
在分离出的菌株培养基中放入滤纸片,选择溃烂程度高的菌株点接种于刚果红纤维素鉴别培养基[15],根据培养基中菌系的直径大小和群落数筛选出可降解的纯菌株。菌株置于PDA培养基中30 ℃恒温培养2~3 d,用含有20%甘油的无菌生理盐水收集菌体,保存于-80 ℃超低温冰箱中备用。
1.2.3
26S rRNA PCR分析。利用北京百泰克生物科技公司真菌基因组DNA提取试剂盒提取各菌株的DNA,采用真菌特异引物扩增。引物序列由上海生工公司合成。DNA扩增结束后,取3 μL的PCR扩增产物与50 μL溴甲酚蓝染料混合均匀后经琼脂糖凝胶电泳,确定1 500 bp处有目的条带后,交于库美生物进行测序,然后在NCBI库上进行序列比对送检测序,其结果与NCBI数据库比对相似度98%以上则初步判断为同一菌属[16]。
1.2.4
复合菌剂的构建。以“1.2.2”中分离提纯的5株单一降解菌(AX1、AX3、AM3、AM4、AM5)为对象,将其分别接种至PDA培养基试管中,在无菌蒸馏水中清洗数次,用滤纸吸干后放入斜面培养基上。接种后的培养基置于15 ℃气候箱中避光培养。待菌丝长满斜面,选择管内无杂菌污染的菌种进行转接。在无菌操作条件下挑取菌丝转接到斜面培养基上,直至斜面长满菌丝,即获得纯菌种,以此方式活化3次。将活化后的菌株接种到装有100 mL细菌培养基的三角瓶中,然后在室温条件下培养7 d,在固体培养基中加入20 mL灭菌生理水溶液,150 r/min摇床振荡30 min后,2 000 r/min中离心10 min,进行计数。并用无菌水分别制备菌数目浓度为1.0×107 CFU/mL。
将5株菌株进行全组合复配试验,在无菌操作条件下挑取菌丝交叉划线,然后转接到斜面培养基上。15 ℃恒温培养箱中倒置培养3 d,如果菌系交叉出现无菌区,说明它们之间存在拮抗作用。将相互之间无拮抗作用的菌株分别接种至200 mL 的MS培养基中。15 ℃、160 r/min恒温摇床培养3 d,1 000 r/min离心后弃上清液收集沉淀菌体,将菌体按一定比例混合制成可降解玉米秸秆复合菌剂。
1.2.5
秸秆重量及半纤维素、纤维素和木质素含量测定。将处理后秸秆56 ℃烘干至恒重,记录秸秆重量。培养菌液同分解秸秆残渣用滤纸过滤,56 ℃烘干至恒重,去除滤纸重后得到分解玉米秸秆残渣重。对比前后秸秆重量,粉碎秸秆,称取处理前秸秆和秸秆残渣各0.5 g,装入专用滤袋中。用滤袋式全自动纤维分析仪(ANKOM 200i,美国安卡姆科技公司)测定纤维素、半纤维素、木质素含量。具体步骤参考石文卿等[17]方法。
1.2.6
复合菌系产酶活性的测定。酶活性的测定包括CMCC酶、FDA水解酶和木聚糖酶。以滤纸50 mg、5%羧甲基纤维素钠、2%微晶纤维素、0.5%水杨苷、1%燕麦木聚糖为底物,使用0.5 g玉米秸秆残渣液和磷酸缓冲液(pH 7.8)定容至100 mL[18]。
1.2.7
复合菌系秸秆相对降解率的测定及效果评价。以构建的复合菌系以及“1.2.1”初筛中的降解能力强的单一菌剂为对象,采用失重法检测复合菌系对玉米秸秆的相对降解率。试验称取500 g土壤,从中取出厚度为5 cm左右的土壤铺垫于灭菌培养瓶中,再称取5 g玉米秸秆粉末均匀放置在土壤上,然后于玉米秸秆粉末上均匀倒入单一菌种降解剂和复合菌种降解剂,再将剩余的土壤覆在秸秆上。试验设置秸秆(CK)、秸秆+单菌、秸秆+复合菌剂,分别标记为J1、J2、J3。用无菌水调解各个培养基得含水量为650~700 g/kg,每隔24 h保存并测定腐朽过程中物料理化性状的变化。腐朽处理过程中取出试样,除掉菌丝和杂质,烘干,称量。烘干恒量时的物质即为降解剩余物[19]。秸秆失重率=(m1-m2)/m1×100%,式中,m1为腐朽前培养基中秸秆重量;m2为腐朽后培养基中秸秆的降解剩余物的重量。
1.3 数据统计分析
通过tidyverse、reshape进行数据处理,采用origin等工具包进行统计分析和相关性分析,利用origin进行数据可视化。
2 结果与分析
2.1 玉米秸秆降解真菌的筛选与鉴定
在低温条件下(15 ℃),从污泥中分离得到12株具有秸秆降解能力的真菌,其中AX1、AX3、AM3、AM4、AM5这5株真菌的降解能力好。水解圈试验和水稻秸秆降解试验结果表明,5株真菌在低温条件下水解圈直径为15~40 mm,对秸秆有良好的降解能力。菌落形态表明其属于不同菌种,对其进行进一步序列鉴定和系统发育分析,结果表明(图1),AX1为链霉菌(Streptomyces),AX3为棘孢木霉(T.asperellum),AM3为钩状木霉(T.asperellum),AM4为曲霉(Aspergillus),AM5为青霉(Penicillium)。5株菌株在NCBI库上进行序列比对送检测序,其结果与NCBI数据库比对相似度均超过99.5%。
2.2 复合菌剂的构建及酶活分析
以菌丝圈、水解圈出现较早作为筛选的依据,图1的结果可作为初步筛选。选取降解能力较高的5株菌AX1、AX3、AM3、AM4、AM5进行组合。拮抗性结果表明(表1),菌株AM5对菌株AX1、AX3、AM3、AM4有一定程度的抑制作用;其余菌株之间不存在拮抗性,故采用菌株AX1、AX3、AM3和AM4进行复合菌剂的构建。
从5株菌株的单菌株CMC-Na和滤纸的酶活性(图2)
可以看出,AX1的CMC-Na酶活性最高,達1 080 IU/mL,AX3次之,为890 IU/mL,然后依次为AM3、AM4、AM5。AX3、AM4的滤纸酶活性显著高于其他3株菌系,AX3、AM4的滤纸酶活性分别为480、475 IU/mL。由此可见,AX1酶活性表型最佳,AX3次之。
从4种不同丰富度的复合菌系的平均CMCC酶和平均FDA酶的活性比较(图3)可以看出,组合三的2种酶的活性均优于其他组合的酶活性,其不同时间酶降解活性和稳定性都优于其他组合,故该研究采用组合三进行后续试验。
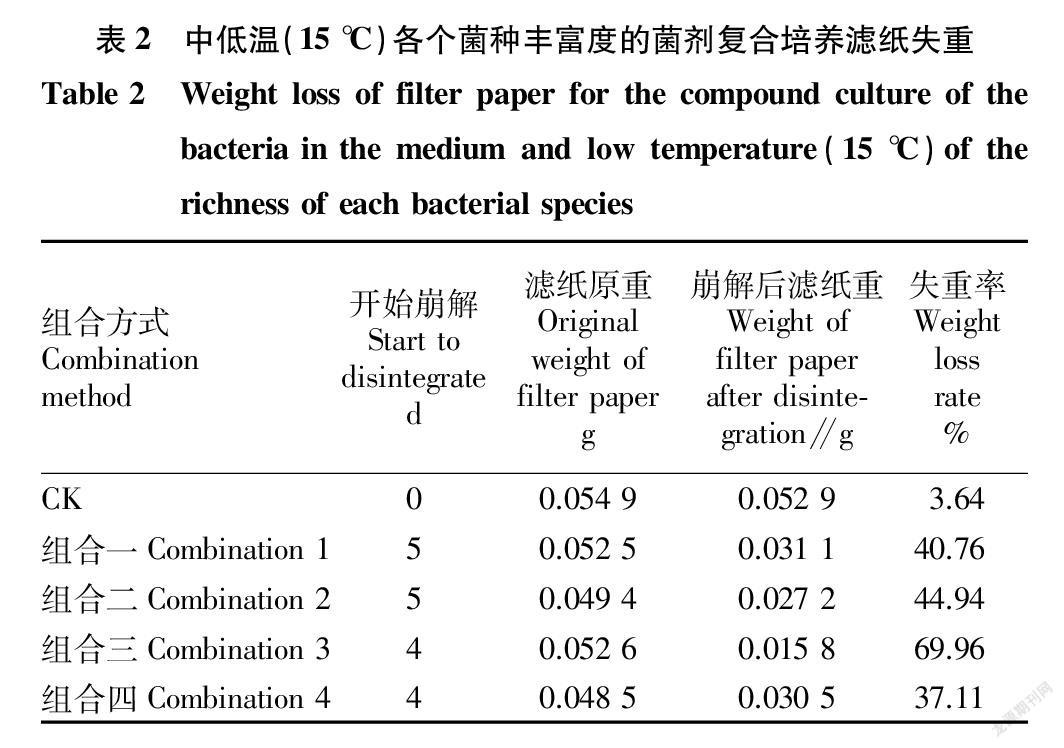
用滤纸过滤发酵液,用稀的盐酸和硝酸混合液反复缓慢冲洗过滤破碎的滤纸条,而后烘干(80 ℃)称量,用减重法计算出滤纸失重率。由表2可知,组合三在低温下降解效果优于其他组合。在组合三的4种复合菌剂组合中:(AX1、AX3、AM3),(AX1、AX3、AM4),(AX1、AM3、AM4),(AX3、AM3、AM4),得到了由AX1、AX3、AM4组合是复合菌剂中活性降解效果最优的复合菌剂。
2.3 低温复合纤维素降解菌株降解效果评价
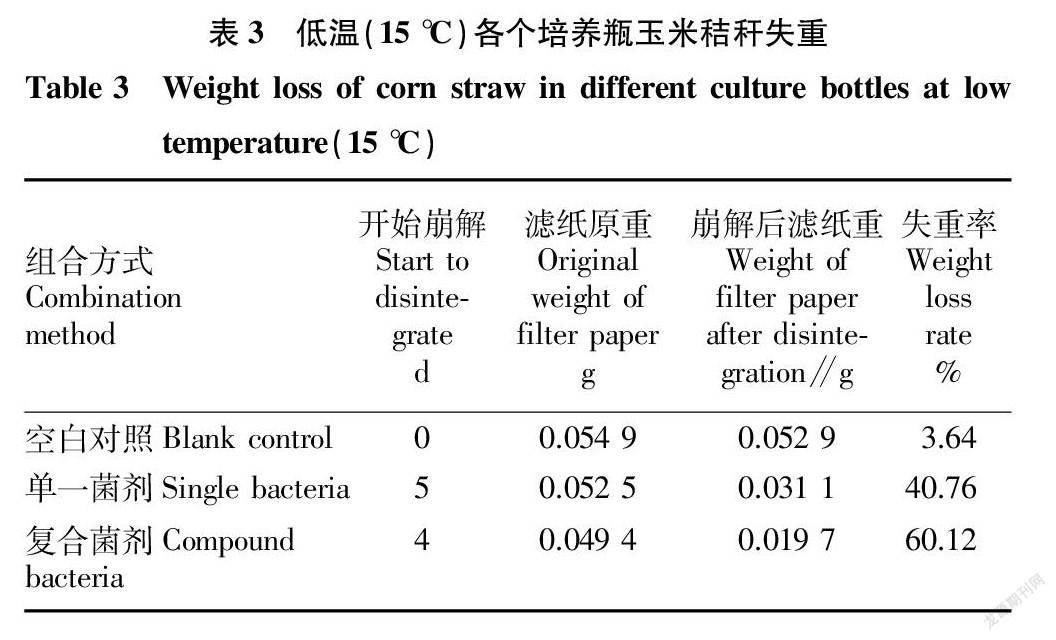
由表3可知,土培法试验组中复合秸秆降解菌剂的失重率明显高于空白对照和单一菌剂降解组,说明复合菌剂的降解能力优异,需要进一步测定来证实其和单一菌剂的降解性能效果的对照。
由图4可知,随着秸秆腐朽试验的进行,3个培养基的含水量均下降,添加外源菌剂的J3处理(复合菌剂)和J2处理(单一菌剂)下降速度均高于J1处理(空白对照),其中J3处理效率更高,含水量从702.4 g/kg下降至290.2 g/kg,含水量下降显著,一定程度上说明复合菌剂中微生物降解反应活跃。3个处理组的pH变化整体趋势一致,在腐朽试验初期均大幅升高,在第20天达到最大值,随后下降,后期趋于稳定。其中,J3处理的pH变化幅度最大,至堆肥腐朽结束,pH稳定在6.44左右。
從图5可以看出,在降解过程中,3个处理组有机质含量均呈下降趋势,J3处理(复合菌剂)的有机质含量下降最为明显,下降了29.8%,其次为J2处理(单一菌剂),下降了20.5%;降解试验结束J1、J2和J3处理的有机质含量分别为725.1、577.6、490.6 g/kg。在降解过程中,3个处理组的发芽指数均呈明显的上升趋势,在整个试验过程中J3处理的发芽指数始终高于J1和J2处理,试验前期,J3和J2处理的发芽指数相差不大,在25 d一直呈交替上升趋势,至试验结束,J3处理的发芽指数达到94.45%。
从腐朽过程中全氮、全磷和全钾含量的变化(表4)可以看出,J2处理(单一菌种)、J3处理(复合菌剂)腐朽试验结束时养分含量均低于初始样品的养分含量;腐朽试验结束时,各个处理的养分含量都有一定程度上的差异,J3处理的全磷、全氮含量明显低于J1处理(空白对照)和J2处理,J2处理、J3处理全钾含量差异性很小且J2处理略高。由此可见,J3处理的养分含量低,在低温(15 ℃)环境下菌剂的协同作用使其降解效果能力优于单一菌剂。
2.4 复合菌系分解玉米秸秆过程中半纤维素、纤维素和木质素分解率变化
测定不同时间的培养液中玉米秸秆中的半纤维素、纤维素、木质素含量,结果发现(图6),纤维素和半纤维素降解趋势相同,在0~15 d降解速度较快,降解速率呈线性上升,在第15天时,半纤维素、纤维素的降解率分别为27%、26%,在15~30 d降解速度放缓,在第30天时,半纤维素、纤维素的降解率分别为35%、32%。
3 结论
该试验探索不同丰富度的复合菌系多样性水平和组成对秸秆降解及其纤维素酶活的影响,明确高效降解秸秆的最佳组合,从长白山高海拔处的典型静水水体污泥中分离获得5株可低温降解玉米秸秆的微生物,进一步26S rRNA PCR序列鉴定和系统发育分析表明,AX1为链霉菌(Streptomyces)、AX3为棘孢木霉(T.asperellum)、AM3为钩状木霉(T.asperellum)、AM4为曲霉(Aspergillus)、AM5为青霉(Penicillium),与NCBI数据库的序列相似度均超过99.5%。经生物拮抗性试验,发现菌株AM5与其他菌株之间产生拮抗作用,用菌株AX1、AX3、AM3、AM4进行复合菌剂的构建。全组合复配结果表明,以编号为AX1、AX3、AM4组合的玉米秸秆降解效果最佳、酶活性最高,其构建的复合菌系的降解能力和纤维素酶活性均高于单一菌系,且随着菌株多样性水平的增加而提高。
为证实该试验复合菌剂的降解能力,进一步利用复合菌剂和单一菌剂进行对比试验,结果表明,复合菌剂组的养分消耗量大于单一菌剂组,全氮、全磷和全钾含量比堆肥初始时均有所增加,这是由于微生物的活动导致堆肥的总干物质量下降和部分养分的释放。至堆肥腐朽结束时,秸秆组各处理间的总养分具有微弱差异,氮、磷、钾含量均为复合菌处理>单菌处理>不加菌处理。
参考文献
[1] 黄根树,孔令保,朱向东,等.纤维素降解复合菌系中纤维结合蛋白的分离及鉴定[J].环境科学学报,2015,35(4):1026-1031.
[2] 樊晓腾.复合菌系FC1的构建及降解玉米秸秆的效果研究[D].南京:南京农业大学,2014.
[3] ZHAO S C,LI K J,ZHOU W,et al.Changes in soil microbial community,enzyme activities and organic matter fractions under long-term straw return in north-centralChina[J].Agriculture,ecosystems & environment,2016,216:82-88.
[4] AHAMED A,VERMETTE P.Culture-based strategies to enhance cellulase enzyme production from Trichoderma reesei RUT-C30 in bioreactor culture conditions[J].Biochemical engineering journal,2008,40(3):399-407.
[5] 王垚,韩燕峰,梁宗琦.两株戴氏霉对水稻秸秆的降解及产酶研究[J].菌物学报,2017,36(5):598-603.
[6] 张晨敏.低温纤维素降解菌的筛选及复合菌剂在秸秆还田中的应用[D].南京:南京农业大学,2014.
[7] GARSOUX G,LAMOTTE J,GERDAY C,et al.Kinetic and structural optimization to catalysis at low temperatures in a psychrophilic cellulase from the Antarcticbacterium Pseudoalteromonas haloplanktis[J].Biochemical journal,2004,384(2):247-253.
[8] YAO G S,WU R M,KAN Q B,et al.Production of a high-efficiencycellulasecomplex via β-glucosidase engineering in Penicillium oxalicum[J].Biotechnology for biofuels,2016,9(1):1-11.
[9] VAISHNAV N,SINGH A,ADSUL M,et al.Penicillium:The next emerging champion for cellulase production[J].Bioresource technology reports,2018,2:131-140.
[10] WEI H W,WANG L H,HASSAN M,et al.Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J].Bioresourcetechnology,2018,256:333-341.
[11] WANG P,CHANG J,YIN Q Q,et al.Effects of thermo-chemical pretreatment plus microbial fermentation and enzymatic hydrolysis on saccharification and lignocellulose degradation of corn straw[J].Bioresource technology,2015,194:165-171.
[12] SUN L,LIU T,MLLER B,et al.The microbial community structure in industrial biogas plants influences the degradation rate of straw and cellulose in batch tests[J].Biotechnology for biofuels,2016,9:1-20.
[13] KAMESHWAR A K S,QIN W S.Recent developments in using advanced sequencingtechnologies for the genomic studies of lignin and cellulose degradingmicroorganisms[J].International journal of biological sciences,2016,12(2):156-171.
[14] 任安靜,吴林飞,李永春,等.基于竹屑降解的腐生真菌筛选、酶活测定与基因表达分析[J].农业生物技术学报,2016,24(11):1664-1675.
[15] 刘爽,范丙全.秸秆纤维素降解真菌 QSH3-3的筛选及其特性研究[J].植物营养与肥料学报,2012,18(1):218-226.
[16] 文亚雄,谭石勇,邱尧,等.1株秸秆降解高温菌的筛选、鉴定及堆肥应用[J].江苏农业科学,2018,46(22):296-300.
[17] 石文卿,陶能国,刘跃进,等.一株高产纤维素酶真菌的分离及产酶特性研究[J].环境工程学报,2011,5(6):1435-1440.
[18] SONI S,KUMAR M,SHUKLA M.A study on health consciousness among the elderly in a rural population of Katihar,Bihar[J].International journal of scientific reports,2016,2(9):233-236.
[19] KAMPMANM T,ELTOFTA,KARALIUTEM,et al.Full implementation of screening for nutritional risk and dysphagia in an acute stroke unit:A clinical audit[J].Neurohospitalist,2015,5(4):205-211.
3611500338225
