盆栽小菊组培快繁体系的建立及玻璃化研究
2022-03-11刘丹陈天烺王容徐春光吴海峰赵鹏霞陈炜赫文韬
刘丹 陈天烺 王容 徐春光 吴海峰 赵鹏霞 陈炜 赫文韬



摘要 以盆栽小菊“子午线”的花瓣作为外植体,研究不同消毒时间对外植体污染率的影响,以及不同激素浓度对花瓣诱导愈伤组织和不定芽分化的影响;以及对缓解玻璃化苗方法的探讨。结果表明,当使用次氯酸钠处理花瓣时,7 min是最佳处理时间。MS+6-BA 2.0 mg/L+NAA1.0 mg/L+蔗糖30 g /L+琼脂5 g/L是诱导花瓣愈伤组织的最佳培养基,诱导率达98%。不定芽分化最适培养基为MS+6-BA 3.0 mg/L+NAA 0.1 mg/ L+蔗糖30 g/L+琼脂5 g/L,分化率达90.30%。培养基MS+6-BA 0.2 mg/L+蔗糖30 g/L+琼脂5 g/L是缓解菊花玻璃化现象的最佳配方,转化为正常苗的转化率最高,可达98.36%。
关键词 花瓣;愈伤组织;玻璃化苗;诱导率;分化率
中图分类号 S 682.1+1文献标识码 A文章编号 0517-6611(2022)04-0044-04
doi:10.3969/j.issn.0517-6611.2022.04.014
开放科学(资源服务)标识码(OSID):
Establishment of Tissue Culture and Rapid Propagation System of Potted Chrysanthemum and Vitrification Study
LIU Dan,CHEN Tian-lang,WANG Rong et al
(Zhejiang Hifun Flower Co., Ltd.,Shaoxing, Zhejiang312000)
Abstract The petals of potted Chrysanthemum “Meridian” were used as explants to study the effects of different disinfection times on explant contamination rate and hormone concentration on petal-induced callus and adventitious bud differentiation. The methods of alleviating vitrification were also discussed. The results showed that when the petals were treated with sodium hypochlorite, 7 min was the best treatment time.MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+sucrose 30 g/L+ agar 5 g/L was the best medium to induce petal callus, the induction rate was 98%.MS+6-BA 3.0 mg/L+NAA 0.1 mg/L+ sucrose 30 g/L+ Agar 5 g/L was the optimum medium for adventitious bud differentiation, the differentiation rate was 90.30%.To solve the problem of vitrification, MS+6-BA 0.2 mg/L+sucrose 30 g/L+Agar 5 g/L was the best formula to alleviate the vitrification of Chrysanthemum, and the highest transformation rate was achieved to 98.36% .
Key words Petals;Callus;Vitrification;Induction rate;Differentiation rate
菊花(Chrysanthemum morifolium)為菊科菊属多年生草本花卉[1],是世界四大切花与我国十大传统名花之一,因其花色丰富,品种繁多,花型多变而深受人们喜爱[2]。盆栽小菊的花径一般小于6 cm,节间较短,分枝能力强,花朵数多且花期长[3],花色绚丽多彩,株型丰满圆润,优良品种的株型通常呈球形或者密丛状,观赏价值极高[4],广泛应用于园林绿化美化、家庭园艺和节日花展、专题展览[5],在花卉市场占据较大份额。目前,盆栽小菊的繁殖方式是最常见的扦插繁殖,但频繁使用插穗进行无性繁殖导致品种退化,影响菊花的花色、花型和株型等品质,从而大大减少了花卉市场中菊花品种的种类。植物组织培养可以解决传统繁殖中存在的一些问题,前人有关菊花组织培养再生体系建立的技术方面做了大量工作,但研究表明由于菊花基因型的不同,其再生体系不存在普遍性[6],所以需要针对不同的菊花品种进行组织培养再生体系建立的研究[3]。笔者以盆栽小菊花瓣为外植体建立组培快繁体系,并对试验中出现的褐化问题进行研究,旨在为以后的菊花母本复壮和新品种培育奠定基础。
1 材料与方法
1.1 材料
2020年10月19日在浙江省绍兴市柯桥区平水镇浙江海丰花卉有限公司种植基地采摘浅紫色小菊“子午线”花朵4个,其直径约3 cm,开放度为4度,并在浙江海丰花卉有限公司实验室开展试验。
1.2 方法
1.2.1 不同消毒时间对外植体污染率的影响。
以菊花花瓣作为外植体,首先用洗洁精水处理15 min,处理后用自来水流水冲洗1 min;多菌灵1 000倍液处理30 min,同上取出用自来水流水冲洗1 min;然后置于超净工作台,用75%的乙醇溶液处理30 s,无菌水冲洗3次;最后用次氯酸钠溶液(有效氯为5%)分别处理3、5、7、9、11 min,无菌水分别冲洗5次,取出后用手术刀将花瓣四周切出伤口,分别接种于含有诱导愈伤组织培养基的培养瓶中,每瓶接种6个花瓣,培养7 d后观察生长情况,统计外植体的污染率。污染率=污染数/接种数×100%,培养条件:培养温度(22±2)℃,光照强度2 000 lx,光照时间14 h/d。
1.2.2 不同激素对花瓣诱导愈伤组织的影响。
以MS为基本培养基,采用单因素完全随机区组试验设计,设置6-BA浓度分别为0.5、1.0、1.5、2.0、2.5 mg/L,NAA浓度为1.0 mg/L,MS作为对照,共6个处理。将消毒后的花瓣四边切出伤口,正面朝上分别平铺接种于6个处理的培养瓶中诱导愈伤组织,每个处理接种10瓶,每瓶接种6个花瓣,共60瓶。每个处理均添加蔗糖浓度30 g/L和琼脂5 g/L,pH为6.0。
培养条件:培养温度(22±2)℃,光照强度2 000 lx,光照时间14 h/d。7 d后定期观察愈伤组织诱导情况,30 d后统计愈伤组织诱导率。愈伤组织诱导率=愈伤组织数/接种数×100%。
1.2.3 不同激素组合对愈伤组织分化不定芽的影响。
将诱导出的愈伤组织切成1mm×1mm的小团,分别接种在含有不同激素组合的组培瓶中进行不定芽分化培养,每瓶接6团,每个处理接10瓶。试验设置的基本培养基为MS培养基,6-BA浓度分别为1.0、2.0、3.0、4.0 mg/L,NAA浓度分别为0.1、0.2 mg/L,MS为对照培养基,pH为6.0。培养条件:温度(22±2) ℃,光照强度2 000 lx,光照时间14 h/d,培养10 d后开始观察不定芽分化情况,60 d后统计不定芽分化率。不定芽分化率=不定芽数/接种数×100%。
1.2.4 缓解玻璃化苗的有效措施。
分化出的不定芽出现严重的玻璃化现象,将玻璃化苗移至浓度较低的培养基中进行缓苗培养,以MS为基本培养基,设置6-BA浓度分别为0.1、0.2、0.3、0.4 mg/L,MS作為对照培养基,蔗糖30 g/L,琼脂5 g/L,pH 6.0,每瓶接种6株。缓苗培养7 d后定期观察苗的生长情况,30 d后统计正常苗转化率。正常苗的转化率=正常苗数/接种数×100%。培养条件:培养温度(22±2) ℃,光照强度2 000 lx,光照时间8 h/d。
2 结果与分析
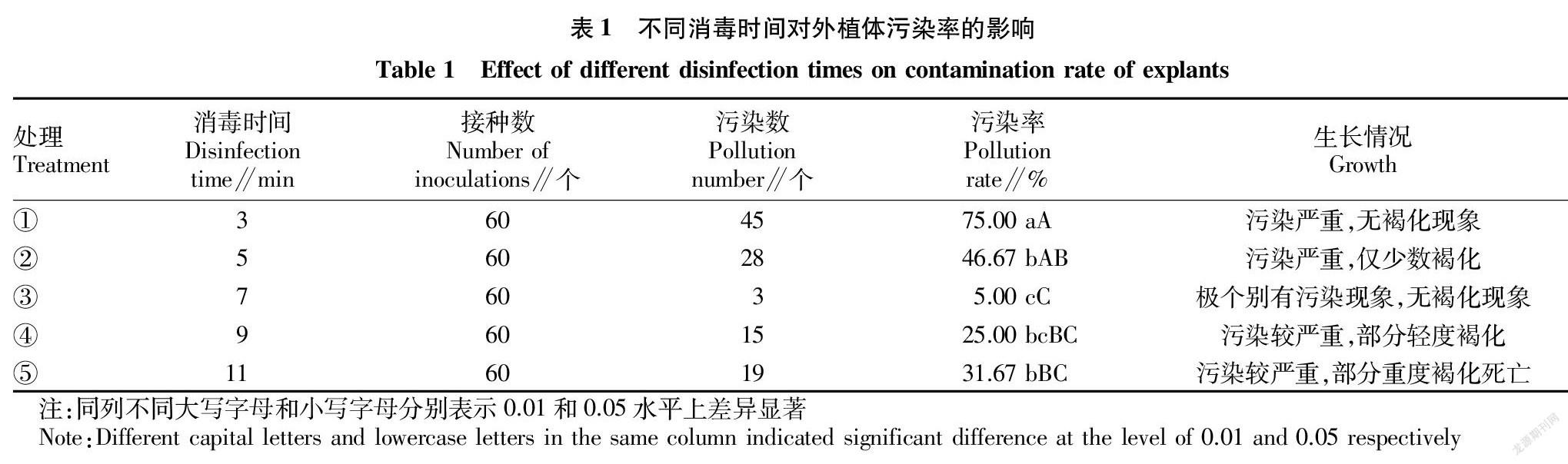
2.1 不同消毒时间对外植体污染率的影响
从表1可以看出,以花瓣作为外植体诱导愈伤组织,不同消毒时间处理外植体对污染率的影响效果差异显著。处理③,即当采用乙醇处理30 s,次氯酸钠溶液处理7 min时,花瓣的污染率最低,仅为5.00%,愈伤组织状态最好,无褐化现象。因此,当使用次氯酸钠处理花瓣时,7 min是最佳处理时间。
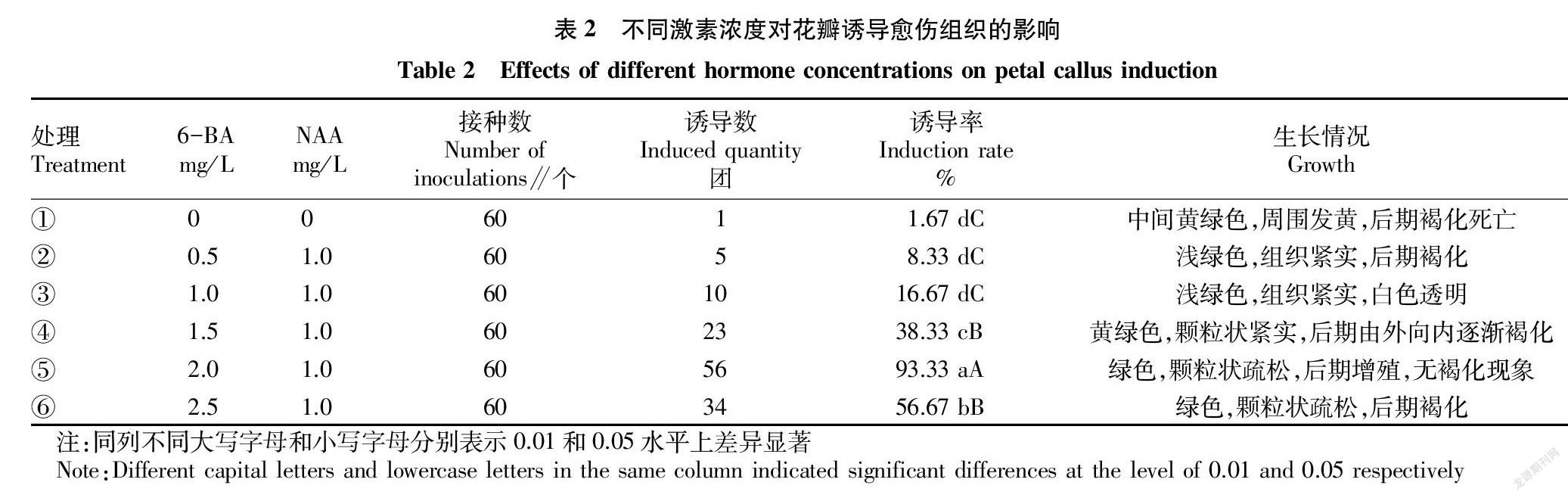
2.2 不同激素浓度对花瓣诱导愈伤组织的影响
从表2可以看出,以花瓣作为材料,不同处理诱导愈伤组织的效果差异显著。处理⑤,即6-BA浓度为2.0 mg/L,NAA浓度为1.0 mg/L时,愈伤组织的诱导率最高,出愈时间最短(图1A),极显著高于其他处理,诱导率达93.33%。因此,MS+6-BA 2.0 mg/L+NAA 1.0 mg/L是诱导花瓣愈伤组织的最佳培养基。
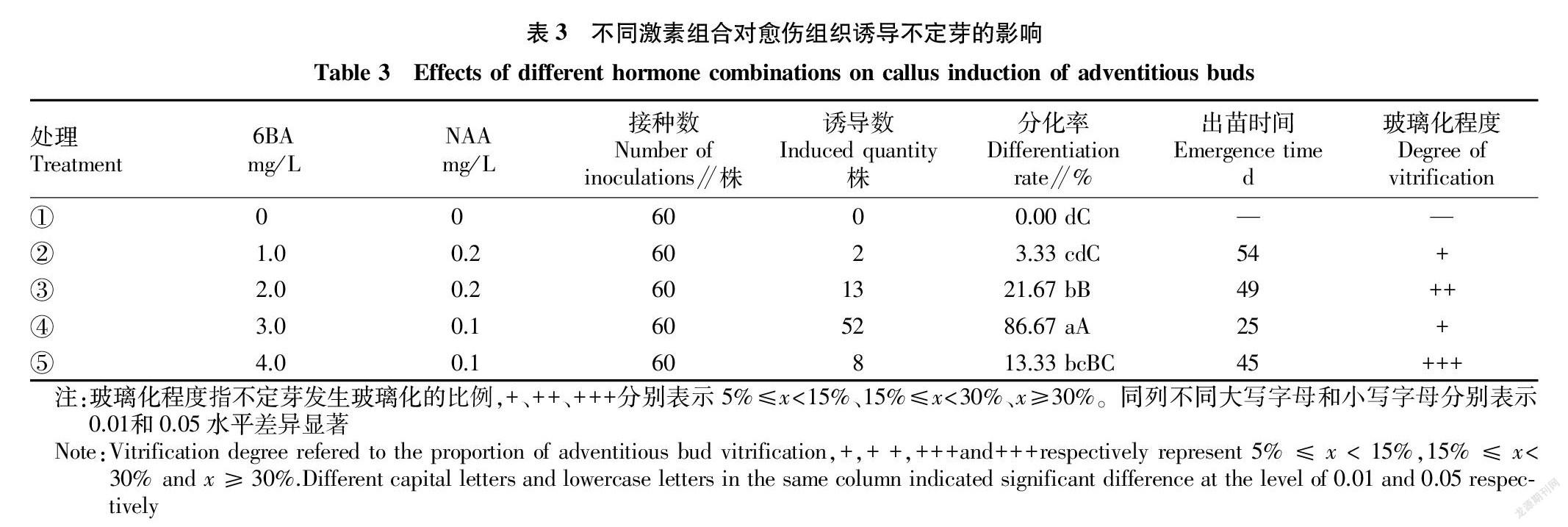
2.3 不同激素组合对愈伤组织诱导不定芽的影响
从表3可以看出,以小菊愈伤组织为材料,采用不同激素组合对不定芽分化的效果差异显著。处理④,即培养基MS+6-BA 3.0 mg/L+NAA 0.1 mg/ L+蔗糖30 g/L+琼脂5 g/L的分化率极显著高于其他处理,达86.67%,仅培养25 d后出苗,玻璃化程度较轻(图1B)。处理①,即对照与其他处理相比,不定芽分化数为0,其他处理均有分化苗,说明激素6-BA和NAA对不定芽的分化起着关键性的作用;处理②和③相比,NAA浓度相同时,随着6-BA浓度的增加,不定芽分化率呈升高趋势;而处理④和⑤相比,NAA浓度同为0.1 mg/L时,随着6-BA浓度的增加,分化率反而呈下降趋势,说明过高的激素浓度抑制不定芽分化。因此,MS+6-BA 3.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂5 g/L是最适宜小菊不定芽分化的培养基。
2.4 缓解玻璃化苗的有效措施
以花瓣愈伤组织诱导出的不定芽出现不同程度的玻璃化现象,采用不同浓度的6-BA对玻璃化苗进行处理,结果见表4。从表4可以看出,5个处理对于玻璃化苗的影响差异显著。处理③,即6-BA浓度为0.2 mg/L时,玻璃化苗转化为正常苗的数量最多,即转化率最高可达98.36%,极显著高于其他处理,植株健壮,叶片厚而绿,伴随有增殖,未出现褐化现象(图1C);而其他处理正常苗转化的周期长,未出现增殖,且植株脆弱,部分叶片稍薄且出现褐化现象。因此,培养基MS+6-BA 0.2 mg/L+蔗糖30 g/L+琼脂5 g/L是最适合缓解菊花组培苗玻璃化现象的配方。
2.5 生根培养及组培瓶苗移栽
将无菌苗切成带1~2片叶的1~2 cm的茎段,接种至MS+6-BA 0.2 mg/L+蔗糖30 g/L+琼脂5 g/L+活性炭0.5 g/L培养基中进行生根培养,14 d后根长3 cm左右,根数5~6条,生根率达100%(图2A)。
待苗高长至5 cm左右时,将组培瓶苗移至大棚。在大棚适应0.5 d后拧松瓶盖,第2天打开瓶盖,适应3 d后取出生根苗洗净根部培养基,移栽至72孔穴盘中(图2B),使用 1 000倍液多菌灵消毒,基质为椰糠和泥炭1∶1混合,温度为20~23 ℃,定期浇水施肥,20 d后移出穴盘种植在土中,成活率100%(图2C)。
3 结论与讨论
与菊花带芽茎段、叶片、花托等外植体比较而言,花瓣和茎尖的病毒含量较少[3]。花瓣作为组织培养的外植体具有取材容易的特点[7],且其变异率高于具有分生组织的外植体且变异主要体现在花色、花径、花型等特性上[8-9]。该试验以盆栽小菊“子午线”的花瓣作为外植体,研究不同培养基对花瓣诱导愈伤组织的影响,结果表明,6-BA浓度为2.0 mg/L,NAA为1.0 mg/L时,愈伤组织的诱导率最高达98%,分别高于刘兴玉等[10]和曾凡力[11]而低于邓丽娟等[12]诱导花瓣愈伤组织的诱导率,出愈时间较短,培养10 d后在花瓣边缘出现绿色的愈伤,颗粒状疏松,无褐化现象。
以小菊愈伤组织为材料,探究不同激素组合对分化不定芽的效果,结果表明,6-BA浓度为3.0 mg/L,NAA浓度为0.1 mg/L,愈伤组织分化不定芽的分化率最高,达90.30%,这与以花瓣为外植体进行组织培养中分化率过低和出芽率过低的结果不同[11-13],可能与菊花的品种不同有关。
植物组织培养过程中通常会出现一些玻璃化现象,植物组培苗的这种生理性病变可能是在高浓度激素以及高湿度的培养条件下形成的[14],与正常组培苗相比,表现为叶片呈透明、卷曲、条形状[15],不定芽分化能力差,增殖、生根率低等[16]。该研究针对不同玻璃化程度的组培苗采用较低浓度的6-BA进行缓解玻璃化,结果表明,玻璃化程度轻的组培苗在6-BA浓度为0.2 mg/L的培养基中培养后发生逆转,得到正常组培苗的数量最多,即转化率最高达98.36%,但较严重的玻璃化苗没有发生逆转,在培养过程中褐化死亡,这与较严重的玻璃化幼苗即使转移到良好的培养条件中也无法逆转的结论一致[17],该试验的研究结果将为解决菊花玻璃化苗提供一定的数据参考。
参考文献
[1] 吴鑫.小菊品种‘炫彩’和‘紫裳粉霓’的测试及评价[D].武汉:华中农业大学,2016.
[2] 沈佳逾.造型菊选育及其配套栽培技术研究[D].南京:南京农业大学,2014.
[3] 刘萌萌.盆栽小菊高频再生体系建立与试管开花研究[D].银川:宁夏大学,2017.
[4] 王青.盆栽多头小菊株型改良的育种研究[D].北京:北京林业大学,2013.
[5] 沈瑶,王晗璇,侯海娴,等.引进盆栽小菊品种观赏价值及园林应用的综合评价[J].广西植物,2021,41(8):1363-1371.
[6] 徐士清,杨世湖,倪丹,等.非洲菊试管苗叶片的组培快繁[J].园艺学报,2002,29(5):493-494,504.
[7] 劉国华,陈海燕,宋刚,等.非洲菊花瓣的离体培养[J].安徽农业科学,2004,32(2):316-317.
[8] 王康才,张雪琼,茅毓英.杭菊花花瓣组织培养[J].中草药,2000,31(8):628-630.
[9] 邓年方,吴桂容.菊花花瓣的组培快繁技术研究[J].贺州学院学报,2007,23(3):144-145.
[10]刘兴玉,蒲红.菊花花瓣的组织培养[J].西南农业大学学报,1990,12(2):204-206.
[11] 曾凡力.菊花花瓣的组织培养[J].北方园艺,2007(9):207-208.
[12] 邓丽娟,万子昱,骆淑媛.激素对菊花组织培养的影响[J].绿色科技,2018(24):177-178.
[13] 毛洪玉,李晓辉,刘志刚,等.地被菊幼嫩花瓣组织培养研究[J].沈阳农业大学学报,2005,36(1):68-71.
[14] DEBERGH P,HARBAOUI Y,LEMEUR R.Mass propagation of globe artichoke(Cynara scolymus):Evaluation of different hypotheses to overcome vitrification with special reference to water potential[J].Physiologia plant,1981,53(2):181-187.
[15] 袁佳,胡恒康,方炎明,等.不同培养条件对铁线莲不定芽增殖及玻璃化的影响[J].西北植物学报,2011,31(2):401-406.
[16] LIN S Z,ZHANG Z Y,LIN Y Z,et al.Comparative study on antioxidative system in normal and vitrified shoots of Populus suaveolens in tissue culture[J].Forestry studies in China,2004,6(3):1-8.
[17] 黄宇翔,吴祖建,柯昉,等.组织培养技术筛选香石竹低玻璃化无性系初报[J].中国农学通报,2006,22(8):88-90.
3400500338284
