双黄连水煎液对猪繁殖与呼吸综合征病毒的体外作用效果研究
2022-03-10范矿士姜昕雨史晶晶张永红崔德凤
范矿士,张 华,吴 琼,周 波,姜昕雨,史晶晶,张永红*,崔德凤*
(1.北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室/动物类国家级实验教学示范中心,北京 102206;2. 河北农业大学动物科技学院,保定 071000;3. 中牧实业股份有限公司,北京 100070)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是当前养猪业最流行的传染病之一,以呼吸窘迫、妊娠母猪流产和仔猪高死亡率为特征[1],给养猪业造成巨大经济损失。猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染猪后在肺巨噬细胞内复制扩散至全身出现病毒血症,对机体免疫器官造成损伤,引发炎性反应[2-3],导致免疫抑制,引起持续感染和继发感染,严重威胁猪群的健康[4-5]。目前,该病主要是通过疫苗预防,然而,面对PRRSV感染引起的免疫抑制、病毒进化、野生型和修饰活病毒(modified-live vaccine,MLV)之间的多重重组问题,已获得许可的疫苗不能有效抵御挑战[6]。迫切需要一种新的抗病毒策略控制PRRSV的传播。
中药拥有丰富的活性成分和药理作用,对动物毒害小,近年广泛用于抗PRRSV的研究,许多天然化合物和中草药成分已被证实具有抗PRRSV活性[7]。尤其是黄芩、连翘和金银花,已被证明能在体外有效抑制PRRSV的增殖。黄芩的主要成分黄酮类化合物黄芩苷和黄芩素具有抗氧化、抗肿瘤、抗炎、抗菌和抗病毒等多种药理作用,其提取物黄芩苷对PRRSV具有很好的阻断吸附效果,且保护率在50%以上[8-9]。连翘可以中和内毒素,具有良好的抗炎和解热作用[10]。从贯叶连翘中提取的具有生物活性的金丝桃素在体外抗PRRSV中能够提高细胞存活率和抑制PRRSV复制[11]。金银花对多种常见呼吸道病毒都具有一定的抑制作用,金银花提取物大孔树脂600 ml/L的乙醇/水洗脱部位具有良好的体外抗PRRSV活性[12-13]。CHENG等[14]发现,绿原酸和黄芩素能抑制PRRSV的复制或直接杀灭PRRSV,在最大安全浓度下对PRRSV的抑制率分别达到90.8%和61.1%,而对病毒的吸附没有阻断作用。
单味中药在改善被PRRSV破坏的免疫系统并发挥良好的抗病毒效果不如中药复方[15]。故该研究拟将金银花、黄芩、连翘按1∶1∶2配比组成双黄连水煎液,使用建立的荧光定量PCR方法,探索双黄连水煎液对PRRSV复制的影响。
1 材料与方法
1.1 材料与仪器
PET-28a-N载体质粒和非洲绿猴胚胎肾细胞(Marc-145细胞)由北京农学院兽医学(中医药)北京市重点实验室保存;猪瘟病毒(classical swine fever virus,CSFV)、猪圆环病毒1型(porcine circovirus type 1,PCV1)、猪圆环病毒2型(porcine circovirus type 2,PCV2)、猪细小病毒(porcine parvovirus,PPV)、猪博卡病毒(porcine boca virus,PBoV)由北京农学院兽医学(中医药)北京市重点实验室保存;黄芩、金银花、连翘购自北京同仁堂大药房;CCK8细胞检测试剂盒购自Solarbio公司;SYBR Green Pro Taq HS预混型qPCR试剂盒、SteadyPure病毒DNA/RNA提取试剂盒、Evo M-MLV反转录预混型试剂盒均购自湖南艾克瑞生物工程有限公司。倒置显微镜为OLYMPUS公司制造;StepOnePlus荧光定量PCR仪为Applied Biosystems公司制造;酶标仪为北京普朗新技术有限公司制造;MLS-3750型高压灭菌锅为SANYO公司制造。
1.2 引物设计与合成
根据DNA序列数据库公布的PRRSV-N基因序列(EU926974.1)通过primer5.0设计荧光定量PCR特异性引物,并由北京擎科生物科技有限公司合成,扩增产物372 bp。
1.3 荧光定量PCR方法的建立及标准曲线的绘制
将北京农学院兽医学(中医药)北京市重点实验室保存的阳性重组质粒测定浓度后计算其拷贝数值。将阳性重组质粒进行8个连续的10倍梯度稀释。根据SYBR Green Pro Taq HS预混型qPCR试剂盒说明书以及引物特性和模板浓度进行试验,探索最佳扩增反应条件和反应体系。反复试验后,选择20 μL反应体系:10 μL的2×SYBR Green Pro Tap HS Premix×6;上游引物和下游引物各0.4 μL;模板2.0 μL;ROX Reference Dye (20 μmol/L)0.4 μL;RNase Free dH2O为6.8 μL。反应条件为95 ℃预变性30 s;95 ℃ 5 s,55 ℃ 30 s,40个循环。反应结束后,选取至少5个连续的不同浓度梯度的结果进行分析,根据得到的Ct值和扩增曲线得出最佳的检测区域和方程,绘制标准曲线。
1.4 荧光定量PCR重复性检验
将稀释好的质粒选择1×104、1×106、1×108的样本进行荧光定量PCR反应。同时分批进行3次荧光定量PCR扩增,比较同一批次同一浓度(批内试验)和不同批次同一浓度(批间试验)Ct值和Tm值的变化情况,验证重复性和稳定性。
1.5 荧光定量PCR特异性检验
以提取的猪瘟病毒、猪圆环病毒1型、猪圆环病毒2型、猪细小病毒、猪博卡病毒核酸为模板,RNA病毒需反转录,使用优化过的最佳反应条件,按照PRRSV的荧光定量PCR反应体系进行扩增,以检测所建方法的特异性。
1.6 病毒培养及TCID50测定
取出已长成单层、生长良好的Marc-145细胞清洗2~3遍。加入病毒液,细胞培养箱中孵育1 h,加入2 mL的2%血清维持培养液培养72 h,反复冻融3次,1 000 r/min离心5 min,上清即为病毒液,保存于-80 ℃。
将Marc-145细胞消化成单个悬液,取少量滴加到细胞计数板上进行计数,调节细胞密度为1×105个/mL,均匀添加到96孔板中,每孔100 μL,置于5%CO237 ℃培养箱中。待细胞长成单层后,弃去培养液,病毒用细胞维持液稀释到8个稀释度即10-8、10-7、10-6、10-5、10-4、10-3、10-2和10-1,每孔加100 μL,每个稀释度进行8个重复,72 h后观察细胞病变(cytopathic effect,CPE)。根据Reed-Muench公式计算50%组织培养感染剂量(TCID50)。
1.7 双黄连水煎液的制作
金银花、黄芩、连翘按1∶1∶2称取100 g,加水浸泡过夜。慢火水煎煮2次,每次沸腾30 min,合并2次水煎液。旋转蒸发浓缩,定容至1 g/mL,离心取上清,用0.45 μm和0.22 μm滤膜过滤除菌,分装后保存于-20 ℃备用。
1.8 双黄连水煎液对Marc-145细胞的安全性测定
为了确定双黄连水煎液对Marc-145细胞的最大安全质量浓度和最佳作用时间,试验采用CCK8法。首先对细胞计数,调节细胞密度为1×105个/mL,然后均匀添加到96孔板中,每孔100 μL。200.00 mg/mL的双黄连水煎液用细胞维持液依次进行2倍倍比稀释后,将稀释好的双黄连水煎液100.00、50.00、25.00、12.50、6.25、3.12、1.56和0.78 mg/mL分别加入96孔板中,每孔100 μL,同时设置对照(对照是指具有细胞、CCK8溶液而没有经过双黄连水煎液处理)。分别培养24、48和72 h后弃去培养液,每孔加90 μL细胞维持液和10 μL的CCK8(避光),继续培养2~3 h,在酶标仪上对OD450 nm进行检测并记录。
1.9 双黄连水煎液对PRRSV感染Marc-145细胞的影响
1.9.1 双黄连水煎液对PRRSV抑制复制作用 使用100TCID50的PRRSV对长成单层的Marc-145细胞进行攻毒,作用1 h后弃去病毒液,加入双黄连水煎液1.56、3.12和6.25 mg/mL,PRRSV侵染细胞后没有添加双黄连水煎液为病毒对照。孵育1 h后弃去药液,加入含2%胎牛血清的细胞维持液,继续培养24、48和72 h后用荧光定量PCR分别检测病毒载量。
1.9.2 双黄连水煎液对PRRSV的阻断吸附作用 Marc-145细胞长满单层,加入1.56、3.12 和6.25 mg/mL双黄连水煎液,PRRSV侵染细胞前没有添加双黄连水煎液作用为病毒对照。培养箱中孵育1 h,弃去药液,加入100TCID50的PRRSV孵育1 h,弃去病毒液,加入含2%胎牛血清的细胞维持液,继续培养24、48和72 h后应用荧光定量PCR分别检测病毒载量。
1.9.3 双黄连水煎液对PRRS病毒粒子直接杀灭作用 Marc-145细胞长满单层后,将1.56、3.12和6.25 mg/mL的双黄连水煎液与100TCID50的PRRSV作用1 h后感染Marc-145细胞,PRRSV侵染细胞前没有与双黄连水煎液相互作用为病毒对照。1 h后更换含2%胎牛血清的细胞维持液,继续培养24、48和72 h后荧光定量PCR检测病毒载量。
1.10 数据统计分析
应用SPSS20.0软件对数据分析,使用t检验法以确定目的基因在不同组别的显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著,P<0.001表示差异非常显著。
2 试验结果
2.1 PRRSV-N基因荧光定量PCR标准曲线的建立
PRRSV-N基因的扩增动力学曲线和标准曲线见图1和图2。标准曲线斜率-3.26,轴距32.4,方程y=-3.26x+32.4,相关系数R2>0.999,扩增效率102.668%。溶解曲线在特定范围内显示单一峰(图3),无非特异性峰,无引物二聚体形成,扩增产物均一,符合试验的要求。
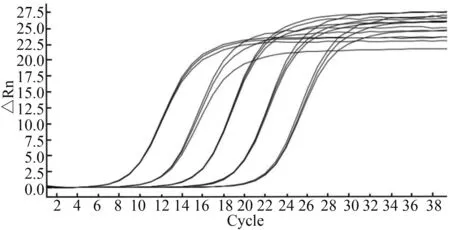
图1 PRRSV荧光定量扩增动力学曲线Fig.1 Dynamic curve of fluorescence quantitative PCR for PRRSV
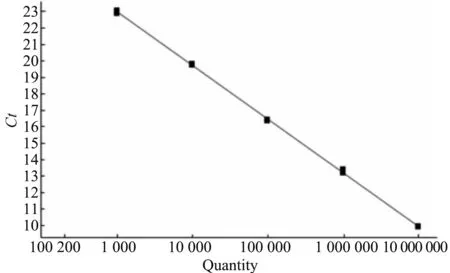
图2 PRRSV荧光定量PCR标准曲线Fig.2 The standard curve of fluorescence quantitative PCR for PRRSV
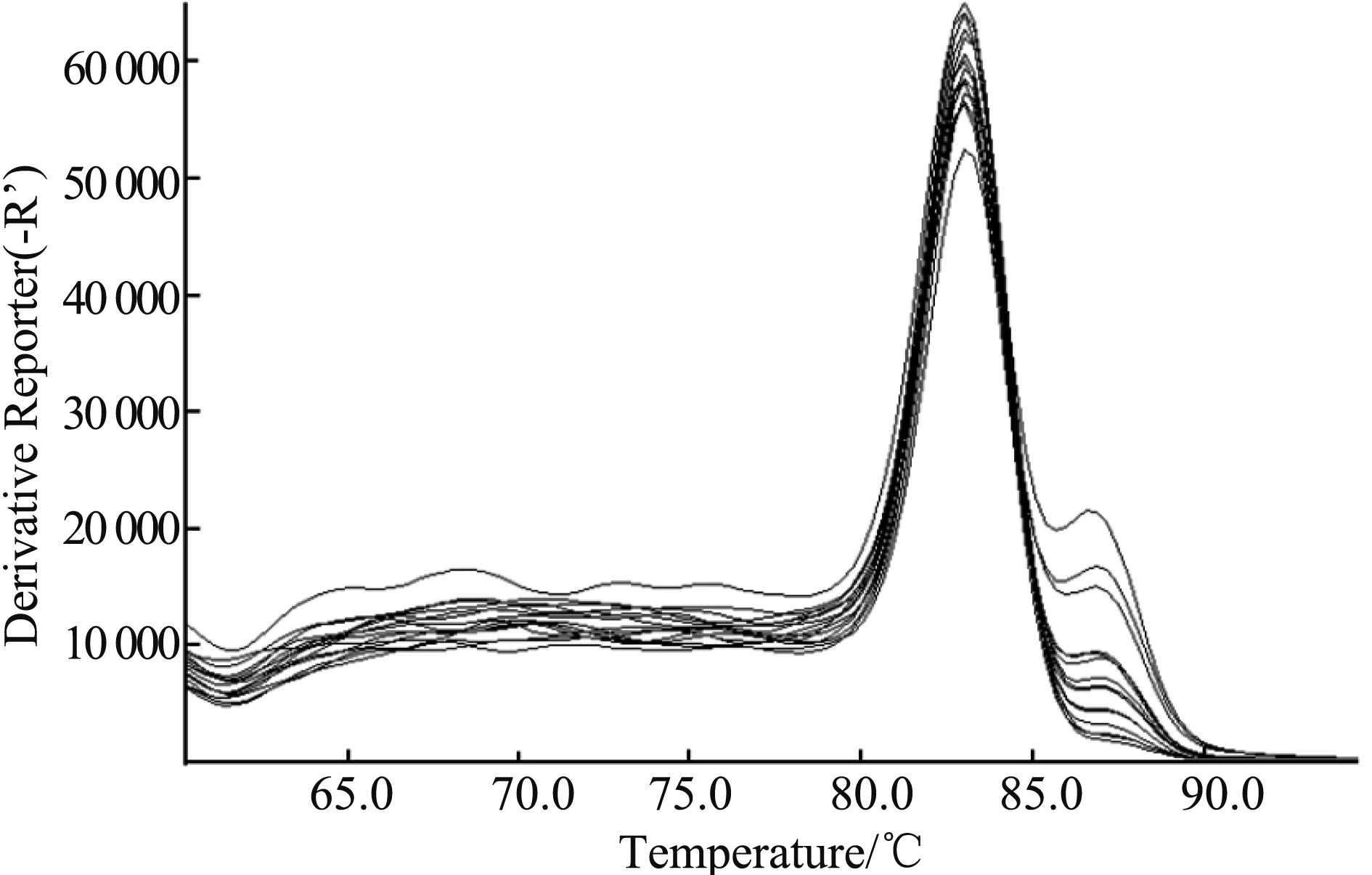
图3 荧光定量PCR溶解曲线Fig.3 The melting curve of fluorescence quantitative PCR for PRRSV
2.2 PRRSV-N基因荧光定量PCR重复性检验
将选取的3组浓度梯度的质粒标准品,进行重复性检验,通过Ct值计算得出标准差小于0.5,变异系数小于3%(表1)。
2.3 PRRSV-N基因荧光定量PCR特异性检验
所扩增的6种病毒模板中只有PRRSV出现了扩增曲线和溶解曲线,证实建立的检测方法具有很强的特异性。
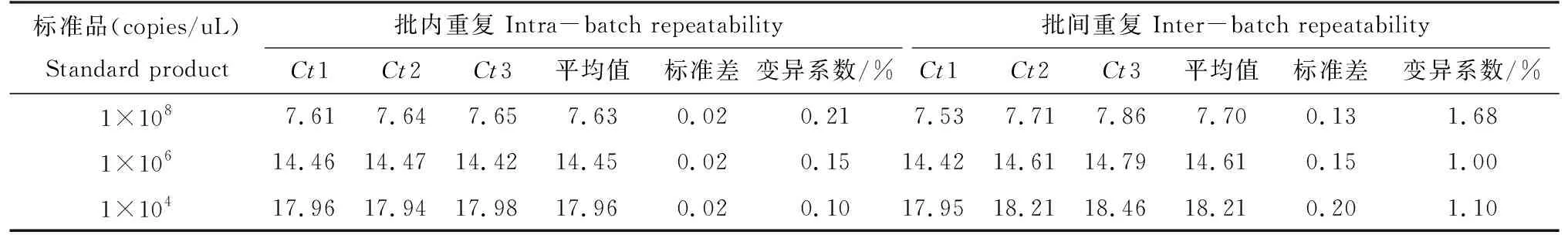
表1 荧光定量PCR重复性试验Tab.1 Repeatability test of fluorescence quantitative PCR
2.4 PRRSV在Marc-145细胞上的TCID50测定
Marc-145细胞感染PRRSV 72 h后,在显微镜下观察细胞的形态变化,可见病毒感染后期,细胞形态肿胀变圆,细胞间质模糊,直至细胞死亡脱落。采用Reed-muench法计算病毒对Marc-145细胞的毒力,用TCID50表示,试验结果见表2,PRRSV在Marc-145细胞的TCID50为10-3.9/0.1 mL。
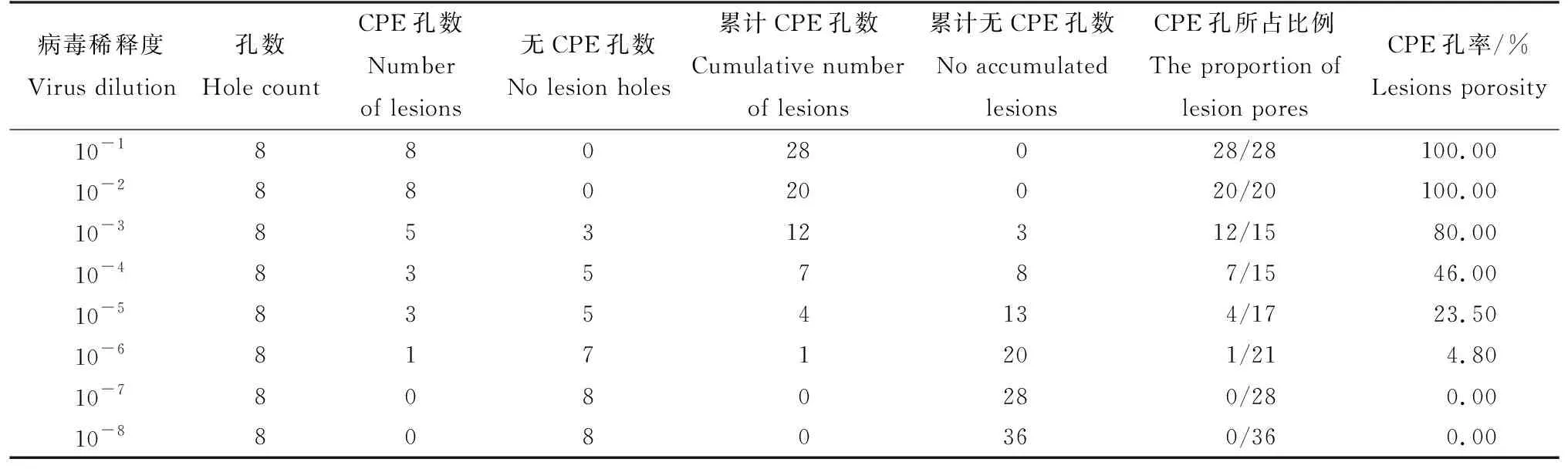
表2 PRRSV TCID50结果(n=8)Tab.2 PRRSV TCID50 results(n=8)
2.5 双黄连水煎液对Marc-145细胞安全性测定结果
当双黄连水煎液在6.25 mg/mL时,与对照无显著性差异(P>0.05),对细胞活力无影响。72 h时细胞活力最高,此试验选取双黄连水煎液最大安全质量浓度6.25 mg/mL,最佳作用时间72 h(图4)。

注:*P<0.05表示差异显著,** P<0.01表示差异极显著。Note: *P<0.05 means significant difference, ** P<0.01 means extremely significant difference.图4 双黄连水煎液对Marc-145细胞安全性测定结果Fig.4 Safety of Shuanghuanglian decoction on Marc-145 cells
2.6 双黄连水煎液体外抗PRRSV的效果测定
2.6.1 双黄连水煎液对PRRSV抑制复制效果 随着双黄连水煎液质量浓度的增加,PRRSV-N基因mRNA表达量显著降低(P<0.05),当双黄连水煎液作用时间达到72 h,PRRSV-N基因mRNA表达量与病毒对照相比差异非常显著(P<0.001),双黄连水煎液能够有效抑制PRRSV的复制,且具有时间依赖性和剂量依赖性(图5和图6)。
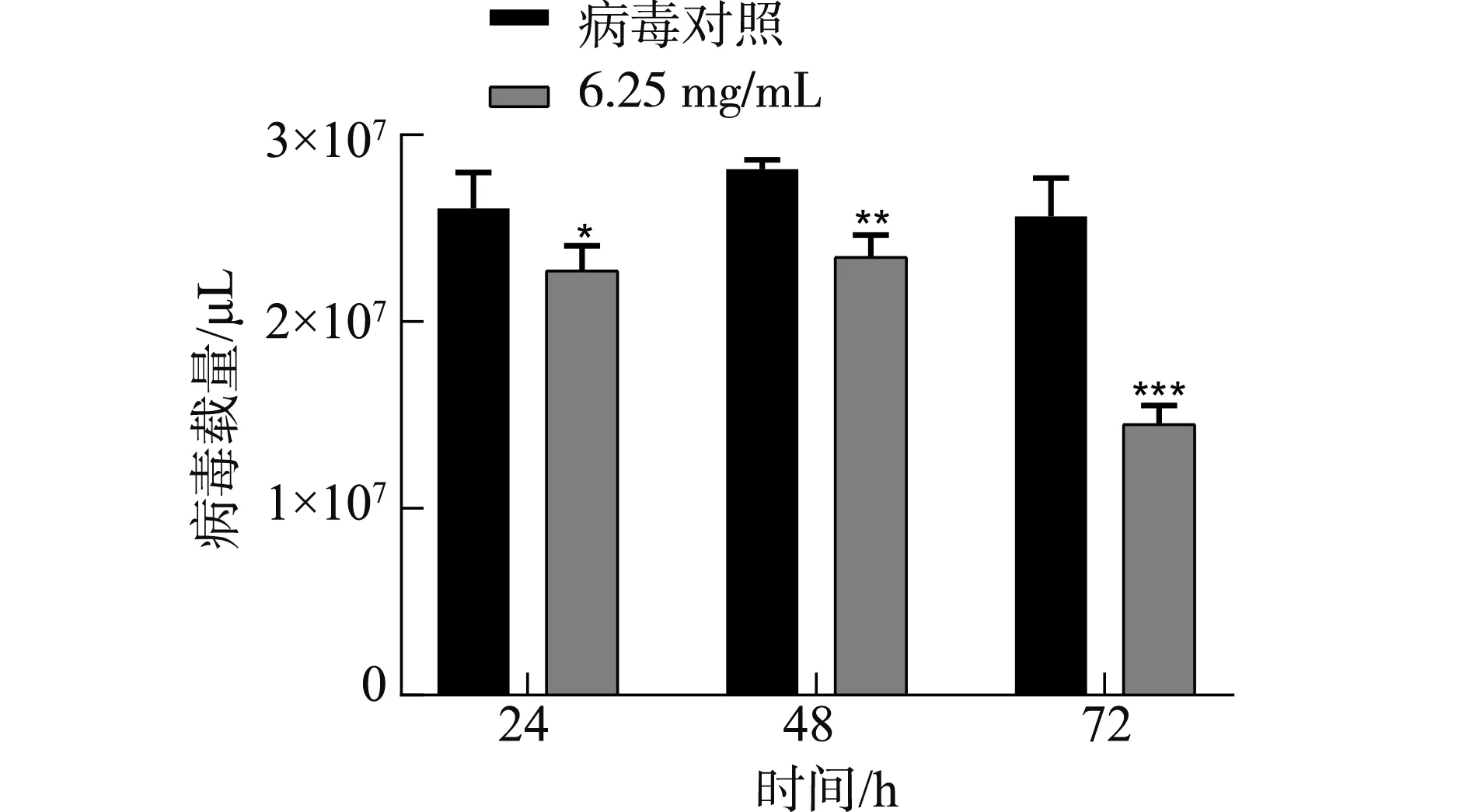
注:*P<0.05表示差异显著,** P<0.01表示差异极显著,***表示差异非常显著P<0.001。Note: *P<0.05 means significant difference, ** P<0.01 means extremely significant difference, *** P<0.001 means very significant difference.图5 双黄连水煎液对PRRSV的抑制复制作用Fig.5 Inhibitory effect of Shuanghuanglian decoction on PRRSV replication
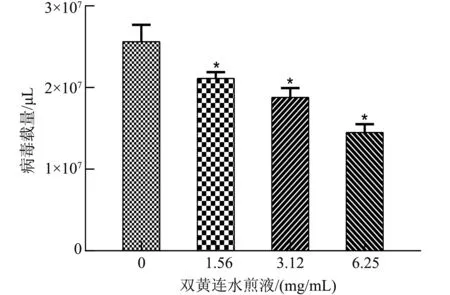
注:*P<0.05表示差异显著。Note: *P<0.05 means significant difference.图6 不同质量浓度双黄连水煎液对PRRSV的抑制复制作用Fig.6 Inhibition of PRRSV replication by Shuanghuanglian decoction of different mass concentrations
2.6.2 双黄连水煎液对PRRSV的阻断吸附效果 与病毒对照相比,PRRSV-N基因mRNA表达量差异极显著(P<0.01),见图7;随着双黄连水煎液质量浓度的增加,PRRSV-N基因mRNA表达量逐渐降低(图8),当双黄连水煎液质量浓度达到6.25 mg/mL时,与病毒对照相比差异极显著(P<0.01),表明双黄连水煎液能够阻断PRRSV对Marc-145细胞的吸附。
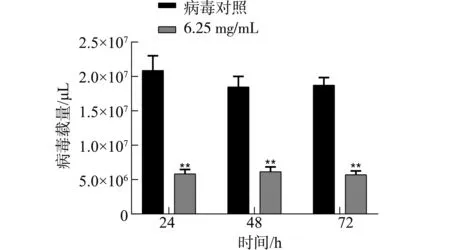
注:** P<0.01表示差异极显著。Note: ** P<0.01 means extremely significant difference .图7 双黄连水煎液对PRRSV的阻断吸附作用Fig.7 Inhibition of PRRSV adsorption by Shuanghuanglian decoction
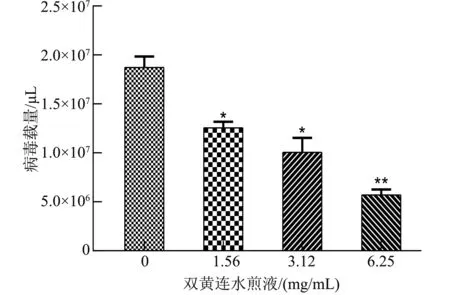
注:*P<0.05表示差异显著,** P<0.01表示差异极显著。 Note: *P<0.05 means significant difference, ** P<0.01 means extremely significant difference.图8 不同质量浓度双黄连水煎液对PRRSV的阻断吸附作用Fig.8 Inhibition of PRRSV adsorption by Shuanghuanglian decoction with different mass concentrations
2.6.3 双黄连水煎液对PRRSV病毒粒子的直接杀灭效果 双黄连水煎液对PRRSV病毒粒子的直接杀灭效果见图9和图10。与病毒对照相比,PRRSV-N基因mRNA表达量差异不显著(P>0.05),表明双黄连水煎液对PRRSV病毒粒子没有影响。
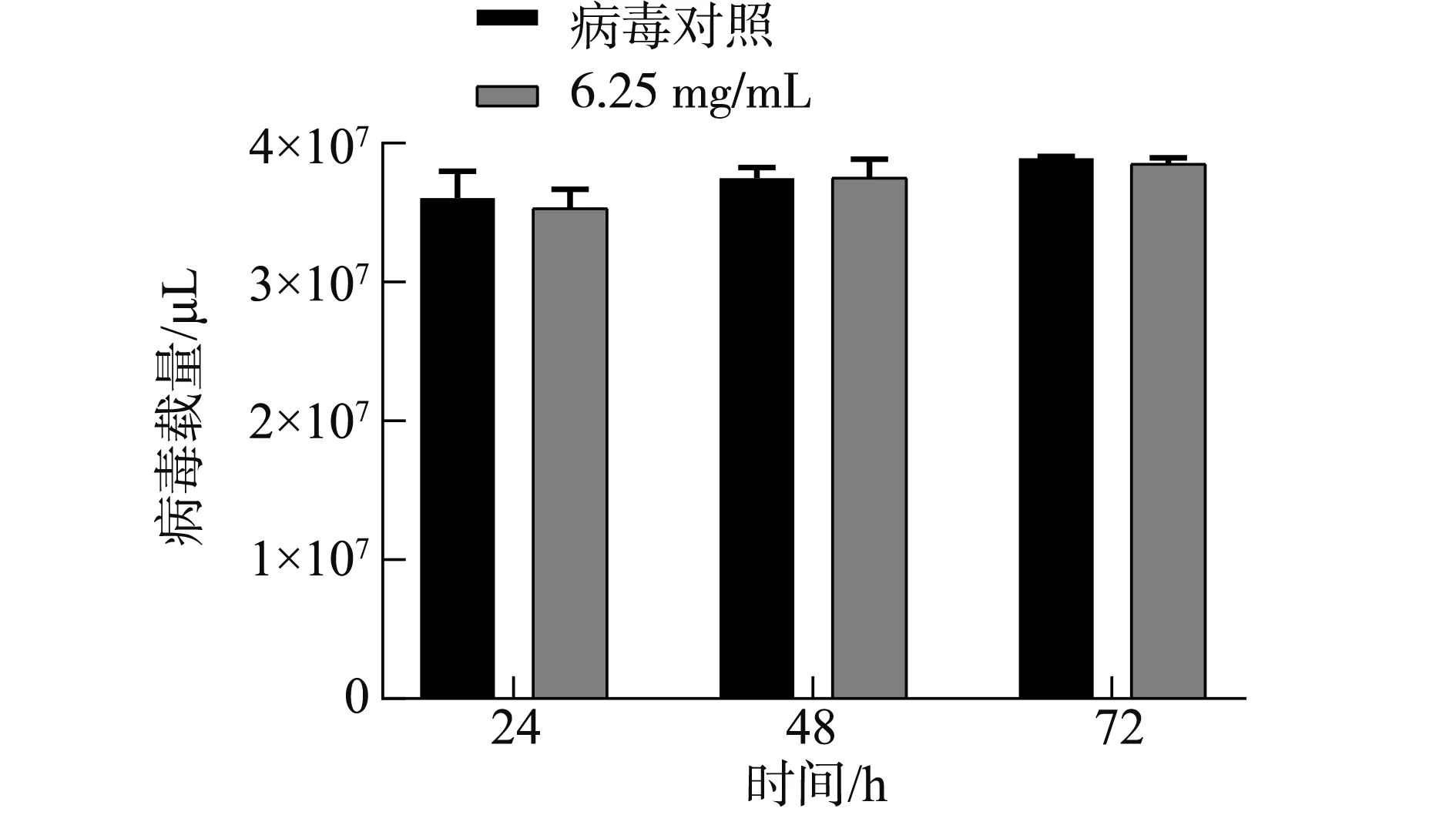
图9 双黄连水煎液对PRRSV的直接杀灭作用Fig.9 Direct killing effect of Shuanghuanglian decoction on PRRSV
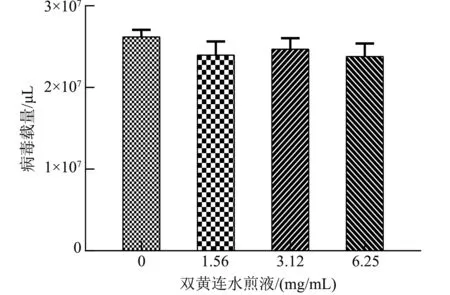
图10 不同质量浓度双黄连水煎液对PRRSV的直接杀灭作用Fig.10 Direct killing effect of Shuanghuanglian decoction with different mass concentration on PRRSV
3 讨 论
近几十年来,中国PPRS的广泛爆发与病毒的高频率重组和免疫抑制的不断进化有关,现有疫苗对PRRS的保护性免疫仅对同源感染有效,对异源PRRSV的感染不能起到良好的保护作用,因此寻找新的抗病毒治疗策略迫在眉睫。
试验前期建立荧光定量PCR方法,其扩增效率102.668%,决定系数大于0.999,变异系数小于3%,均符合荧光定量PCR标准曲线建立需要满足的3个参数条件[16]。并对当前比较常见的猪博卡病毒和猪圆环病毒等进行特异性检测,证实所建立方法的准确性和特异性。对比普通PCR方法,该试验建立的荧光定量PCR方法不仅可以定量、还可以提高检测的特异性,适用于临床检测,是国际公认检测病毒的黄金标准[17]。
PRRSV通过膜蛋白受体介导的内吞过程感染宿主,包括病毒附着和结合,膜融合和内化[18-19]。 一旦病毒基因组(单链正向RNA)被释放到细胞质中,它就会进行翻译,从而进行复制并产生转录复合体。该试验首先通过CCK8法筛选出双黄连水煎液对Marc-145细胞最大安全质量浓度6.25 mg/mL,然后通过对PRRSV进行直接杀灭、抑制病毒复制、阻断病毒吸附试验,分析双黄连水煎液是否影响PRRSV的生命周期。阻断病毒吸附试验表明双黄连水煎液预处理会降低Marc-145细胞对病毒的敏感性,影响病毒的附着。双黄连水煎液在6.25 mg/mL作用72 h时显著抑制PRRSV复制(P<0.05)。双黄连水煎液对PRRSV复制阶段的抑制作用更为明显。
黄芩、金银花、连翘这三味中药单独使用都具有抗病毒的功效,尤其是对于呼吸道病有良好的治疗效果。该试验提取双黄连水煎液,对其体外抗PRRSV效果进行初步研究,并显示出体外抗PRRSV能力。然而药物的抗病毒活性尚未在体内得到进一步评估,而且中药复方水煎液成分复杂,有效成分不明确,在阐明其作用机制和新药研发方面还有很多的缺陷尚待解决[20]。
