mpMRI联合99mTc-PSMA SPECT/CT检测前列腺癌新辅助雄激素剥夺治疗后显著残留病灶的价值研究
2022-03-08周冰妮刘晓航顾丙新周良平顾雅佳
周冰妮,刘晓航,顾丙新,周良平,顾雅佳
1.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032
前列腺癌仍然是全世界男性常见的癌症之一,也是导致癌症相关死亡的第二大常见原因[1]。多参数磁共振成像(multiparametric magnetic resonance imaging,mpMRI)已发展成为前列腺癌检查、分期、疗效监测的重要工具,但雄激素剥夺治疗(androgen deprivation therapy,ADT)后前列腺腺体纤维化,信号广泛减低,使得mpMRI对治疗后残留病灶的诊断受到限制[2-3]。而前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)靶向正电子发射体层成像(positron emission tomography,PET)/计算机体层成像(computed tomography,CT)或MRI可显著提高原发性和复发性前列腺癌的检出率[4-5]。目前,国内外靶向PSMA前列腺癌分子影像方法应用最为广泛的是68Ga-PSMA PET/CT检查[6-8],但PET/CT设备昂贵,普及率低,而单光子发射计算机体层成像(single photon emission computed tomography,SPECT)因仪器设备较低廉,单光子核素99mTc物理性能优良、成本合理,普及率高,临床应用更方便、更广泛。有学者[9]研究99mTc-PSMA SPECT/CT在前列腺癌检查中的价值,发现其病灶检出率与68Ga-PSMA PET/CT相近。然而也有研究[10]表明ADT后病灶最大标准摄取值显著降低,可能会影响治疗后病灶的检出。本研究旨在探索mpMRI联合99mTc-PSMA SPECT/CT在检查新辅助ADT后显著残留病灶中的临床价值。
1 资料和方法
1.1 临床资料
回顾收集2017年3月—2021年7月在复旦大学附属肿瘤医院接受新辅助ADT的前列腺癌患者资料。纳入标准:①接受系统性经直肠超声(transrectal ultrasonography,TRUS)引导下前列腺穿刺活检证实的前列腺癌患者。在接受根治性前列腺切除术(radical prostatectomy,RP)前行新辅助ADT;② 新辅助ADT后、RP术前2周内行99mTc标记PSMA小分子抑制剂(HYNIC-Glu-Urea-A,简称99mTc-PSMA)SPECT/CT及MRI检查;③MRI影像序列完整,包括T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、弥散加权成像(diffusion-weighted imaging,DWI)和动态对比增强(dynamic contrast enhancement,DCE)序列;④ 接受RP治疗,获得术后病理学检查结果。排除标准:①RP治疗前进行过放射治疗、消融治疗或栓塞、化疗、免疫治疗;② 处于急性感染期、发热期;③不能完成SPECT/CT或MRI检查。最终纳入154例患者,新辅助ADT 3~5个月的患者为90例,6~8个月39例,9~11个月14例,12个月及以上11例,其中12例患者同时接受经尿道前列腺电切术。
1.2 MRI检查及诊断
MRI检查采用美国GE公司的SIGNA Pioneer和SIGNA Architect 3.0 T扫描仪,16通道相控阵表面线圈。患者取仰卧位,扫描范围以前列腺中央部为中心,行前列腺整体扫描,检查前排便,适度充盈膀胱。扫描参数:T1WI采用快速自旋回波序列,重复时间(repetition time,TR)/回波时间(echo time,TE)为673/10 ms,激励次数(number of excitation,NEX)为1,层厚5 mm,层间距1 mm,视野(field of vision,FOV)为360 mm×200 mm;T2WI包括横轴面、冠状面,采用快速自旋回波序列,TR/TE为3 265/85 ms,NEX为3,层厚4 mm,层间距0.5 mm,FOV为220 mm×200 mm;DWI采用小视野高清序列,TR/TE为5 426/81 ms,FOV为200 mm×100 mm,层厚4 mm,层间距1 mm,b值为0、50和1 000 s/mm2;DCE扫描采用容积超快速三维成像序列,TR为5.4 ms,TE为1.6 ms,FOV为340 mm×200 mm,层厚4.0 mm,经手背静脉以压力注射器3 mL/s流速注射钆喷替酸葡甲胺(Gd-DTPA),连续行18期扫描,单期扫描时间为11 s。
由2位分别具有5和10年泌尿系统影像学诊断经验的影像科医师参考前列腺局部复发磁共振成像报告评分(Prostate Magnetic Resonance Imaging for Local Recurrence Reporting,PI-RR)中放射治疗后复发的标准对病灶进行评分[11](表1)。评分以DWI和DCE为主序列,两者中得分最高的序列决定最终评分,如两个序列中可疑病灶的位置相匹配,则从评分 PI-RR 4升级到PI-RR 5。T2WI图像不参与最终评分,而是用于辅助识别良性前列腺增生结节、定位可疑病变,并与治疗前图像进行比较。1~2分表示局部残留可能性低,3~5分表示局部残留可能性高。意见不一致时经讨论后达成一致。多病灶的患者,以最高评分病灶的分数为患者评分。

表1 前列腺癌放射治疗后磁共振各序列评分Tab.1 Assessment categories by magnetic resonance imaging sequence after radiation therapy
1.3 99mTc-PSMA SPECT/CT显像及图像分析
99mTc-PSMA标记方法和质量控制详见参考文献[12-13]。全身平面显像:采用美国GE公司的Discovery NM/CT 670单光子发射断层及X射线计算机体层摄影成像系统配低能高分辨平行孔准直器。检查取仰卧位。扫描参数:能峰140 keV,窗宽20%;采集矩阵256×1 024,采集床速为15 cm/min,行全身前位和后位同时扫描。全身扫描结束后,患者取仰卧位,双上肢抱头,探头尽量贴近躯体,进行腹盆部SPECT/CT显像。扫描参数:先常规低剂量CT采集,后SPECT断层采集,矩阵128×128,放大倍数为1,探头旋转360°,30 s/帧,共60帧。经迭代重建后,用Entegra(GE Medical Systems)软件处理[12]。
PSMA阳性灶判断标准:SPECT图像表现为放射性摄取高于正常组织者,并排除生理性摄取或分布(涎腺、眼眶、肝脏、胆囊、脾脏、小肠、肾脏及膀胱),不论同机CT有无解剖形态异常,均将其视为病灶;同机CT表现异常但相应部位未见放射性异常摄取,均视为PSMA阴性病灶或非前列腺癌来源病灶[12]。
1.4 病理学分类
研究[14]表明前列腺癌治疗后完全缓解和微残留患者的预后相似,均明显好于有显著残留病灶的患者,因此将RP术后标本分为显著残留和完全缓解/微残留两组。完全缓解病理学特征为腺体体积减小、腺体密度降低和腺周密度增加以及癌细胞几乎完全变性等[15]。当存在残留病灶,最大横截面小于5 mm时为微残留,最大横截面>5 mm时为显著残留。
1.5 统计学处理
使用SPSS 20.0和Medcalc19.6软件进行统计分析。根据术后病理学检查结果分为显著残留组和完全缓解/微残留组。符合正态分布的数据以表示,非正态分布的数据以M(P25,P75)表示。符合正态分布的连续变量比较采用独立样本t检验分析,等级资料及非正态分布的连续变量采用Mann-WhitneyU检验分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估两种检查方式单独使用及联合应用时对显著残留病灶的诊断效能,采用Z检验比较ROC曲线的曲线下面积(area under curve,AUC)的差异。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
本研究共纳入154例患者,其中术后病理学检查证实显著残留组128例、完全缓解/微残留组26例。患者年龄47~85岁,平均年龄(66.88±7.79)岁,中位年龄68岁。两组患者年龄、初始PSA、Gleason评分差异无统计学意义(P>0.05);而治疗后PSA显著残留组明显高于完全缓解/微残留组,差异有统计学意义(P<0.05,表2)。
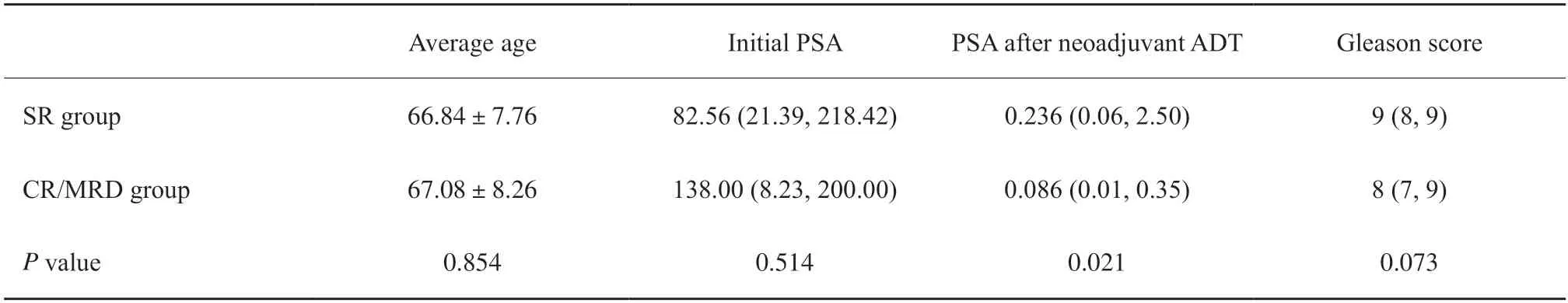
表2 显著残留组与完全缓解/微残留组的一般资料比较Tab.2 Comparison of general information between the significant residual group and complete response or minimum residual disease group
2.2 MRI、99mTc-PSMA SPECT单独使用及联合应用对显著残留病灶的诊断效能
表3、4分别为显著残留组和完全缓解/微残留组PI-RR评分分布及99mTc-PSMA SPECT/CT的检出情况。MRI、99mTc-PSMA SPECT/CT单独使用及联合应用对显著残留病灶的诊断效能见图1。MRI诊断前列腺癌新辅助ADT后显著残留的AUC值为0.713,以PI-RR评分3为界值时灵敏度为78.13%,特异度为30.77%,以PI-RR评分4为界值时灵敏度为68.75%,特异度为69.23%。99mTc-PSMA SPECT/CT诊断病灶残留的AUC值为0.729,灵敏度为76.56%,特异性为69.23%。两种方法AUC值差异无统计学意义(P>0.05)。MRI联合99mTc-PSMA SPECT/CT使用的AUC为0.809,显著高于两者单独使用(Z=2.096,P=0.036 1,Z=3.130,P=0.001 7,图2、3)。
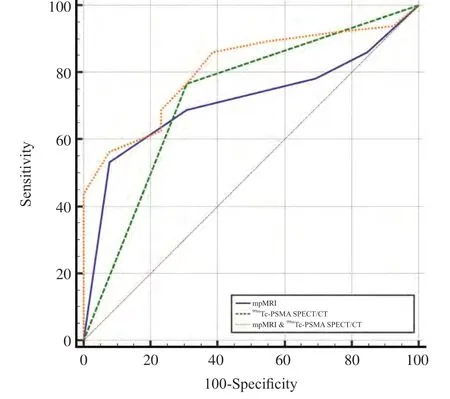
图1 mpMRI、99mTc-PSMA SPECT/CT单独使用及联合运用下ROC曲线Fig.1 ROC curves of mpMRI,99mTc-PSMA SPECT/CT used alone and in combination
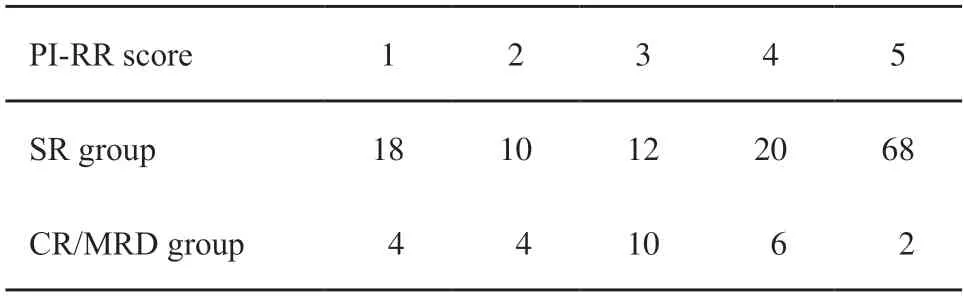
表3 显著残留组和完全缓解/微残留组PI-RR评分分布Tab.3 PI-RR scores in the significant residual group and complete response or minimum residual disease group
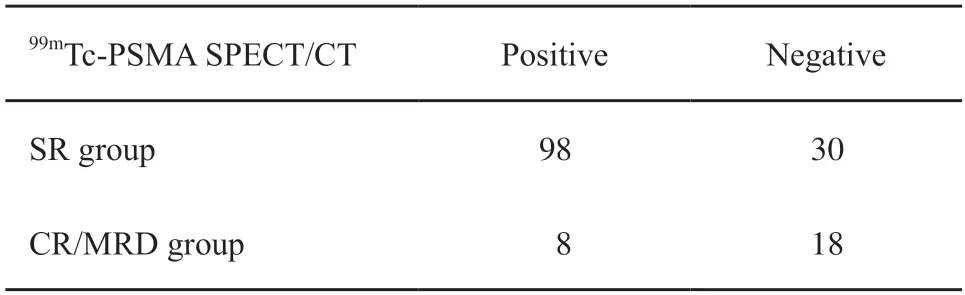
表4 显著残留组和完全缓解/微残留组99mTc-PSMA SPECT/CT的检出情况Tab.4 The detection of 99mTc-PSMA SPECT/CT in the significant residual group and complete response or minimum residual disease group
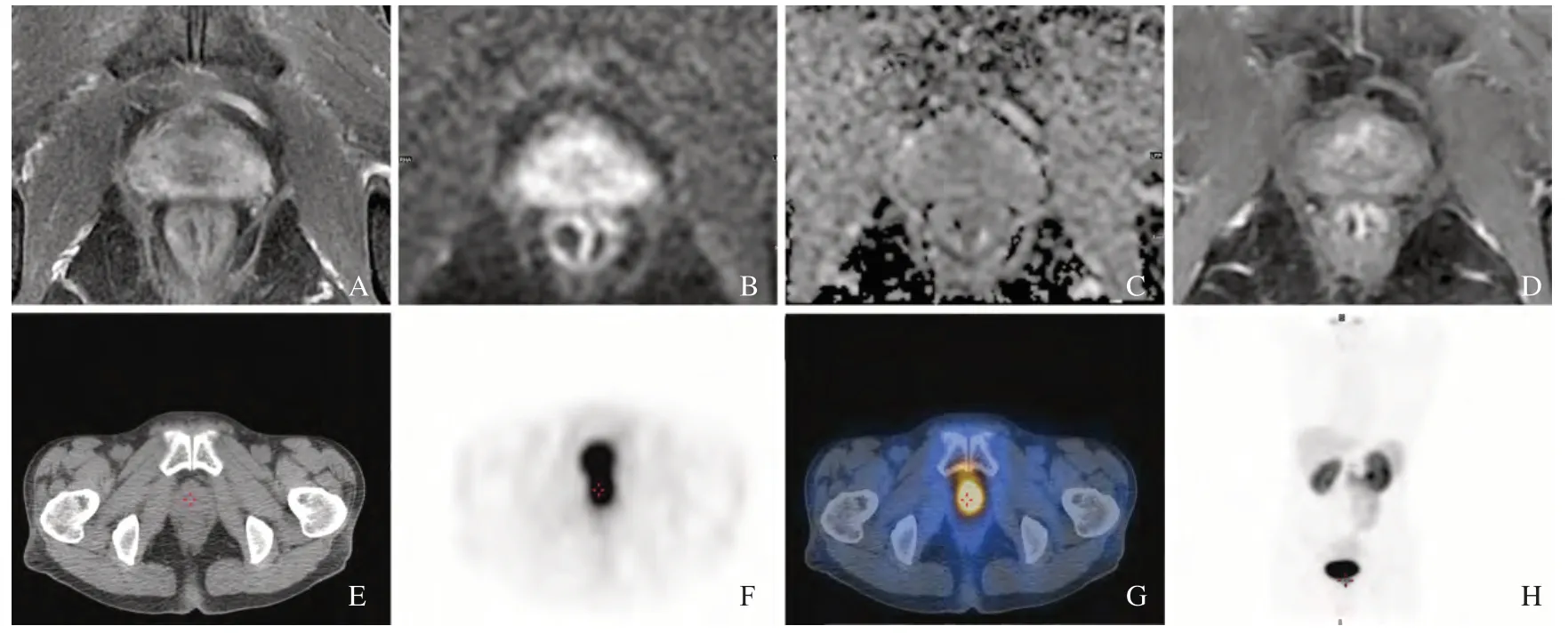
图2 mpMRI、99mTc-PSMA SPECT/CT检测前列腺癌新辅助雄激素剥夺治疗后显著残留Fig.2 mpMRI combined with 99mTc-PSMA SPECT/CT to detect significant residual prostate cancer after neoadjuvant androgen deprivation treatment
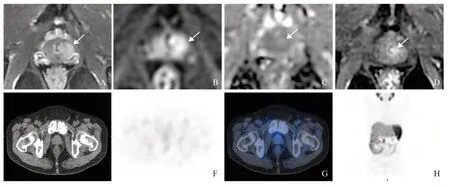
图3 mpMRI、99mTc-PSMA SPECT/CT检测前列腺癌新辅助雄激素剥夺治疗后显著残留Fig.3 mpMRI combined with 99mTc-PSMA SPECT/CT to detect significant residual prostate cancer after neoadjuvant androgen deprivation treatment
3 讨论
mpMRI在前列腺癌的诊断、鉴别诊断中具有重要意义,影像学特征联合定量分析对初诊临床显著前列腺癌的诊断效能可达0.9左右[16-17]。而本研究结果显示mpMRI诊断新辅助ADT后残留的AUC值为0.713,低于初诊前列腺癌,可能与ADT对前列腺的影响相关。ADT后前列腺腺体萎缩、纤维化导致T2WI上前列腺组织的信号降低,从而影响病灶边缘的区分及肿瘤病灶的检出[18-19];前列腺腺体的体积及密度减低,分布更疏松,其表观弥散系数值显著减低,而肿瘤病灶的表观弥散系数值没有明显变化[19];血供变化方面,ADT会导致前列腺组织中的血供减少,而残留肿瘤病灶的血管增加[20-22]。ADT后前列腺腺体及瘤灶均发生明显形态及病理学改变,从而影响了mpMRI对治疗残留病灶的检出,根据传统影像学诊断经验诊断ADT后病灶残留、复发的效能仅为0.5,运用人工神经网络建立诊断模型的诊断效能为0.54~0.85[3,23]。因ADT后前列腺正常腺体及病灶变化与放疗后改变相似,故本研究参考PI-RR放疗后图像评分标准,以DWI和DCE序列为评估主序列,以T2WI图像辅助识别良性前列腺增生结节、定位可疑病变,并与治疗前图像进行比较,尝试进行新辅助ADT后图像评分,结果显示诊断效能高于上述研究的常规经验诊断及部分人工神经网络诊断模型。因此,本研究推测PI-RR评分标准在前列腺癌ADT及放疗后显著残留、复发病灶的检测方面有良好临床应用价值。与此同时,根据PI-RR评分标准,1~2分表示局部残留可能性低,3~5分表示局部残留可能性高,本研究中以3分为界值时,MRI诊断灵敏度高达78.13%,而以4分为界值则特异度高达69.23%。目前基于PI-RR的研究少见,本研究样本量较小,因而界值的选择仍有待今后大样本、多中心的研究。
PSMA是存在于前列腺上皮细胞膜的Ⅱ型跨膜糖蛋白,在正常前列腺及前列腺增生细胞中表达较低,但在几乎所有前列腺癌细胞表面高表达,且在低分化、转移性和雄激素非依赖型前列腺癌细胞中表达进一步增加,与前列腺癌去势治疗抵抗、生化复发等密切相关,是前列腺癌的理想分子靶点[24-25]。目前68Ga-PSMA PET/CT检查在国内外靶向PSMA前列腺癌分子影像学诊断中应用最为广泛,然而普及率低,设备及核素制备费用远高于99mTc-PSMA SPECT/CT。与此同时,研究[9,25-27]表明,与68Ga-PSMA PET/CT检查相比,99mTc-PSMA SPECT/CT可以获得膀胱中更大的放射性示踪剂尿清除率和更好的肿瘤背景比率,因此前列腺、前列腺床在图像中能更好地实现可视化,前列腺病灶的检出率与68Ga-PSMA PET/CT相近,而总体病灶检出效能为78%~91%。本研究中99mTc-PSMA SPECT/CT诊断效能为0.729,略低于既往研究,可能与本研究目标病灶仅包含新辅助ADT后前列腺区残留病灶、不包含转移灶相关。与此同时,ADT对病灶PSMA表达的影响尚不完全清楚,部分研究[28-29]表明ADT后PSMA表达增高,而另一些研究[10]表明ADT后病灶最大标准摄取值显著降低。不同的结果可能与ADT时间相关,短期ADT会增加PSMA表达,长期ADT会降低PSMA配体的摄取[30]。本研究中部分患者在新辅助ADT前未行99mTc-PSMA SPECT/CT检查,因此病灶治疗前后摄取的改变、ADT对99mTc-PSMA SPECT/CT检测残留病灶的影响仍有待进一步研究。
mpMRI与99mTc-PSMA SPECT/CT在诊断新辅助ADT后显著残留病灶中能提供不同的有效诊断信息,互为补充,以PI-RR评分3为界值时mpMRI灵敏度高于99mTc-PSMA SPECT/CT,而99mTc-PSMA SPECT/CT诊断特异度高于mpMRI。两者联合应用时可以显著地提高诊断效能,有助于治疗后显著残留病灶的监测。
本研究存在以下局限性:回顾性分析可能存在一定的选择偏倚;样本量较小,研究结果仍有待今后大样本、多中心研究的支持;部分患者在新辅助ADT前未行99mTc-PSMA SPECT/CT检查,ADT对病灶PSMA表达的影响有待进一步研究。
综上所述,mpMRI与99mTc-PSMA SPECT/CT均能用于诊断新辅助ADT后显著残留病灶,两者联合应用时可以显著地提高诊断效能,为前列癌新辅助ADT后精准诊疗提供帮助。
利益冲突声明:所有作者均不存在利益冲突。
