培哚普利对糖皮质激素诱导的MSCs凋亡及成骨分化的影响
2022-03-08朱治同李泽平董立明
朱治同 李泽平 董立明
遵义医科大学附属医院骨一科,贵州 遵义 563000
糖皮质激素(glucocorticoids,GCs)是目前多种慢性疾病及自身免疫性疾病如类风湿关节炎、炎性肠病、慢阻肺等的首选药,数据[1-2]显示,全球约1%~2%患者长期接受GCs治疗,大剂量或长期低剂量使用GCs易导致继发性骨质疏松等严重副作用。虽然骨质疏松症已得到临床上的广泛认知,但对其干预性治疗措施仍需做深入研究。研究[3]表明,GCs促使成骨活动受抑制是导致骨质疏松的原因之一。培哚普利属于血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI),可降低心脏负荷,延缓心血管重塑等,研究[4-5]证实,其可以增加骨量或骨密度,治疗骨质疏松及降低骨折风险。正常生理状态下,骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)可分化为成骨细胞,使得成骨与骨吸收代谢处于稳态[6]。但目前有关培哚普利治疗骨质疏松症的具体作用机制研究鲜有报道,因此本研究拟探讨培哚普利对GCs诱导的MSCs凋亡及成骨分化的影响,并分析相关机制,以期为GCs诱导骨质疏松症的预防及治疗提供新的参考依据。
1 材料与方法
1.1 材料
人骨髓间充质干细胞株MSCs(货号BNCC100385)购自北京北纳创联生物技术研究院;DMEM-F12培养基(货号GNM-12500-S)、间充质干细胞-成骨诱导分化培养基(货号7531)购自上海中乔新舟生物科技有限公司;3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑蓝(MTT)(批号:1120-02-1)均购自美国sigma公司;AnnexinV-FITC/PI细胞凋亡双染试剂盒(货号556547)均购自上海谷研实业有限公司;反转录试剂盒(RP1105-100 T)、AceQqPCR SYBR Green Mix(ALH185)、Trizol Reagent核酸分离试剂(YT526)购自北京百奥莱博科技有限公司;兔抗人半胱氨酰天冬氨酸特异性蛋白酶3(cysteiny aspartate specific protease3,cleaved Caspase-3,货号AF488))、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2,货号BYFG-70R-36053)、兔抗人Bcl-2相关蛋白(Bcl-2-associated X Protein,Bax,货号FNab00811)、碱性磷酸酶(alkaline phosphatase,ALP,货号ab83259)、Ⅰ型胶原(type Ⅰcollagen,CollagenⅠ,货号BYFG-70R-1081)、骨桥蛋白(osteopontin,OPN,货号BYFG-70R-9882)、Notch通路受体(Jagged 1,JAG1,货号BM4565)、(Jagged 2,JAG2,货号BM4565)、跨膜受体蛋白1(Notch1,货号BM4565)、跨膜受体蛋白2(Notch2,货号BYFG-70R-30786)、下游靶基因(hairy and enhancer of split1,Hes1,货号BM4565)、HRP标记山羊抗兔二抗(货号GB23303)抗体均购自东莞市润博生物科技有限公司;CO2培养箱(型号NHD DYE1738)购自日本sanyo公司;Elx800酶标仪(型号HSG9832)购自美国Thermo公司;荧光定量PCR仪(型号C1000)购自美国Bio-rad公司。
1.2 方法
1.2.1细胞培养:复苏MSCs细胞,培养于含10 %灭活FBS的DMEM-F12培养基中,于37 ℃、5 % CO2、95 % O2的培养箱中进行传代培养,待对数生长期时用于后续实验。
1.2.2细胞分组及处理:取1.2.1对数生长期的MSCs细胞重悬并接种于24孔板(2.5×105个/孔)。将细胞分为5组(均设6个复孔):(1)空白对照组:只含MSCs细胞用无血清培养基处理48 h;(2)DEX组:加入含106mol/L DEX溶液[7]的无血清培养基处理48 h;(3)培哚普利低、中、高剂量组:加入含106mol/L DEX溶液的无血清培养基,分别与含0.01、0.1、1.0 μmol/L培哚普利[8]溶液共同孵育,继续培养48 h后,进行后续实验。
1.2.3MTT法检测MSCs增殖能力:取1.2.2各组MSCs重悬并接种至24孔板(2.5×105个/孔),各孔加20 μL MTT(5 g/L),继续培养4 h;各孔加DMSO(150 μL)振荡5 min,混匀。570 nm处测定各孔细胞光密度(optic density,OD),每组设置6个复孔,取平均值。计算细胞增殖抑制率(%)=(1-实验组OD/对照组OD)×100%。实验重复3次。
1.2.4流式细胞术检测细胞凋亡率:取1.2.2各组MSCs重悬并接种至24孔板(2.5×105个/孔),每组设置6个复孔。用预冷的PBS缓冲液清洗细胞,离心弃上清后用0.2 mL PBS将细胞沉淀混匀,70 %的冷乙醇4 ℃固定24 h以上。离心弃上清,PBS清洗,加5 μL PI+5 μL AnnexinV‐FITC混匀,4 ℃避光染色30 min、稀释,用流式细胞仪检测细胞凋亡率。实验重复3次。
1.2.5成骨诱导分化:取1.2.2各组MSCs重悬并接种至24孔板(2.5×105个/孔),每组设置6个复孔,培养细胞约80 %左右融合时更换成骨诱导培养液(含50 μmol/L左旋抗坏血酸+10 mmol/L β甘油磷酸盐+DMEM-F12培养基),15 d后进行茜素红染色,显微镜下观察成骨分化效果。
1.2.6实时荧光定量PCR法检测凋亡、成骨分化及Notch通路相关基因水平:TRIzol法提取1.2.2各组培养48 h的MSCs总RNA并测定浓度。以RNA为模板、PrimeScript RT reagent试剂盒说明书为操作标准进行逆转录合成cDNA。体系20 μL:ULtraSYBR mixture(10 μL)、模板cDNA(2.0 μL)、上下游引物(各2.0 μL)、去离子纯化水(4.0 μL);条件(40个循环):93 ℃ 30 s、93 ℃ 5 s、65 ℃ 30 s。引物序列详见表1,由苏州泓迅生物科技股份有限公司设计并合成。采用2-ΔΔCt方法计算各基因mRNA水平相对表达量。

表1 引物序列Table 1 Primer sequence
1.2.7蛋白免疫印迹法检测凋亡、成骨分化相关蛋白及Notch通路蛋白表达情况:收集1.2.2各组MSCs,加入RIPA裂解液提取总蛋白并检测浓度及纯度,取20 μg蛋白上样于12 % SDS-PAGE进行分离,将各蛋白转至PVDF膜,放入脱脂奶粉(5 %)溶液室温封闭2 h,分别加入一抗凋亡相关蛋白(Bax、Bcl-2、cleaved Caspase-3)、成骨分化相关蛋白(ALP、CollagenⅠ、OPN)、Notch通路蛋白(JAG1、JAG2、Notch1、Notch2、Hes1、Hey1),内参β-actin,稀释比均为(1∶500)作为一抗,4 ℃孵育过夜,TBST清洗,加入HRP标记山羊抗兔二抗(1∶1 000),室温孵育1 h,显影、定影、成像,半定量分析各蛋白含量。
1.3 统计学方法
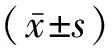
2 结果
2.1 培哚普利对MSCs增殖的影响
与空白对照组[(12.33±1.85)%]比较,DEX组[(43.87±6.58)%]MSCs增殖抑制率显著升高(P<0.05);与DEX组比较,培哚普利低[(35.37±5.31)%]、中[(25.62±3.85)%]、高[(17.96±2.69)%]剂量组MSCs增殖抑制率显著降低(P<0.05),呈剂量依赖性。
2.2 培哚普利对MSCs凋亡的影响
与空白对照组[(15.27±2.33)%]比较,DEX组[(40.22±6.03)%]MSCs凋亡率显著升高(P<0.05);与DEX组比较,培哚普利低[(33.40±5.01)%]、中[(25.05±3.75)%]、高[(19.12±2.87)%]剂量组MSCs凋亡率显著均显著降低(P<0.05),且呈剂量依赖性。详见图1。
2.3 培哚普利对MSCs成骨分化的影响
茜素红染色结果显示,MSCs可诱导分化为成骨细胞,部分细胞呈聚集态生长,形成钙结节。与空白对照组比较,DEX组深红色钙化结节显著减少;与DEX组比较,培哚普利低、中、高剂量组深红色钙化结节显著增多。详见图2。
2.4 培哚普利对MSCs成骨分化相关基因及其蛋白表达的影响
与空白对照组比较,DEX组MSCs中ALP、CollagenⅠ、OPN mRNA及其蛋白表达显著降低(P<0.05);与DEX组比较,培哚普利低、中、高剂量组MSCs中ALP、CollagenⅠ、OPN mRNA及其蛋白表达显著升高(P<0.05),呈剂量依赖性。详见图3、表2、表3。

图1 培哚普利对MSCs凋亡的影响Fig.1 Effect of Perindopril on MSCs apoptosis

图2 培哚普利对MSCs成骨分化的影响(比例尺:100 μm)Fig.2 Effects of Perindopril on osteogenic differentiation of MSCs (scale: 100 μm)

图3 培哚普利对MSCs成骨分化相关蛋白表达的影响Fig.3 The effect of Perindopril on the expression of Osteogenic differentiation-related proteins in MSCs
2.5 培哚普利对MSCs凋亡相关基因及其蛋白表达的影响
与空白对照组比较,DEX组MSCs Bcl-2、cleaved-caspase-3 mRNA及其蛋白表达显著升高(P<0.05),Bax蛋白表达显著降低(P<0.05);与DEX组比较,培哚普利低、中、高剂量组MSCs Bcl-2、cleaved-caspase-3 mRNA及其蛋白表达显著降低(P<0.05),Bax蛋白表达显著升高(P<0.05),呈剂量依赖性。详见图4及表4和表5。

表2 成骨分化相关基因表达情况比较

表3 成骨分化相关蛋白表达情况比较

图4 培哚普利对MSCs Bcl-2、cleaved-caspase-3、Bax表达的影响Fig.4 Effect of Puli on expression of Bcl-2, cleaved-caspase-3 and Bax in MSCs cells

表4 培哚普利对MSCs Bcl-2、cleaved-caspase-3、Bax mRNA表达的影响

表5 培哚普利对MSCs Bcl-2、cleaved-caspase-3、Bax蛋白表达的影响
2.6培哚普利对MSCs JAG1/Notch通路相关基因及其蛋白表达的影响
与空白对照组比较,DEX组MSCs JAG1、JAG2、Notch1、Notch2、Hes1、Hey1 mRNA及其蛋白表达显著降低(P<0.05);与DEX组比较,培哚普利低、中、高剂量组MSCs JAG1、JAG2、Notch1、Notch2、Hes1、Hey1 mRNA及其蛋白表达显著升高(P<0.05),且呈剂量依赖性。详见图5、表6、表7。

图5 培哚普利对MSCs JAG1/Notch通路相关蛋白表达的影响Fig.5 Effect of Puli on the expression of jag1notch pathway related proteins in MSCs

表6 培哚普利对MSCs JAG1/Notch通路相关基因表达的影响Table 6 Effects of Puli on the expression of JAG1/Notch related genes in
3 讨论
正常状态下,成骨与骨吸收处于动态平衡,当骨代谢失衡时则导致骨吸收大于骨形成,成骨受抑制[9]。MSCs是一种具有分化潜能的细胞,在不同诱导条件下能够分化为成骨细胞、成软骨细胞等,研究[10]表明,其分化为成骨细胞的能力减弱是骨质疏松的发病原因之一。因此通过促进MSCs向成骨细胞分化以防治骨质疏松症仍是临床研究者研究热点之一。培哚普利是ACEI类抗高血压药物,研究[11]证实,其能够预防骨质中骨钙、骨磷及骨镁等重要成分的丢失,预防骨质疏松症。然而有关培哚普利预

表7 培哚普利对MSCs JAG1/Notch通路相关蛋白表达的影响Table 7 Effects of Perindopril on the expression of Jag1/notch pathway-related proteins in
防骨质疏松症的相关机制尚未明确。研究[12]表明,GCs诱导产生的骨骼系统疾病是继发性骨质疏松症的原因之一,因此本研究探讨了培哚普利对GCs类药物DEX诱导的MSCs凋亡及成骨分化的影响,并分析相关机制。
DEX属于GCs类,是临床常用抗炎及免疫抑制类药物,长期大量使用会引发多种代谢副作用如胰岛素抵抗、肌肉萎缩等[13]。潘吉铭等[14]的研究显示,DEX可抑制成骨细胞增殖,诱导细胞凋亡。Bcl-2、Bax是人体最主要细胞凋亡相关基因,分别发挥抑凋亡、促凋亡作用[15]。cleaved-caspase-3可将细胞阻滞在G2/M期,促进细胞凋亡[16]。本研究以106mol/L DEX为造膜剂建立细胞模型,显示与空白对照组比较,DEX组MSCs增殖抑制率、凋亡率显著升高。与既往研究结果一致,说明DEX可抑制MSCs增殖,诱导其凋亡。薛青等[17]的研究显示,培哚普利可明显上调绝经后骨质疏松伴高血压患者的骨密度并下调硬骨蛋白,改善骨质疏松症。薛青等[17]的另一项体外实验研究显示,培哚普利对体外培养的小鼠胚胎成骨细胞前体细胞MC3T3-E1增殖及分化具有促进作用。本研究结果显示,与DEX组比较,培哚普利低、中、高剂量组MSCs增殖抑制率、凋亡率均显著降低,呈剂量依赖性。说明培哚普利可能减弱DEX对MSCs增殖的抑制作用及对凋亡的促进作用。骨质疏松症的发病原因之一是MSCs成骨分化能力减弱。ALP是衡量成骨细胞分化程度的重要指标,CollagenⅠ、OPN是成骨分化成熟过程的特异性标志物[18]。姜涛等[19]的研究显示,牛膝甾酮能够促进骨质疏松乳鼠成骨分化。本研究结果显示,DEX环境下MSCs中ALP、CollagenⅠ、OPN mRNA及其蛋白表达均显著降低,当加入不同剂量培哚普利药物处理后,MSCs中ALP、CollagenⅠ、OPN mRNA及其蛋白蛋白表达均显著升高,且呈剂量依赖性。说明培哚普利可能减弱GCs对MSCs成骨分化的抑制作用。
Notch信号通路包括Notch受体如Notch1/2及功能性Notch配体如JAG1/2,JAG1/2可识别Notch1/2并分别与二者结合,使得Notch1、Notch2经两次酶切过程形成活性形式,转移至胞核,调控下游靶基因Hes1、Hey1的转录及表达从而参与细胞一系列生物学过程[20]。研究[21]证实,Notch信号通路活化能够促进成骨细胞分化。马玉等[22]的研究显示,与空白对照组比较,肿瘤坏死因子(TNF-α)组牙周干细胞骨向分化能力明显减弱,且JAG1、Notch2蛋白表达水平显著降低,提示TNF-α可能通过抑制Notch信号通路活化抑制牙周干细胞骨向分化。本研究显示,当加入不同剂量培哚普利药物处理后,MSCs中JAG1、JAG2、Notch1、Notch2、Hes1、Hey1 mRNA及其蛋白蛋白水平较DEX组显著升高,呈剂量依赖性。说明培哚普利可能拮抗DEX抑制Notch通路活化。
综上所述,培哚普利可抑制DEX诱导的MSCs凋亡,促进成骨分化,可能是通过促进Notch信号通路实现的,可为预防及治疗骨质疏松症提供一定的参考。但细胞凋亡机制较为复杂,具体调控机制仍需开展进一步的深入探讨。
