血清miR-16与新生儿败血症患儿心功能障碍及炎症反应的关系
2022-03-05祁宏亮李莎莎武彦秋赵宏伟李俊乔周启立
祁宏亮,李莎莎,武彦秋,赵宏伟,李俊乔,周启立
(1.承德医学院附属医院新生儿科,河北 承德 067000;2.承德医学院生理学教研室,河北 承德 067000)
新生儿败血症是因细菌或真菌侵入新生儿血液循环,并通过繁殖经血流扩散引起的全身性疾病,其常伴有血流动力学变化以及呼吸暂停、体温不稳、黄疸等临床表现,是全球范围内新生儿死亡的主要原因之一[1-2]。新生儿败血症可在短时间内分泌大量促炎因子,进而诱发炎症级联反应,导致全身炎症反应,增加多器官功能障碍的发生风险[3]。然而临床对于新生儿败血症炎症反应及器官功能障碍发生机制的研究仍不充分。近几年临床研究越来越关注microRNA(miRNA)与新生儿败血症病理机制的相关性,有研究发现miR-15a、miR-16与新生儿败血症密切相关,miR-15a/16基因转染下调了经毒素脂多糖(lipopolysaccharide,LPS)处理的细胞Toll样受体4(Toll-like receptor 4,TLR4)和白细胞介素-1受体相关激酶1的转录水平,并且二者可被长链非编码RNA SNHG16下调,进而逆转内毒素脂多糖诱导的炎症反应[4]。因此,本研究拟通过分析新生儿败血症样本,探讨血清miR-16与新生儿败血症患儿心功能障碍及炎症反应的相关性,以期为临床实现精准诊疗提供靶点。
1 资料与方法
1.1 临床资料
回顾性分析119例2016年1月1日至2020年6月1日于我院确诊为新生儿败血症的患儿(败血症组)临床资料,胎龄25~42周。纳入标准:①符合《新生儿败血症诊疗方案》诊断标准[5],伴有呼吸急促、心动过速或胃肠道反应等非特异性临床表现,同时实验室检查白细胞计数<5×109/L或>20×109/L,血小板计数<100×109/L,C反应蛋白(C-reactive protein,CRP)>100 mg/L;②血培养结果为革兰氏阳性细菌或革兰氏阴性细菌。排除标准:①入院前接受过抗感染治疗;②合并窒息、血液疾病或凝血功能障碍;③伴有先天性心脏病、消化道畸形等严重先天性畸形、遗传代谢疾病或免疫缺陷疾病。另选取100例同期住院的普通感染新生儿作为对照组,胎龄26~41周。2组新生儿临床资料比较,差异无统计学意义(P>0.05),见表1。根据左室射血分数(left ventricular ejection fraction,LVEF)判断住院期间患儿有无心脏收缩功能障碍,将败血症组患儿分为心功能障碍组(LVEF<50%)及无心功能障碍组(LVEF≥50%)2个亚组。本研究已获得我院伦理委员会批准(批准文号:2017028),所有新生儿的法定监护人均对本研究知情,并签署同意书。
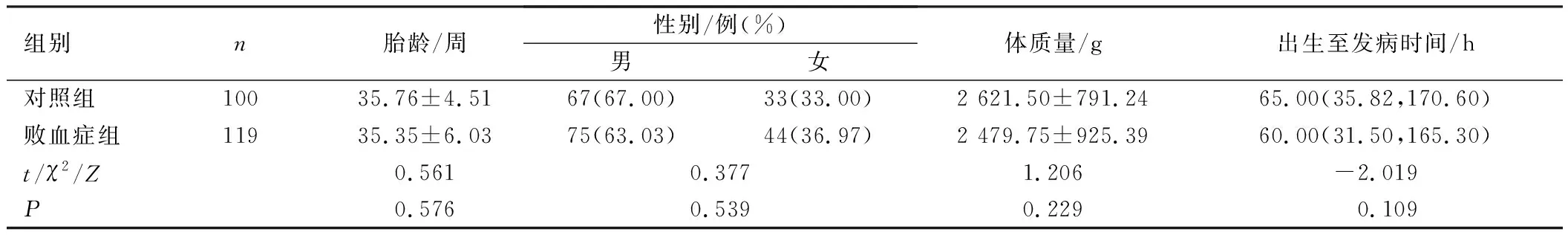
表1 2组新生儿临床资料比较
1.2 方法
1.2.1 血样采集 败血症组及对照组患儿入组后分别取外周静脉血11 mL、5 mL置于促凝管中,在室温下使用离心机以3 000 r/min离心15 min,收集上清液,再以15 000 r/min离心30 min除去细胞碎片,置于-80 ℃冰箱中储存待测。
1.2.2 血清miR-16表达检测 按照miRNeasy Serum/Plasma Kit(Qiagen公司,德国)及miRNeasy Mini Kit(Qiagen公司,德国)说明书分离血清miRNA及mRNA。采用FastQuant RT试剂盒(TianGen公司,中国)将miRNA、mRNA进行逆转录,42 ℃孵育15 min,95 ℃孵育3 min获得cDNA。使用SYBR Green PCR试剂盒(TransGen公司,中国)依照说明书在Applied Biosystems 7300 Sequence Detection系统(Applied Biosystems,美国)进行qRT-PCR,扩增条件为95 ℃变性10 min,95 ℃、30 s,58 ℃、30 s,72 ℃、30 s,共40个循环。采用U6基因作为内参基因,用2-ΔΔCT公式对表达数据进行分析,每个样本平均检测3次。miR-16引物序列:正向5’-TCGGCGTAGCAGCACGTAAAT-3’,反向5’-GTATCCAGTGCAGGGTCCGAGGT-3’;U6基因引物序列:正向5’-GCAACTAGGATGGTGTGGCT-3’,反向5’-TCCCATTCCCCAGCTCTCATA-3’。
1.2.3 血清炎症因子检测 使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测血清炎症因子CRP、白细胞介素-6(interleukin-6,IL-6)水平。
1.2.4 超声心动图及心肌损伤标志分子检测 应用GE Vivid E9彩色多普勒超声诊断仪进行超声心动图检查,取胸骨旁左心室长轴和标准心尖四腔心切面,测量QT离散度,计算Tie指数和LVEF;采用迈瑞BS-200型全自动生化分析仪检测心肌损伤标志物肌酸激酶心肌同工酶(creatine kinase isoenzyme,CK-MB)、心肌肌钙蛋白Ⅰ(cardiac troponinⅠ,cTnⅠ)、乳酸脱氢酶(lactate dehydrogenase,LDH)、心脏型脂肪酸结合蛋白(heart fatty acid-binding protein,H-FABP)水平。
1.3 统计学方法
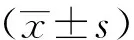
2 结果
2.1 2组新生儿血清miR-16表达水平比较
经qRT-PCR检测,败血症组患儿的血清miR-16表达水平为(1.836±0.951),显著高于对照组的(1.080±0.230),差异具有统计学意义(t=7.759,P<0.001)。
2.2 新生儿败血症患儿血清miR-16表达水平与心功能障碍的关系
败血症组患儿中有62例被诊断为心功能障碍,其余57例患儿则被纳入无心功能障碍组。2组患儿的临床资料比较,差异无统计学意义(P>0.05);心功能障碍组患儿的血清miR-16表达、IL-6、CRP、cTnⅠ、LDH、CK-MB、H-FABP水平及QT离散度、Tie指数均显著高于无心功能障碍组患儿,而LVEF则显著低于无心功能障碍组患儿,差异均有统计学意义(P<0.05),见表2。
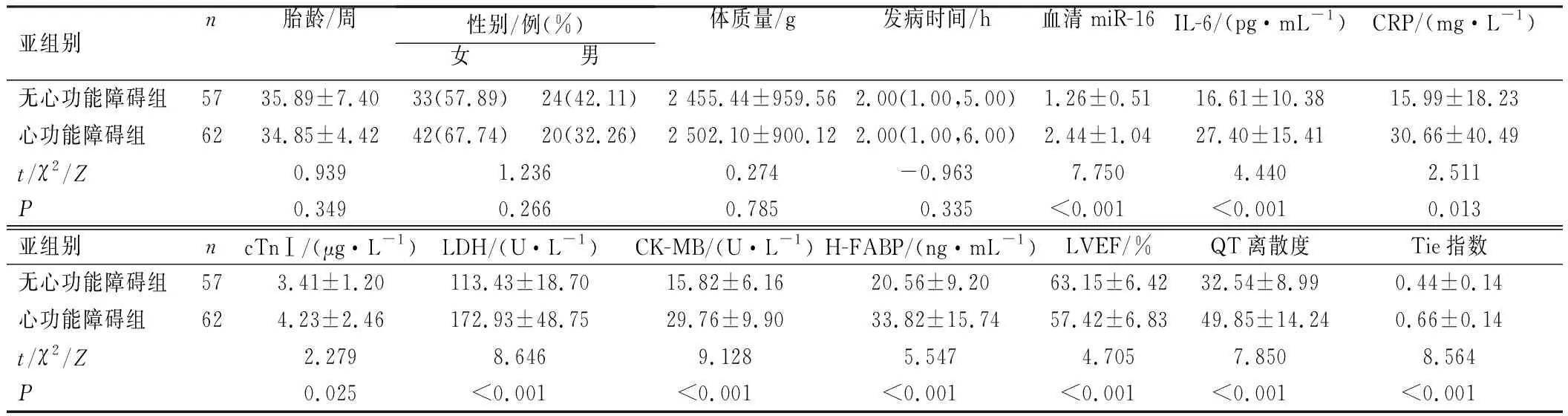
表2 心功能障碍组和无心功能障碍组新生儿基线临床资料比较
2.3 多因素Logistic回归分析新生儿败血症患儿发生心功能障碍的影响因素
经多因素Logistic回归分析,血清miR-16表达水平是新生儿败血症患儿发生心功能障碍的独立危险因素(P<0.05),见表3。
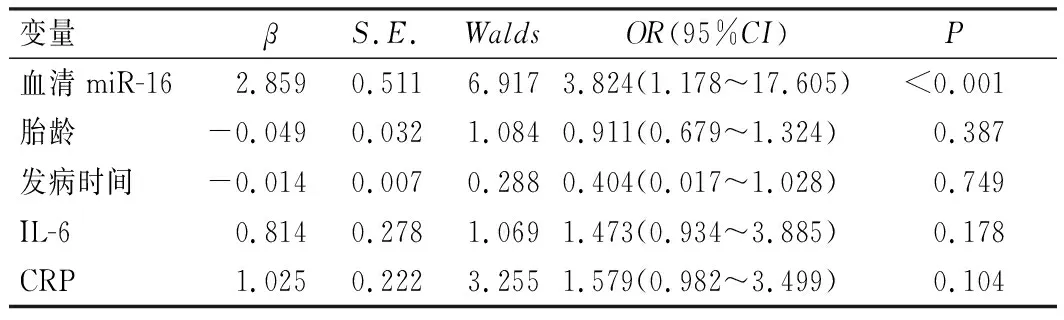
表3 多因素Logistic回归分析新生儿败血症患儿发生心功能障碍的影响因素
2.4 ROC曲线分析血清miR-16表达水平诊断新生儿败血症患儿发生心功能障碍的价值
经ROC曲线分析,采用血清miR-16表达水平诊断新生儿败血症患儿发生心功能障碍的AUC为0.901(95%CI:0.846~0.956),cut-off值为1.496,在该阈值下,特异度和灵敏度分别为80.7%和85.5%,约登指数为0.662,见图1。
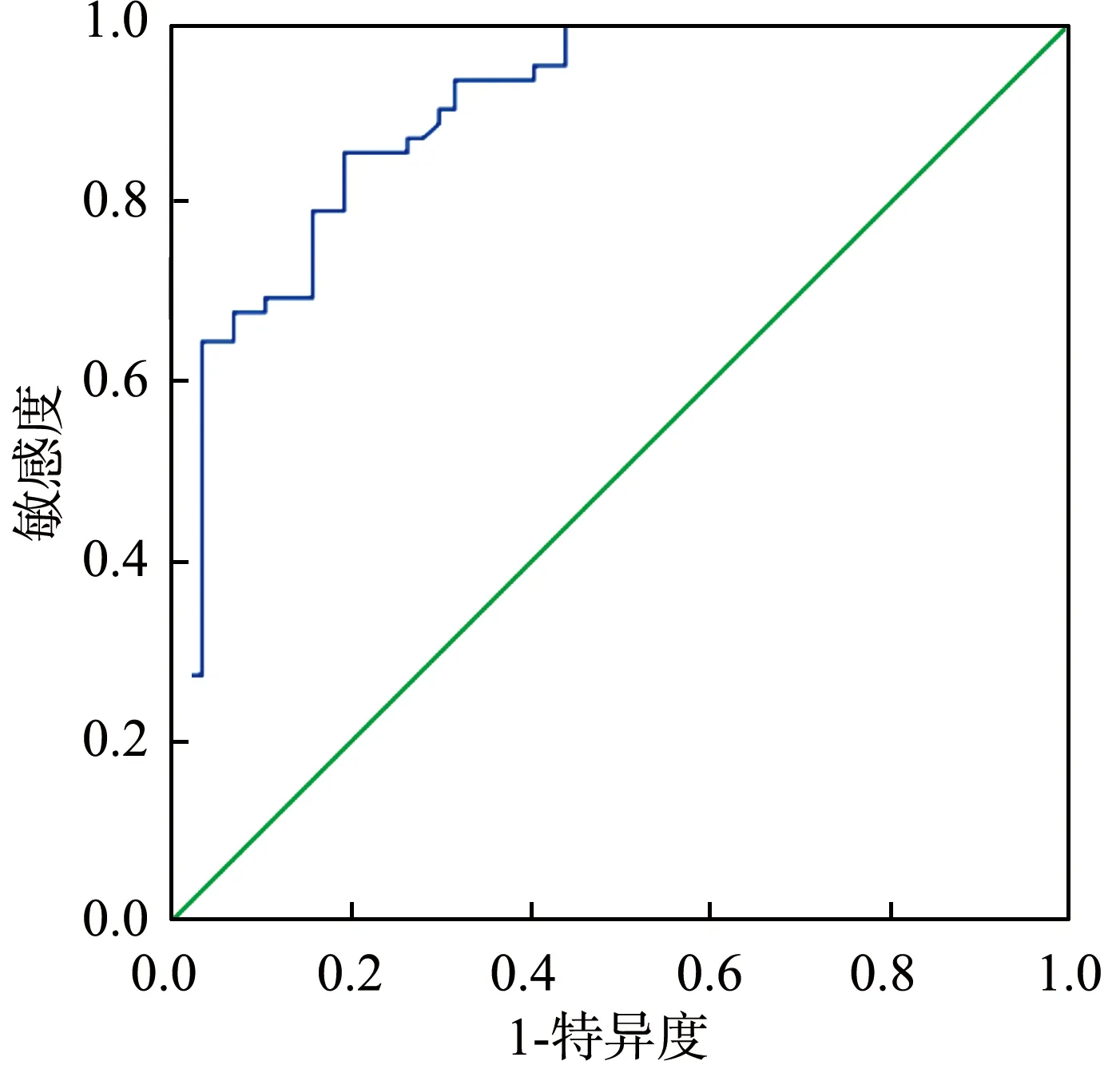
图1 血清miR-16表达水平诊断新生儿败血症患儿发生心功能障碍的ROC曲线
2.5 新生儿败血症患儿血清miR-16表达水平与炎症因子和心肌损伤标志分子水平的关系
经Pearson相关性分析,新生儿败血症患儿的血清miR-16表达水平与IL-6、CRP、cTnⅠ、LDH、CK-MB、H-FABP水平呈显著正相关性(r=0.439、0.341、0.325、0.842、0.683、0.705,P<0.001),见图2。
3 讨论
败血症是新生儿死亡的重要原因之一,由于新生儿器官还未发育成熟,且特异性及非特异性免疫反应功能低下,病菌侵入新生儿血液系统后,会大量繁殖造成全身感染性疾病,导致病情进展迅速,病死率高[6-7]。全身炎症反应为败血症病理生理过程的表现之一,大量炎症因子释放后,经血液循环进入组织、器官,从而引起器官功能障碍[3]。本研究结果显示,败血症组新生儿的血清miR-16表达水平显著高于对照组新生儿,因此我们进一步探究了血清miR-16在新生儿败血症患儿中的差异表达是否与炎症因子、心功能障碍相关。
新生儿败血症的易感性、严重程度受多方面影响,包括母体因素、环境暴露、新生儿免疫状态以及炎症反应等。革兰氏阳性菌可通过外毒素及细胞抗原启动新生儿败血症的炎症反应,革兰氏阴性菌则通过细胞壁内LPS的释放启动炎症反应。有研究表明,新生儿败血症患儿CRP、TNF-α、IL-6、PCT等多个生化、免疫学标志物的表达水平均有差异[8]。CRP为发生感染或炎症时在肝中合成的急性期蛋白,但其也在胎儿窘迫、产妇发热等情况下升高,因此特异性较低;IL-6由单核细胞及巨噬细胞响应细菌感染而产生,在炎症级联反应早期增加,同时IL-6还可引起包括分泌CRP在内的急性期反应,在败血症早期感染时就能检测到其水平增加,但IL-6半衰期较短,临床常将其与其他指标联合辅助诊断[9-10]。临床常使用上述两个指标对新生儿败血症进行辅助诊断,以减少确诊时间,同时IL-6、CRP还可反映患儿全身炎症反应程度,与新生儿败血症的发展息息相关[7]。在本研究中,血清miR-16表达水平与IL-6、CRP水平表现出显著正相关性,说明miR-16表达上调可能与机体炎症反应加重有关。
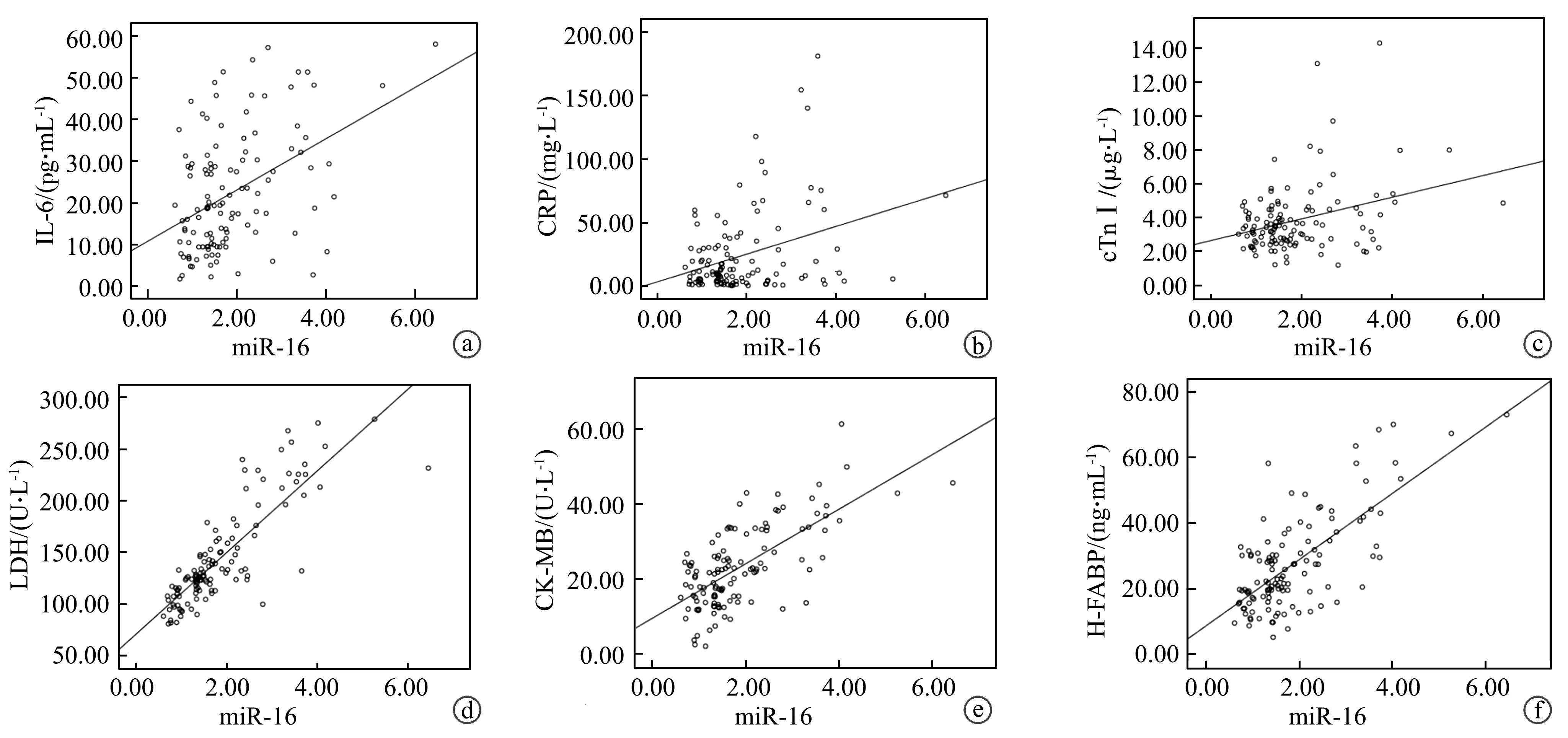
a:血清miR-16表达水平与IL-6水平的相关性;b:血清miR-16表达水平与CRP水平的相关性;c:血清miR-16表达水平与cTnⅠ水平的相关性;d:血清miR-16表达水平与LDH水平的相关性;e:血清miR-16表达水平与CK-MB水平的相关性;f:血清miR-16表达水平与H-FABP水平的相关性
既往研究证实miRNA参与免疫反应的调节,Chen等[11]发现,新生儿败血症患儿的血清miR-96-5p低表达可抑制LPS刺激RAW264.7细胞中核因子-κB(nuclear factor kappa B,NF-κB)信号通路、靶向烟酰胺磷酸核糖转移酶来减轻新生儿败血症的炎症反应。还有研究发现,miR-181a过表达有部分通过靶向TLR4抑制LPS诱导的炎症反应;miR-129-5p过表达也可下调LPS诱导的TNF-α和IL-8水平升高,减轻新生儿败血症患儿的炎症反应[12-13]。Cheng等[14]的研究也显示新生儿败血症患儿血液单个核细胞及血清中的IL-6显著上调,可能与miR-26下调有关,证实了miR-26参与新生儿败血症的发病和免疫应答。而Wang等[15]的研究中新生儿败血症患儿的miR-15a/16表达均较正常新生儿上调,同时该研究团队通过miR-15a/16模拟物瞬时转染小鼠巨噬细胞RAW264.7,证明miR-15a/16转染下调TLR4、白细胞介素-1受体相关激酶1的转录水平,western blot检测也显示miR-15a/16能抑制TLR4和白细胞介素-1受体相关激酶1的表达,说明miR-16表达与新生儿败血症炎症反应有关。有研究发现,在败血症或全身炎症反应综合征患者血清中伴有miR-15a/16高表达[16],本研究也具体分析了miR-16表达与IL-6及CRP水平的相关性,结果显示新生儿败血症患儿的血清miR-16表达水平与IL-6、CRP水平表现出显著正相关性。
心脏被认为是新生儿败血症炎症反应累及最严重的脏器,往往表现为心肌损伤、左心收缩能力下降[17]。本研究将新生儿败血症患儿分为心功能障碍组及无心功能障碍组,结果发现心功能障碍组患儿的血清miR-16表达、IL-6、CRP、cTnⅠ、LDH、CK-MB、H-FABP水平及QT离散度、Tie指数均显著高于无心功能障碍组患儿,而LVEF则显著低于无心功能障碍组,且新生儿败血症患儿的血清miR-16表达水平与cTnⅠ、LDH、CK-MB、H-FABP水平表现出显著正相关性,说明血清miR-16表达水平与新生儿败血症患儿心肌损伤密切相关;通过ROC进一步证实血清miR-16表达水平对新生儿败血症患儿心功能障碍有诊断价值。
综上所述,新生儿败血症患儿伴血清miR-16高表达,并且血清miR-16高表达与新生儿败血症患儿全身炎症反应及心脏等器官的功能障碍密切相关。血清miR-16表达水平是新生儿败血症患儿发生心功能障碍的独立临床因素,因此检测血清miR-16表达水平对新生儿败血症患儿发生心功能障碍有一定诊断价值。
