神经病理性疼痛大鼠中脑导水管周围灰质腹外侧区NLRP3炎症小体激活水平研究
2022-03-05傅丹泓彭梅静黄海英高贤伟
傅丹泓,彭梅静,黄海英,高贤伟
(1.福建中医药大学附属康复医院麻醉科,福建 福州 350003;2.福建省康复技术重点实验室,福建 福州 350003)
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体是固有免疫系统的重要成分,由核心蛋白NLRP3、连接蛋白ASC与效应蛋白Caspase-1组成,可识别病原体、应激和损伤等刺激,介导炎症因子白介素-lβ(interleukin-1β,IL-1β)与白介素-18(interleukin-18,IL-18)的成熟与释放,在脓毒症、糖尿病、动脉粥样硬化以及炎症性肠病等多种疾病中发挥重要作用[1-3]。神经病理性疼痛是由外周或中枢神经系统损伤引起的疼痛[4-6],也可由带状疱疹、糖尿病、神经损伤及自身免疫性疾病等引起[7]。神经病理性疼痛以自发性疼痛、痛觉过敏和痛觉超敏为特征,发病率为3.3%~8.2%[8],治愈率低,易复发,同时会导致患者焦虑、抑郁等,给患者带来极大的痛苦[9]。有研究发现,NLRP3炎症小体可在神经病理性疼痛中发挥重要作用,该结论在慢性坐骨神经压迫性损伤(chronic constriction injury of the sciatic nerve,CCI)动物模型中得到了初步验证[10-12]。有研究表明,中脑导水管周围灰质腹外侧区(ventrolateral periaqueductal gray,vlPAG)在神经病理性疼痛的发生发展中具有重要作用[13-16]。然而有关NLRP3炎症小体在神经病理性疼痛vlPAG中的变化情况及作用尚不明确。因此,本研究采用CCI大鼠模型对vlPAG中NLRP3炎症小体及其下游炎症因子的变化进行探索,进一步阐明神经病理性疼痛的发生机制,以期为神经病理性疼痛治疗新靶点的开发提供新的理论依据。
1 材料与方法
1.1 主要仪器与试剂
酶标仪(BioTek公司,美国),超声破碎机(宁波新芝生物科技股份有限公司,中国),荧光显微镜(Leica公司,德国),RIPA裂解液(上海碧云天生物有限公司,中国),NLRP3兔源一抗、pro-Caspase-1兔源一抗、Caspase-1 p10兔源一抗、ASC兔源一抗、IBA1鼠源一抗(Abcam公司,美国),Western blot山羊抗兔二抗(Cell Signaling Technology公司,美国),免疫荧光二抗(武汉塞维尔生物科技有限公司,中国),ECL发光试剂盒(上海翊圣生物科技有限公司,中国),4%PFA、10×PBS(武汉塞维尔生物科技有限公司,中国),蔗糖(上海国药有限公司,中国),引物(上海生工生物工程股份有限公司,中国),逆转录及扩增试剂盒(TAKAR公司,日本),酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(杭州联科生物技术股份有限公司,中国)。
1.2 动物及模型制备
本实验严格遵守动物实验相关伦理规定,在保证实验需求的情况下减少动物的使用量,保障动物福利,并尽可能减轻动物所承受的非实验必要的痛苦。
SPF级SD大鼠20只,7周龄,体质量190~210 g,均由上海杰思捷实验动物有限公司提供。每笼4只,自由进食进水,温度22~26 ℃,湿度50%~60%。饲养1周后进行CCI模型制备。采用随机数字表法将20只大鼠分为假手术组(Sham组)与慢性坐骨神经压迫性损伤组(CCI组),每组10只。
CCI组大鼠采用10%水合氯醛5 mL/kg腹腔注射麻醉,随后俯卧位固定四肢,手术区域备皮、消毒、铺巾,作约0.5 cm的手术切口,钝性分离肌肉,暴露右侧坐骨神经中段。坐骨神经主干采用4道4-0尼龙非可吸收线结扎,间距1 mm,结扎线的松紧程度以结扎线可在坐骨神经上轻微滑动并可使右后肢坐骨神经支配的肌肉产生轻微抽搐为准,术毕分层缝合肌肉及皮肤,使用青霉素眼膏涂抹伤口。Sham组仅切开皮肤,钝性分离肌肉,游离相同长度坐骨神经但不作结扎,其他操作同CCI组。所有动物模型制备均由同一操作者完成,以保证模型均一稳定。
1.3 机械痛阈与热痛阈检测
采用双盲法分别于术前及术后3 d、7 d、14 d、21 d测定痛阈。机械痛阈:将大鼠单独置于底部带孔(孔径0.5 cm×0.5 cm)的透明有机玻璃箱内适应30 min,电子von Frey测痛仪以不同压力刺激大鼠患肢足底中部2 s,记录诱发缩足反应时的压力值,间隔10 min,测量3次,取其平均值。热痛阈:将透明有机玻璃箱置于3 mm厚的玻璃板上,用全自动热痛刺激仪(BME-410C型)照射大鼠患肢足底,记录诱发抬腿回避的时间;为防止组织损伤,照射时间不超过50 s。
1.4 Western blot
大鼠于术后21 d麻醉后放血处死,迅速取脑组织,每只大鼠切下相同体积vlPAG置入RIPA裂解液和蛋白酶抑制剂的混合液中(裂解液∶脑组织=10 μL∶1 mg;蛋白酶抑制剂∶裂解液=1∶100),充分研磨后4 ℃震荡30 min,随后12 000 r/min离心30 min,取上清,相同条件再次离心,取上清。BCA法测定蛋白浓度。Loadingbuffer混合β-巯基乙醇后加入蛋白上清中,100 ℃变性10 min。用10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离蛋白(90 V,30 min;120 V,1.5 h)。200 mA恒流2 h转膜,将蛋白转移到PVDF膜。5%脱脂奶粉溶液室温封闭1 h,TBST清洗3次,一抗(NLRP3、ASC、pro-Caspase-1、Caspase-1 p10、GAPDH,1∶1 000)4 ℃摇床孵育过夜;TBST清洗3次,辣根过氧化物酶标二抗(1∶2 000)室温孵育1 h;TBST清洗3次,ECL曝光显色。
1.5 总RNA提取及RT-PCR
取部分vlPAG加入500 μL Trizol液体中,充分研磨后加入250 μL氯仿,剧烈震荡10 s,4 ℃下12 000 r/min离心20 min,取上清,加入等体积异丙醇,4 ℃下12 000 r/min离心20 min,弃去上清,用焦碳酸二乙酯水配制的75%乙醇清洗沉淀2次,4 ℃下7 500 r/min离心10 min,晾干后使用20 μL焦碳酸二乙酯溶解,测定RNA浓度。设置逆转录体系,加入1 000 ng RNA后逆转录成cDNA。因RT-PCR扩增孔板孔数限制,每组样本取6只大鼠进行实验,若出现统计学差异,即认为组间存在统计学差异。根据各基因设置PCR扩增体系,点样后离心进行PCR,扩增引物序列见表1。

表1 引物序列
1.6 ELISA
新鲜vlPAG加入预冷生理盐水,匀浆研磨,冰浴超声破碎。4 ℃下12 000 r/min离心20 min,取上清。检测蛋白浓度后按ELISA说明书检测炎症因子IL-1β与IL-18的表达水平。
1.7 免疫荧光实验
大鼠预冷生理盐水灌流后,预冷4%PFA灌流取全脑,4 ℃下4%PFA固定24 h,20%蔗糖脱水沉底,30%蔗糖沉底。聚乙二醇和聚乙烯醇水溶性混合物冰冻包埋、切片,预冷PBS漂洗,1×柠檬酸抗原修复液加热抗原修复,10%BSA室温封闭1 h。一抗(1∶1 000)4 ℃孵育过夜,PBS漂洗3次;二抗(1∶2 000)室温孵育2 h,PBS漂洗3次;DAPI孵育30 min,PBS漂洗,抗猝灭剂封片。于荧光显微镜及低倍镜下观察,根据大鼠大脑解剖图谱找到vlPAG,摄取不同荧光通道图片。
1.8 统计学处理
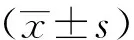
2 结果
2.1 机械痛阈与热痛阈比较
与Sham组相比,CCI组术后3 d、7 d、14 d、21 d机械痛阈与热痛阈均明显降低,差异有统计学意义(P<0.001),见图1。
a:机械痛阈;b:热痛阈 ***:与Sham组相比,P<0.001
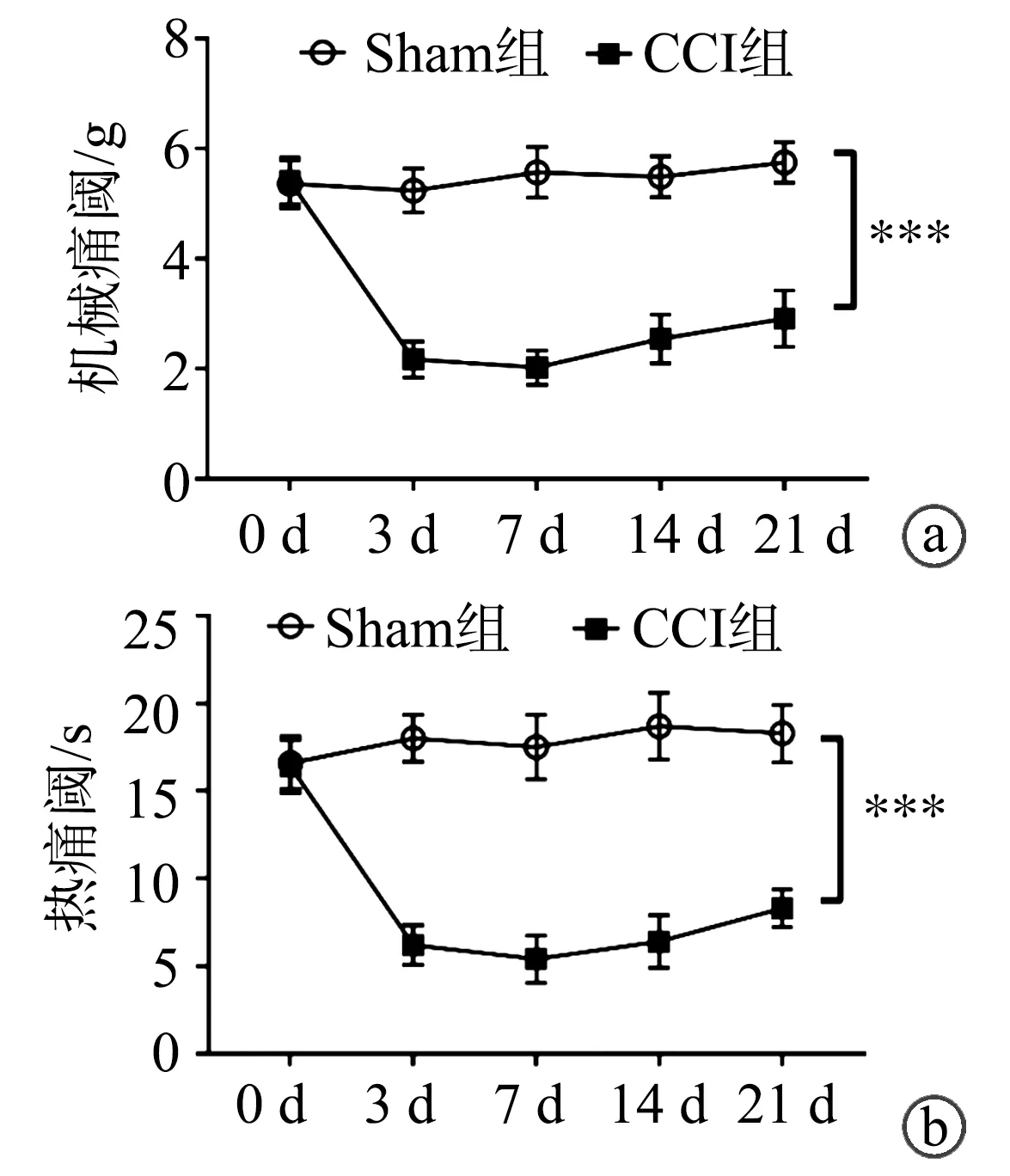
2.2 NLRP3炎症小体各组分蛋白表达
Western blot显示,与Sham组相比,CCI组vlPAG术后21 d NLRP3炎症小体核心蛋白NLRP3、前体蛋白pro-Caspase-1与效应蛋白Caspase-1 p10表达水平均明显升高(P<0.001),2组连接蛋白ASC表达水平比较差异无统计学意义(P>0.05),见图2。
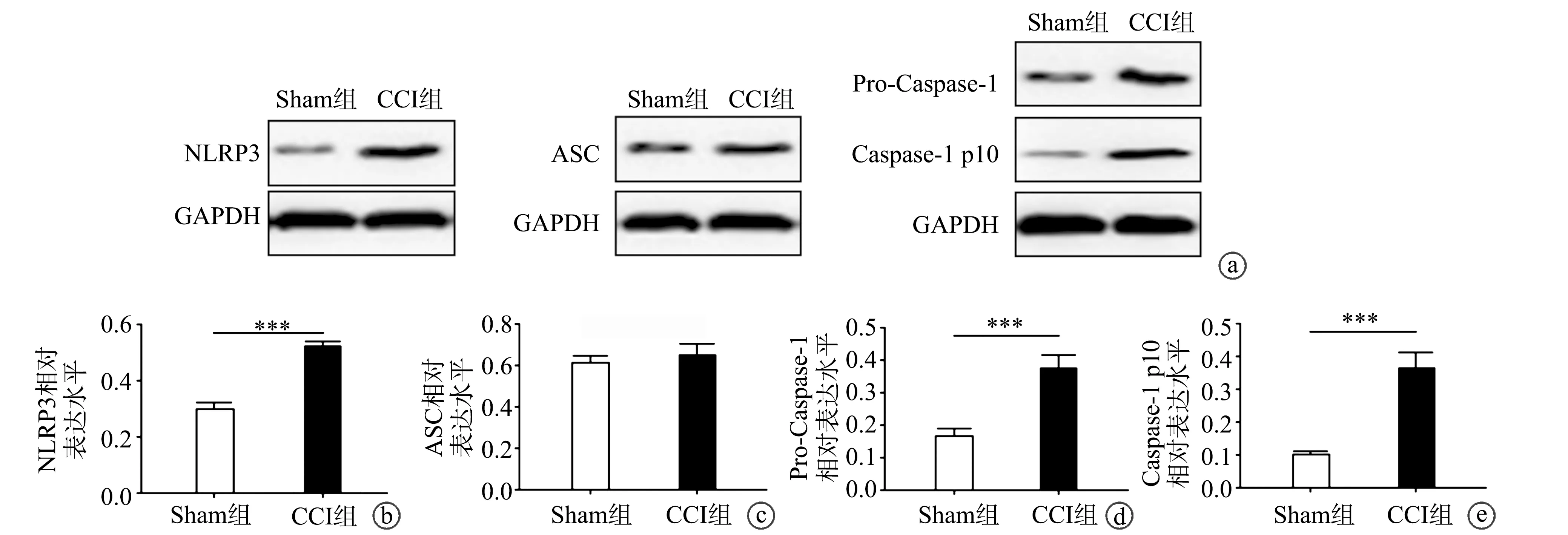
2.3 NLRP3炎症小体及下游基因mRNA表达
RT-PCR结果显示,与Sham组相比,CCI组vlPAG中NLRP3炎症小体各组分基因NLRP3(P<0.001)、Caspase-1(P<0.001)、IL-1β(P<0.01)mRNA表达水平均明显升高,2组ASC与IL-18 mRNA表达水平比较差异无统计学意义(P>0.05),见图3。
2.4 炎症因子IL-1β及IL-18表达水平
与Sham组相比,CCI组vlPAG术后21d炎症小体下游效应炎症因子IL-1β(P<0.001)及IL-18(P<0.01)表达水平均明显升高(图4)。
a:Western blot检测NLRP3、ASC、pro-Caspase-1及Caspase-1 p10表达水平;b:NLRP3表达水平;c:ASC表达水平;d:pro-Caspase-1表达水平;e:Caspase-1 p10表达水平 ***:与Sham组相比,P<0.001
a~e:NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表达水平 **:与Sham组相比,P<0.01;***:与Sham组相比,P<0.001
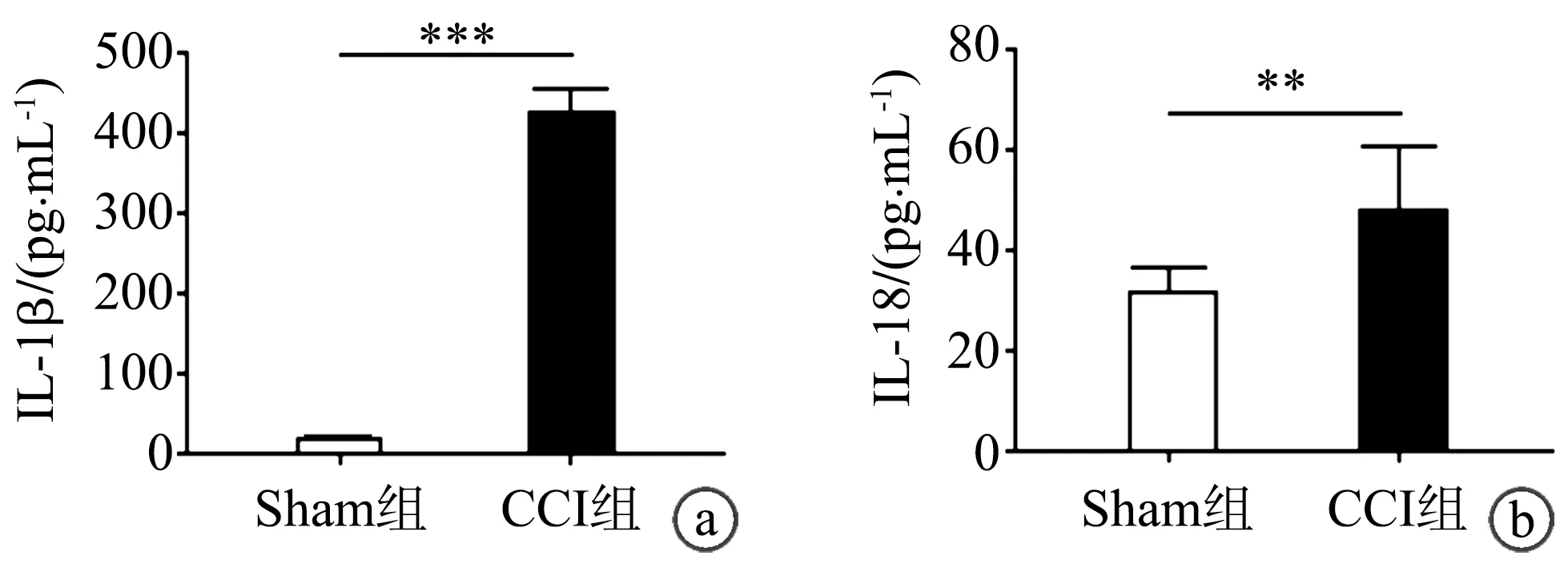
a:IL-1β表达水平;b:IL-18表达水平 **:与Sham组相比,P<0.01;***:与Sham组相比,P<0.001
2.5 NLRP3炎症小体的分布情况
与Sham组相比,CCI组激活的小胶质细胞数增加,NLRP3阳性细胞数也增加,IBA1与NLRP3多数存在共标(图5)。
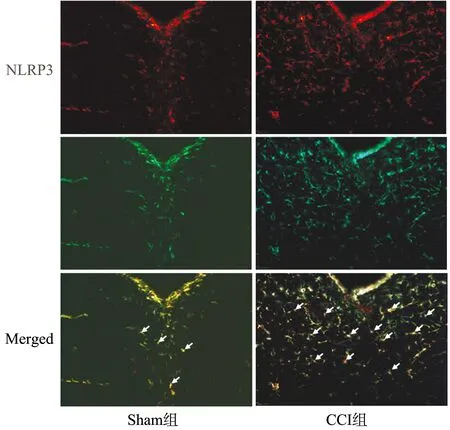
图5 大鼠术后21 d IBA1及NLRP3双阳性细胞(×200)
3 讨论
已有研究在CCI模型及其他方法诱导的神经病理性疼痛模型(如紫杉醇诱导模型)中证实,NLRP3炎症小体在神经病理性疼痛中起着重要作用[4,6,17]。也有研究显示,在选择性神经损伤模型中,NLRP3炎症小体并未发挥作用[18],但该研究仅限于脊髓水平,且对NLRP3炎症小体并未进行蛋白水平的验证,结论并不十分可靠;且动物足底注射福尔马林可显著提高野生型和NLRP3基因敲除小鼠的NLRP3炎症小体相关基因的表达水平,说明NLRP3炎症小体在神经病理性疼痛中存在作用。Grace等[11]研究发现,常用于镇痛治疗的吗啡可以通过激活脊髓NLRP3炎症小体释放IL-1β,从而延长神经病理性疼痛的痛觉超敏持续时间,且NLRP3炎症小体激活主要位于脊髓的小胶质细胞。然而目前有关NLRP3炎症小体在神经病理性疼痛中的作用研究都只聚焦于脊髓层面,未涉及中脑水平。
本研究采用慢性坐骨神经压迫性损伤方法制备神经病理性疼痛大鼠模型,在坐骨神经结扎术后第3天,大鼠机械痛阈与热痛阈出现明显下降,表明神经病理性疼痛大鼠模型制备成功。该模型均一稳定,效果明确,可控性强,可较好模拟临床神经病理性疼痛。
Gustin等[19]研究发现,NLRP3炎症小体在小鼠大脑中的表达和功能发挥主要位于小胶质细胞,而非星形胶质细胞,本研究结果与之一致。Chang等[20]发现NLRP3炎症小体介导的小胶质细胞凋亡与心脏骤停后脑损伤的发展密切相关,提示NLRP3炎症小体在中枢神经系统炎症中具有重要调节作用。心脏骤停后脑损伤产生的炎症反应与神经病理性疼痛大鼠产生的炎症同属无菌性炎症反应,因此我们猜测,无菌性炎症在中枢神经系统的进展过程主要由小胶质细胞NLRP3炎症小体激活介导。本研究NLRP3炎症小体3个组分蛋白中,核心蛋白NLRP3与效应蛋白Caspase-1 p10表达水平在CCI组发生了明显变化,这可能与NLRP3炎症小体的激活调节机制有关。NLRP3炎症小体激活机制包括经典激活途径与非经典激活途径。经典激活途径需要LPS结合受体通过TLR4/NF-κB激活NLRP3炎症小体,而非经典激活途径则通过ATP结合P2X7、钾离子通道等调节NLRP3炎症小体[1,21]。秦颖等[16]研究发现,CCI大鼠中P2X7表达增高。程祝强等[22]也发现,P2X7在神经病理性疼痛大鼠中脑导水管周围灰质区的表达增高,然而P2X7作为NLRP3炎症小体激活途径的重要受体,在该研究中却未与小胶质细胞激活的重要标记物IBA1共标,而是与星形胶质细胞激活标记物GFAP共标,也就是说,P2X7在CCI大鼠中脑导水管周围灰质区主要表达于星形胶质细胞。本研究虽未检测P2X7,但作为固有免疫的重要组成部分,P2X7在理论上与小胶质细胞存在共标,所以这项研究结果是比较有趣的现象。有关P2X7在神经病理性疼痛的发生发展过程中所扮演的角色以及其对vlPAG中NLRP3炎症小体激活水平的影响值得进一步深入研究。
NLRP3炎症小体作为固有免疫的重要组成部分,其适度激活有益于清除病毒体以及修复组织损伤,同时启动炎症调节通路,维持机体免疫平衡,而NLRP3持续激活则可能引起炎症瀑布反应,导致组织坏死。本研究初步验证了vlPAG中NLRP3炎症小体在CCI模型中的变化,为神经病理性疼痛的研究提供了新的治疗思路,也为开发神经病理性疼痛新的治疗药物和治疗方法提供了新的靶点。然而有关NLRP3在神经病理性疼痛中发挥作用的具体机制仍有待进一步研究。
