压力对实际气体热力学能影响的宏观及微观分析*
2022-03-04张克舫王照亮刘安源吴明铂
张克舫 王照亮 刘安源 吴明铂
[中国石油大学(华东)新能源学院 山东 青岛 266580]
1 引言
热力学能(也称为内能)u和焓h=u+pv是物质重要的状态参数,也是工程技术中用途广泛的热力学函数[1].J.L.Gay-Lussac在1807年,J.P.Joule在1843年,分别做了著名的Joule实验[2],推导出理想气体的内能u与焓h都仅为温度T的单值函数而与压力p和体积V无关.J.P.Joule和W.Thomson在1852年进行了Joule-Thornson实验[2],推导出实际气体的内能与焓都不只是温度的函数,而是与压力、体积都有关,即对于实际气体有u=F1(T,p),h=F2(T,p).
实际气体的热力学能和焓值不仅与温度T有关,还取决于压力p或比体积v.工程上遇到的实际气体(例如水蒸气、油气田开采的天然气等),相同压力下,温度T越高,热力学能和焓越大,这很容易理解.那么相同温度下,压力越高,实际气体的热力学能和焓值如何呢?我们选取工程上常见的水蒸气和天然气为例回答这个问题.
水蒸气是实际工程中广泛应用的工质,表1是从过热蒸汽热力学性质图表中截取的不同压力和温度下水蒸气的状态参数.从表1中数据可以看出,在相同温度下,压力分别为0.5 MPa,1 MPa,2 MPa时,2 MPa时的热力学能和焓最小,压力为0.5 MPa时,热力学能和焓值最大.

表1 不同温度、压力下过热蒸汽的热力学能和焓值[3]
REFPROP是一款国际权威工质物性计算软件[4],图1是根据REFPROP软件的数据绘制的水蒸气焓熵图,图中横坐标是熵,纵坐标是焓,右边3条实线是干度x为0.9,0.95,1.0的等干度线,两条虚线是温度T分别为350 K(77 ℃)和400 K(127 ℃)的等温线,两条点划线是压力p为 0.15 MPa和0.9 MPa的等压力线.从图1可以看出,在相同温度时(例如T=400 K的等温线上),p=0.15 MPa的过热蒸汽比焓大于p=0.9 MPa时过热蒸汽的比焓值.也就是说,相同温度下,压力越高,过热蒸汽的热力学能u和焓h越小.

图1 水蒸气的焓熵图
表2是根据REFPROP软件查到的某组分天然气的状态参数,从表2可以看出,天然气组分一定时,相同温度下,压力越高,天然气的热力学能u和焓h越小.

表2 组分一定,不同温度、压力下天然气的热力学能和焓值
表1、表2和图1的数据都表明了,相同温度T下,压力越高,水蒸气和天然气的热力学能和焓值越小,这与我们一般的感性认识背道而驰,怎么解释此现象呢?其他的实际气体是否也具有相似的规律呢?在《大学物理》及《工程热力学》等教材中,都没有给出答案以及解释,学习者特别是工程技术人员很容易产生困惑, 本文从宏观的实际气体状态方程及热力学能统计定义微观的角度出发,推导分析压力对实际气体的热力学能的影响,从理论上证明了在相同的温度下,压力越高,比热力学能和焓值越小.
2 从实际气体状态方程角度分析
对于实际气体,人们已经提出了上百个半经验与纯经验状态方程,尽管方程的复杂性和精度不同,但都考虑了气体分子自身大小和分子之间的相互作用力,是对实际气体pVT行为的一种近似描述.其中范德瓦耳斯方程是最经典的方程之一, 即
(1)
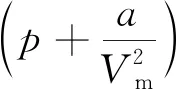
热力学能的全微分表达式为
(2)

2.1 单独考虑分子体积修正项时
当单独考虑分子体积修正项时有
p(Vm-b)=RT
(3)
从式(3)可以求得
代入到式(1)可得
(4)
(5)
由式(5)可见,分子体积修正项对du没有影响.
2.2 单独考虑分子引力时
单独考虑分子引力时有
(6)
从式(6)可以求得
代入到式(2)可得
(7)
(8)
由式(8)此可见,随着体积的增大,热力学能是增大的.而体积与压力成反比,因而压力增大时,体积减小,热力学能减小.
2.3 同时考虑分子体积修正及分子引力时
范德瓦耳斯方程在理想气体状态方程的基础上,对分子体积项以及分子间的引力项进行了修正.由以上分析可知,在定温条件下,分子体积修正项对热力学能的变化没有影响,也就是压力变化(或比体积的变化)时,热力学能不变化;但对于分子间的引力一项,随着压力的增大(比体积减小),热力学能是减小的.因此两者的综合作用就是,随着压力的增大(比体积减小),热力学能是减小的.
3 从热力学能的统计定义角度分析
从统计角度看,单原子经典气体的热力学能U等于分子动能与分子势能之和,当气体的密度不是很高时
(9)
其中,pi是第i个分子的动量,即第一项是体系中分子的动能;ri,j是两个分子之间的距离,φ(ri,j)是两分子相互作用势能[9],反映两个分子间相互吸引作用的强弱.
由式(9)中第一项可以看出,分子的动能与其质量和速度有关,温度一定时,体系中分子的动能是确定的,不随分子间距或压力而变化.但是考虑分子间的引力,即表现为式(9)的第二项,式(10)的Lennard-Jones势是常用分子势能曲线的表示分子作用势的半经验公式[9]
(10)
式中,r0和φ0是相互作用势能的两个参量.当两个分子相距r0(10-10m的数量级)时,相互作用势能达到极小值-φ0.
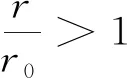
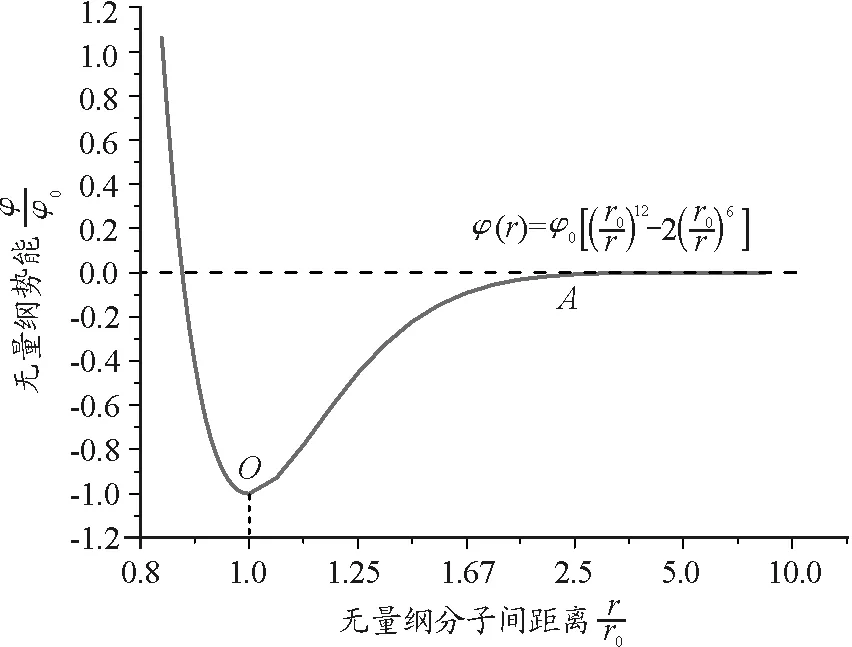
图2 Lennard-Jones分子势能曲线
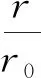
气体压力p增大时,热力学能减小,也可以从能量角度定性分析.由于实际气体的分子间总存在着相互作用(吸引力),当压力减小或体积增大时,必须吸收能量以克服分子间的吸引力,所以吸收的能量导致热力学能增加.
4 结论
(1)对水蒸气和天然气这样的实际气体来说,温度相同时,压力越高,比热力学能和焓值越小.
(2)根据宏观的范德瓦耳斯实际气体状态方程,在定温条件下,分子体积修正项对热力学能的变化没有影响;但对于分子间的引力一项,随着压力的增大(比体积减小),热力学能是减小的.两者的综合作用是,随着压力的增大(比体积减小),热力学能是减小的.
(3)根据微观的热力学能统计定义,温度一定时,体系中分子的动能不随分子间距或压力而变化;根据Lennard-Jones势能曲线和公式,当r>r0时,随着气体分子间距r的增大,分子作用势φ是增大的.
(4)宏观的范德瓦耳斯实际气体状态方程及微观的热力学能统计定义,都证明了相同温度下,实际气体的热力学能U随着压力的增大而降低.
