神阙穴电针对便秘型肠易激综合征胃肠功能障碍及肠道菌群的影响*
2022-03-03谢林林赵玉粒黄明桂古远云
谢林林,赵玉粒,黄明桂,古远云
(西南医科大学附属中医医院 泸州 646000)
肠易激综合征(Irritable bowel syndrome,IBS)是一种功能性胃肠道疾病,以腹痛、腹胀、排便习惯改变和大便紊乱为主要临床表现[1]。全球IBS的患病率约为11%,而亚洲不同地区的患病率从5%到9.9%不等,根据罗马Ⅳ标准,IBS分为腹泻型IBS(IBS-D)、便秘性IBS(IBS-C)混合型IBS(IBS-M)和不可分型IBS(IBSU),其中IBS-C发病率约占26.7%,且发病率逐年增高,症状顽固,严重降低了患者的生活质量[2-3]。IBS-C的病理生理机制仍不清楚,因此阻碍了有效治疗IBSC的发展[4]。目前,可用的IBS-C治疗大致分为药物治疗和其他干预措施,如生活方式和饮食调整[5]。大多数IBS-C药物仅限于对症治疗IBS-C的特定症状,对其他相关症状没有显著疗效,且生活方式和饮食改变并不是对所有患者都统一有效[6]。在此背景下,补充和替代医学显示出希望,作为补充和替代医学的治疗方法之一,电针被认为是治疗功能性胃肠道疾病的有益替代疗法[7]。研究表明电针可通过干扰躯体神经系统和中枢神经系统的相关介质来改变内脏感觉和运动[8]。此外,电针可从脑-肠轴和免疫系统等方面干预IBS[9]。然而,这些研究还没有提供足够的证据来确定电针治疗IBS-C的有效作用机制。因此,本研究以肠道微生物变化为切入点,进而探讨神阙穴电针治疗IBS-C的作用机制,以期为电针治疗IBS提供理论依据。
1 材料与方法
1.1 实验动物
选择健康Sprague Dawley(SD)大鼠48只,体质量(230±20)g,由西南医科大学实验中心提供(许可证号:SCXK(川)2018-17)。所有大鼠均饲养于恒温(23±2)℃、相对湿度55%±5%的环境中,常规24 h昼夜循环,本研究方案经西南医科大学附属中医医院实验动物伦理委员会批准(20210010),实验过程严格遵守实验动物管理条例。
1.2 主要试剂及仪器
西沙必利片(国药准字H20020345)购自浙江京新药业;苏木素染液(批号:C200301)、伊红染液(批号:C200403)购自珠海贝索生物;环磷酸鸟苷(cGMP,货号:ZC-36710)ELISA试剂盒购自上海茁彩生物;RNA Trizol Reagent(批号:vs18061730)购自合肥博美生物;TB GreenTMPremix Ex TaqTMⅡ(货号:RR820A)购自宝日医生物;DNA分离试剂盒(货号:12888-50)购自美国Mobio;QAQUICK PCR纯化试剂盒(货号:28106)美国QIAGEN;PIKORed 96实时荧光定量(RT-PCR)仪,正置荧光显微镜(型号:DM3000)购自德国Leica公司。
1.3 便秘型肠易激综合征大鼠模型构建及分组
大鼠随机分为空白组、模型组、西沙必利组、电针治疗组,每组12只。将除空白组外的大鼠统称为造模组,造模组大鼠给予普通饲料适应喂养7天后,采用冰水灌胃法建立IBS-C大鼠模型,即每日8∶30给予大鼠0-4℃冰水混合物灌胃,共14天。每日于灌胃后更换大鼠垫料,24 h后捡取大鼠粪便,称取粪便质量,记录粪便粒数,观察粪便硬度及形态。若见大鼠粪便质硬、形状变小、含水量减少,大鼠性易激惹,可判断造模成功。
1.4 治疗方法
造模成功后,电针治疗组每日9∶00将大鼠仰卧固定,电针大鼠神阙穴(胸腹正中线上,剑突至耻骨联合上缘上2/3与下1/3交界处),进针5 mm左右,每日1次,每次30 min,每天1次,5次为一个疗程,疗程中间休息2天,共治疗4个疗程。参照《大鼠穴位图谱的研制》以及李忠仁版的《实验电针学》进行穴位定位[10],电针参数参考曹洋等[11]研究结果:强度2 mA,疏密波(疏波4 Hz,密波50 Hz)。为了避免由于强制固定时所引起的应激反应误差,空白组、模型组大鼠每日只采取固定并给予等体积生理盐水灌胃,西沙必利组大鼠每日固定给予西沙必利片0.9 g·L-1混悬液,按剂量为3.6 mg·kg-1灌胃,每日1次,持续28天。
1.5 检测指标
1.5.1 炭末推进实验及粪便含水量测定
治疗结束后,每组取6只大鼠灌胃墨汁,40 min后采用戊巴比妥钠(35 mg·kg-1)麻醉大鼠,打开腹腔,分离肠系膜。剪取幽门至回盲部的肠管,测量肠管长度为小肠总长度,炭末在小肠中推进距离为幽门至炭末前沿的距离,炭末推进率=炭末在小肠中的推进距离/小肠总长度×100%。治疗结束当天,收集各组大鼠(n=12)24 h粪便,先后称取大鼠粪便的湿重及干重(粪便湿重(A),粪便烘干后粪便重量(B)),粪便含水量=(A-B)/A×100%。
1.5.2 腹部撤退反射(AWR)评分
将蘸取液体石蜡的气囊导管经大鼠肛门插入直肠(一般4.5 cm)并固定,后将大鼠放在透明观察箱,待其适应并安静休息时,连接实验用血压计,通过加压球缓慢向导管及气囊内注气使肠道扩张,观察大鼠腹壁的回缩反射,每个压力测定3次,每只大鼠重复测量3次,每次间隔5 min。评分标准为:0分:无明显反应;1分:轻微扭动头部;2分:腹背部肌肉轻微紧张;3分:腹背部肌肉较明显聚拢;4分:腹部肌肉急剧收缩。
1.5.3 结肠组织病理学观察
给药结束后,收集各组剩余6只大鼠的结肠组织,用4%多聚甲醛固定,将固定组织经脱水、包埋、切片(厚度5 µm),用HE染色,二甲苯透明,中性树胶封固、镜检观察。
1.5.4 酶联免疫吸附法(ELISA)检测
各组取剩余6只大鼠的结肠组织,PBS冲洗,剪成小块,5 mL PBS冰上用玻璃匀浆器匀浆,反复冻融,进一步破碎细胞膜,匀浆物以5000 r·min-1离心20 min,取上清液,按照ELISA试剂盒检测大鼠结肠组织cGMP的含量。
1.5.5 qRT-PCR检测结肠组织C-fos mRNA表达
各组取剩余6只大鼠的结肠组织,使用TRIzol试剂盒按照制造商说明从结肠组织中提取总RNA,逆转录合成cDNA,用Takara TB Green ™PreMix Ex Taq™定量基因表达水平,引物序列:C-fos:5’-GTGGACCTGTC TGGTTCCTTCTATGC-3’(正向),5’-CTCGTTGCTGCT GCTGCCCTTT-3’(反向);β-actin:5’-CTCCATCGTCC ACCGCAAATGCTTCT-3’(正向),5’-GCTCCAACCGA CTGCTGTCACCTTC-3’(反向)。以β-actin内参。qRT-PCR反应条件:95℃ 10 min,95℃ 10 s,60℃ 10 s,72℃ 10 s,45个循环,记录CT值,采用2-ΔΔCT分析相对表达水平。
1.5.6 肠道微生物区系分析
治疗结束后,无菌收集各组大鼠粪便(〉0.5 g),分装于无菌冻存管,对粪便样本进行16S rDNA基因测序,使用DNA分离试剂盒提取粪便样本DNA,并使用Nanodrop ND-1000分光光度计检测DNA的质量。使用针对V4区的引物集进行16S rDNA序列的PCR扩增,用QAQUICK PCR纯化试剂盒从未掺入的核苷酸和引物中提纯最终的PCR产物,将纯化的样品归一化到相同的DNA浓度,并使用Illumina MiSeq测序仪PE250进行测序。
1.6 统计学分析
使用SPSS 20.0软件对数据进行统计分析,数据表示为平均值±标准差(±s),除肠道微生物区系分析外,所有其他数据多组间比较采用单因素方差分析(one-way ANOVA),当方差齐性时采用LSD检验,否则采用Tamhane's检验,对于所有分析,P〈0.05表示差异具有统计学意义。16S rDNA序列数据利用QIIME分析。
2 结果
2.1 神阙穴电针对便秘型肠易激综合征大鼠粪便含水量及粪便粒数的影响
与空白组比较,模型组大鼠粪便颗粒数、粪便重量、粪便含水量均明显降低(P〈0.01);与模型组比较,电针治疗组大鼠粪便颗粒数、粪便重量、粪便含水量均明显升高(P〈0.01),见图1。
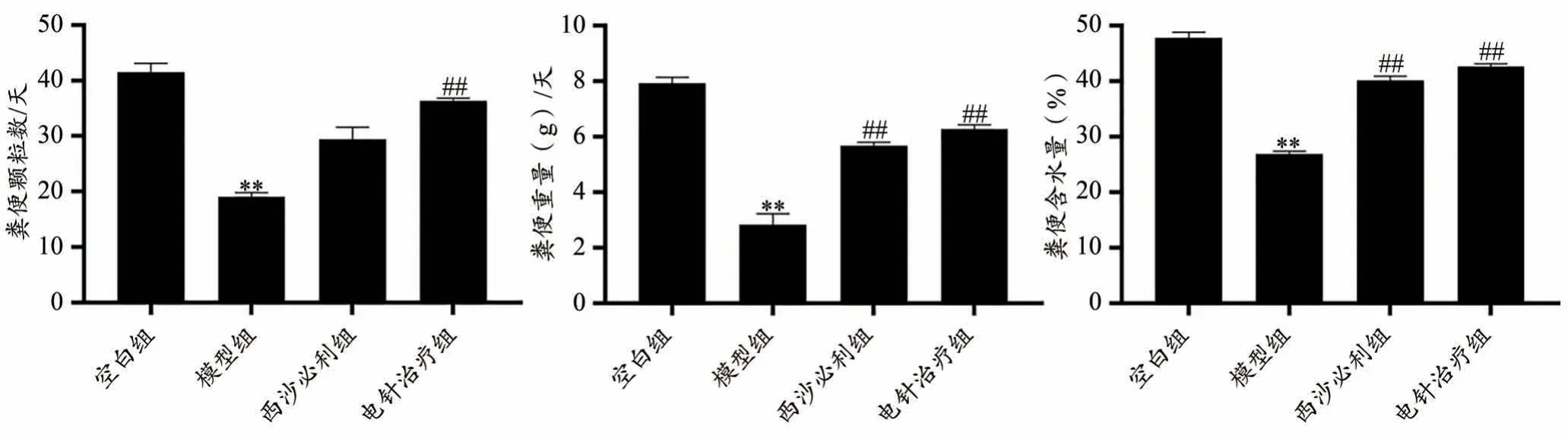
图1 各组大鼠粪便颗粒数、粪便重量、粪便含水量变化
2.2 神阙穴电针对便秘型肠易激综合征大鼠结直肠扩张的影响
与空白组比较,模型组大鼠AWR评分明显升高,炭末推进率明显降低(P〈0.01);与模型组比较,西沙必利组、电针治疗组大鼠AWR评分明显降低,炭末推进率明显升高(P〈0.01),见图2。

图2 各组大鼠AWR评分、炭末推进率变化
2.3 神阙穴电针对便秘型肠易激综合征大鼠组织病理学的影响
空白组大鼠结肠组织结构完整,黏膜层、黏膜下层、肌层和外膜分层明显,未见明显变性坏死。模型组大鼠结肠组织结构被破坏,黏膜层全层溶解坏死较为明显,黏膜上皮脱落缺失,固有层内肠腺溶解基本消失,坏死区域及肠腔内可见坏死细胞碎片聚集,局部区域固有层轻微出血。西沙必利组大鼠局部结肠组织结构被破坏,黏膜浅表坏死较为明显,形态结构模糊,上皮脱落,肠腺溶解坏死。电针治疗组大鼠局部结肠组织结构被破坏,部分区域黏膜上皮坏死脱落,固有层内肠腺浅表溶解坏死,坏死区域染色较浅,结构模糊。见图3。
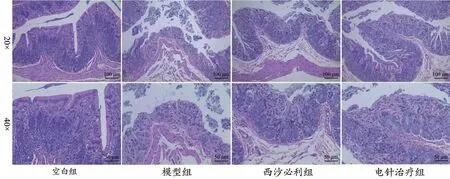
图3 各组大鼠结肠组织病理变化(HE)
2.4 神阙穴电针对便秘型肠易激综合征大鼠胃肠功能障碍的影响
与空白组比较,模型组大鼠cGMP含量、C-fos mRNA表达明显升高(P〈0.01);与模型组比较,西沙必利组、电针治疗组大鼠cGMP含量、C-fos mRNA表达明显降低(P〈0.05),见图4。

图4 各组大鼠cGMP含量、C-fos mRNA表达变化
2.5 神阙穴电针对便秘型肠易激综合征大鼠微生物区系Alpha及Beta多样性的影响
Alpha多样性指数结果显示,Chao1指数、Simpson指数、Shannon指数及观察到的物种指数各组间均无明显差异,电针治疗对便秘型肠易激综合征大鼠肠道菌群的丰富度及均匀度没有明显影响(图5A)。使用PCA、PCoA以及NMDS图分析了肠道微生物区系Beta多样性的影响,Beta多样性显示各组间无明显交叠趋势,聚类现象较弱(图5B)。
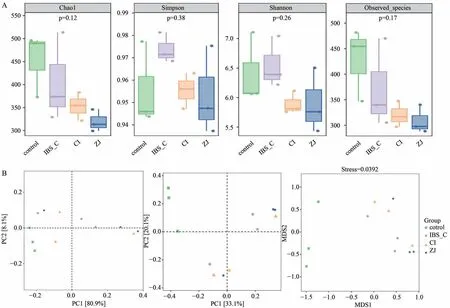
图5 各组大鼠肠道微生物区系Alpha多样性及Beta多样性
2.6 神阙穴电针对便秘型肠易激综合征大鼠微生物区系门、属水平的影响
在门水平上,在空白组中,粪便样本中菌群门水平最丰富的是拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicuts);与空白组比较,模型组粪便微生物区系组成有明显的变化,以拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicuts)为主,拟杆菌门(Bacteroidetes)丰度下降,而厚壁菌门(Firmicuts)丰度增加;与模型组相比,西沙必利组拟杆菌门(Bacteroidetes)丰度增加,电针治疗组厚壁菌门(Firmicuts)丰度增加(图6A)。在属的水平上,粪便成分的个体差异增强,空白组以副普氏菌属(Paraprevotella)、普氏杆菌(Prevotella)丰度较高;模型组以乳酸杆菌(Lactobacillus)、异杆菌属(Allobaculum)为主;西沙必利组以乳酸杆菌(Lactobacillus)、双歧杆菌属(Bifidobacterium)为主;而电针治疗组以乳酸杆菌(Lactobacillus)和梭菌属(Clostridium)为主;其比例在各组间具有可比性。普氏杆菌(Prevotella)丰度在模型组降低,而在西沙必利组丰度升高,电针治疗组可增加乳酸杆菌(Lactobacillus)及梭菌属(Clostridium)丰度(图6B)。
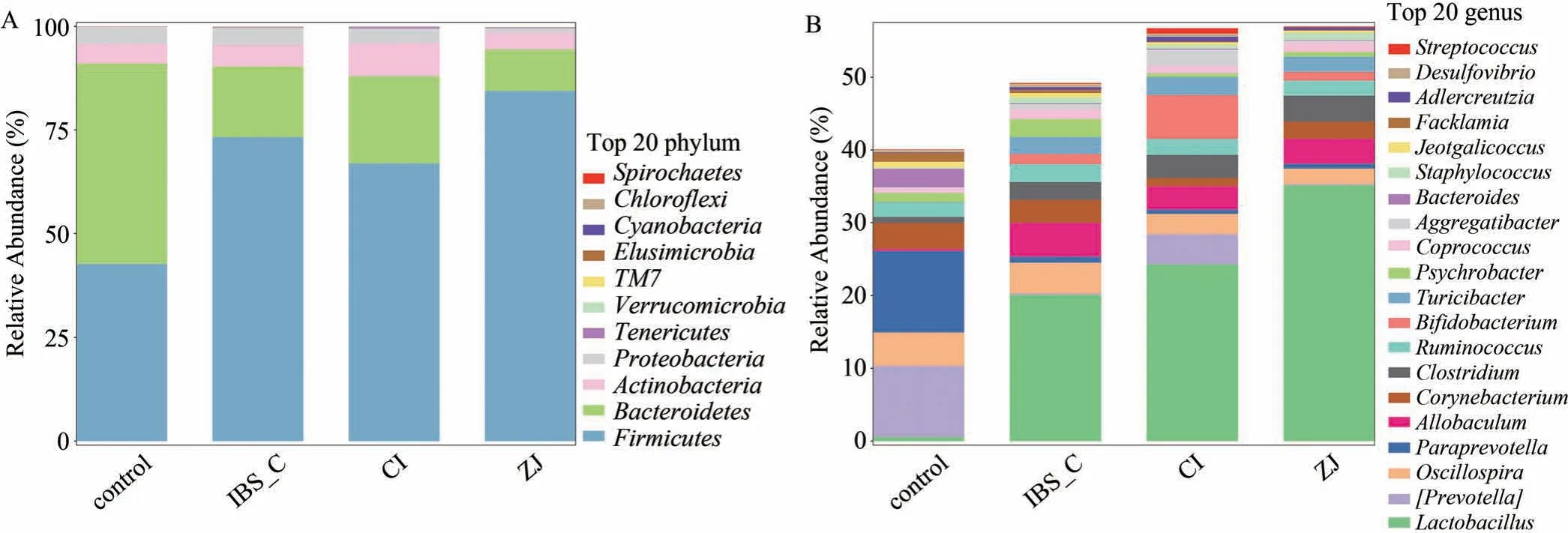
图6 各分组门、属水平上的物种相对丰度柱形图
3 讨论
IBS-C是功能性胃肠道疾病之一,给个人和社会造成了相当大的经济负担[12]。中医认为IBS-C为压抑的情绪和担忧会导致肝气郁滞,进而导致肝脏对脾胃的攻击,由此导致的脾虚会影响消化问题。此外,肝气郁结会阻塞经络气血,引起腹痛[13]。IBS-C的主要症状是腹痛、便秘和乏力,这些都是脾虚证的常见表现[14]。电针被认为具有改善肝郁脾虚的作用,神阙穴位于脐中,为任脉要穴,与肠腑相隔,具有调胃理肠的功效,于该穴治疗可健运脾胃,因此,本实验采用了神阙穴电针治疗IBS-C[7,15]。研究制备了IBS-C大鼠模型,结果显示模型组大鼠粪便粒数、粪便含水量及炭末推进率明显降低,符合IBS-C模型特征。报道指出IBS-C大鼠肠黏膜有坏死、糜烂,且有明显的炎性细胞浸润[4],本结果显示与其一致。通过电针神阙穴治疗后,大鼠的粪便粒数、粪便含水量及炭末推进率明显升高,结肠组织部分区域黏膜坏死,结肠炎性细胞浸润明显减少,组织病理形态变化明显低于模型组,此外,结肠组织cGMP含量较模型组明显降低。提示神阙穴进行电针治疗可以有效地延缓结肠组织病变程度。
肠道菌群是一个复杂的微生态系统,其代谢可能影响肠道免疫反应、养分吸收及能量调节[16]。此外,细菌修饰肠道是肠道菌群研究的重要领域之一,已被证明其有益于治疗癌症、炎症性肠病、结肠炎、肥胖或其他疾病[17-19]。IBS-C的确切病因可能是多因素的,近年来越来越多的研究集中到胃肠道微生物区系对IBS-C的影响上[20]。而关于肠道微生物区系的变化及其影响目前仍知之甚少。研究指出微生物因素在IBS病理生理学中起作用。然而,IBS肠道微生物改变的证据目前有限[21]。研究报道Alpha多样性和Beta多样性指数分别表征物种在生境内和生境间的多样性,以综合评价其总体多样性,Alpha多样性以Chao1、Observed species指数表征丰富度,以Shannon、Simpson指数表征多样性,Chao1值越大代表物种总数越多,Simpson、Shannon指数越大,说明群落多样性越高;Beta多样性指数聚焦于不同生境间多样性的比较,也就是样本间的差异,随着样本数的增加,距离矩阵的维度也不断增大[22]。既往研究表明紫甘薯多糖能增加小鼠Alpha多样性指数,增强免疫功能,改善小鼠肠道菌群结构[23]。本研究结果显示Chao1指数、Simpson指数、Shannon指数及观察到的物种指数于各组间均无明显差异,提示神阙穴电针治疗对IBS-C大鼠肠道菌群多样性的改变不明显。然而,传统肠道微生物区系向无菌大鼠转移的研究表明嗜酸乳杆菌(Lactobacillus acidophilus)和双歧杆菌(Bifidobacterium bifidum)可以促进小肠转运[24]。Shen等[25]研究发现乳酸杆菌(Lactobacillus)增加了小鼠粪便菌群中有益细菌的相对丰度,改善了粪便菌群的结构。本研究结果显示神阙穴电针治疗改善了肠道菌群失调,增加了乳酸杆菌(Lactobacillus)及梭菌属(Clostridium)丰度,维持了肠道菌群的平衡,促进了一些潜在益生菌属(乳杆菌属)的出现。本研究与盐酸洛普酰胺模型大鼠与正常大鼠在肠道菌群多样性和组成上存在显著差异的结果一致[26]。
研究认为肠道微生物区系与肠道通透性增加密切相关,根据脑-肠轴理论,当脑屏障被破坏时肠屏障也被破坏,从而影响肠道营养吸收及动力[27]。C-fos是即刻早期基因的一种,C-fos的基因功能是通过其所编码的核蛋白Fos实现的,多种刺激诱导可使Fos快速表达[28]。研究表明IBS-C由于内脏高敏感性,经常有腹痛、腹胀等刺激,使C-fos处于高表达状态[29],本研究结果中模型组大鼠C-fos mRNA表达明显升高,与其报道一致。此外,报道证实IBS-C大鼠脑干上行转导通路上多个部位的C-fos表达升高,提示IBS-C发病过程中高级神经中枢可通过C-fos参与刺激信号调控[30]。Muller等[31]研究显示肠道微生物群可以调节肠道外交感神经元,虽然微生物区系消耗导致C-Fos表达增加,但用短链脂肪酸产生菌对无菌小鼠进行定植可以抑制c-Fos在肠道交感神经节的表达。本研究结果表明神阙穴电针治疗后大鼠C-fos mRNA表达明显降低,提示电针治疗可能影响C-fos参与肠脑连接,可能通过调节肠道菌群来改善IBS-C,而IBS-C大鼠肠菌群的这些变化表明电针治疗方法可能是较有效的治疗方向。
综上所述,本研究发现电针治疗可以调节IBS-C大鼠肠道微生物区系,促进有益菌属如乳酸杆菌的丰度,进而可能调节胃肠功能障碍以及增加粪便含水量来缓解IBS-C进展。
