氯化胆碱-尿素低共熔溶剂中锌的电沉积研究
2022-03-03孙海静王贺杨帅付旭战充波张润佳周欣陈国亮孙杰
孙海静,王贺,杨帅,付旭,战充波,张润佳,周欣,陈国亮,孙杰
氯化胆碱-尿素低共熔溶剂中锌的电沉积研究
孙海静,王贺,杨帅,付旭,战充波,张润佳,周欣,陈国亮,孙杰
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
研究锌在氯化胆碱-尿素低共熔溶剂(ChCl-Urea DES)中的电化学行为、电结晶机理、电沉积历程和耐蚀性。采用循环伏安(CV)和计时电流技术(CA),研究了锌在玻碳电极上的电化学行为和电结晶机理。采用扫描电子显微镜(SEM)和X射线衍射技术(XRD)对锌镀层的微观形貌和物相组成进行了表征。采用动电位极化曲线和电化学阻抗谱,对比研究了ChCl-Urea DES和水溶液中锌镀层的耐蚀性。CV测试表明,在Zn(Ⅱ)的氧化还原过程中仅出现了一对氧化还原峰,这说明Zn(Ⅱ)在ChCl-Urea DES中为一步还原及氧化,且还原峰电位为‒1.207 V(vs. Ag)。不同扫描速度下的CV曲线表明,还原峰和氧化峰的峰值电位p和峰值电流p均随扫描速率的变化而有规律的偏移,这符合不可逆电极反应的特征。对p和1/2的关系进行了线性拟合,发现p与1/2之间符合线性关系,故可认为Zn(Ⅱ)的还原反应是受扩散控制的,进一步计算出扩散系数Zn(Ⅱ)为6.67×10‒8cm2/s。在–1.141 ~ –1.147 V下测定CA曲线,通过对比拟合CA曲线和理论曲线发现,Zn(Ⅱ)在ChCl-Urea DES中的形核方式不符合三维瞬时成核和三维连续成核,是一种具有两种形核方式特征的混合形核。SEM结果表明,不同沉积时间下锌镀层的微观形貌相差较大。随着沉积时间的增加,锌晶粒由细小、粒径均一的颗粒逐渐变化成大小颗粒交叠存在的六方形立体结构,然后又变成线状或棒状的结构,最终转变为六方形的片状晶粒。XRD表明,锌镀层由六方晶相的多晶锌构成。动电位极化曲线测试和电化学阻抗图谱表明,在没有任何添加剂的情况下,ChCl-Urea DES可获得与水溶液中耐蚀性相当的锌镀层,且ChCl-Urea DES中锌镀层的沉积速率略高于水溶液。Zn(Ⅱ)在ChCl-Urea DES中的电沉积过程是受扩散控制的不可逆电极过程,形核方式不符合三维瞬时成核和三维连续成核,是一种具有两种形核方式特征的混合形核。锌镀层是由六方晶相的多晶锌构成的。在ChCl-Urea DES中可获得与水溶液中耐蚀性相当的锌镀层,且沉积速率略高于水溶液。
低共熔溶剂;离子液体;电沉积;锌;形核机制;微观形貌;耐蚀性
锌及锌合金由于具有优异的耐蚀性能和能量存储性能而被广泛应用于金属防护、电池制造和能源存储等领域[1-2]。长久以来,金属锌的电沉积通常是在氰化物镀液、锌酸盐镀液和氯化钠(钾)镀液等水溶液体系中进行的[3],但这些镀锌电解液毒性较高、腐蚀性较强,并且在电沉积过程中存在析氢反应和镀层质量控制难等问题[4],因此寻找锌电沉积的替代电解质是十分必要的。近年来,离子液体在电沉积领域的优异表现而受到研究者的广泛关注。但人们逐渐意识到离子液体制备工艺复杂、应用条件苛刻、毒性较大且成本较高[5],已不能满足当今可持续发展的时代潮流,于是新一代离子液体的替代物——共熔溶剂(Deep Eutectic Solvents,DESs),一经发现便受到了研究者的青睐。
氯化胆碱、尿素的物质的量比为1∶2的氯化胆碱-尿素低共熔溶剂(ChCl-Urea DES)作为一种新型的价格低廉、合成简单的绿色溶剂,其具有电化学窗口宽、液态温度范围大、无析氢反应、无毒性和溶解性能好等优良性质[6-9],是作为电沉积锌的优良电解液,也是目前科研工作者最常用的电沉积锌低共熔体系。在ChCl-Urea DES中电沉积锌已有较多报道。如Abbott等[10]在物质的量比为1∶2的ChCl-Urea DES(含0.5 mol/L ZnCl2)中成功沉积了金属锌,并以Al2O3为例证明了在ChCl-Urea DES中可沉积复合材料。Abbott团队[11]发现,在物质的量比为1∶2的ChCl-Urea DES中,锌镀层的表面形貌与锌的成核和生长速率有关。对于Zn(Ⅱ)在ChCl-Urea DES中电沉积的基本动力学仍需要做进一步的研究。Abbott团队首次研究了添加剂对在ChCl-Urea DES中电沉积锌的影响。结果表明,氨水和乙二胺是锌电沉积的有效光亮剂[12],该研究仅对锌镀层的表面形貌进行了研究,并未对锌镀层的性能(如耐蚀性)进行研究。雷震等[13]研究了在ChCl-Urea DES(含ZnO)中锌的电沉积行为。结果表明,在ChCl-Urea DES中Zn(Ⅱ)的还原反应是受扩散控制的准可逆过程,且扩散系数约为1.2×10‒7cm2/s。此外,在电沉积锌合金方面,也有部分报道,如Zn-Ni[14]、Zn-Co[15]等。
目前为止,在使用ChCl-Urea DES体系进行电沉积锌的研究中,锌镀层的制备、Zn(Ⅱ)的电化学行为及形核机制和添加剂的影响等方面,都得到了一定的研究并取得了一些研究成果,但在Zn(Ⅱ)的基本动力学和锌镀层的性能(如耐蚀性)等方面,仍需要做进一步的研究。因此,本文采用循环伏安(CV)和计时电流技术(CA),研究了锌在玻碳电极上的电化学行为和电结晶机理。采用扫描电子显微镜(SEM)和X射线衍射技术(XRD),对锌镀层的微观形貌和物相组成进行了表征。最后,采用动电位极化曲线和电化学阻抗图谱,对比研究了锌镀层在ChCl-Urea DES和水溶液中的耐蚀性。
1 实验
1.1 DES体系制备
氯化胆碱(HOC2H4N(CH3)3Cl,ChCl)、尿素(H2NCONH2,Urea)和氯化锌(ZnCl2),均为分析纯。首先将ChCl和Urea放入80 ℃真空干燥箱中干燥24 h,然后称取物质的量比为1∶2的ChCl和Urea置于烧杯中混合均匀,在80 ℃油浴锅中磁力搅拌(500 r/min)24 h,即得到ChCl-Urea DES,将浓度为0.5 mol/L的ZnCl2加入到ChCl-Urea DES中,继续搅拌至澄清透明,即得到ChCl-Urea-ZnCl2DES。
1.2 电沉积及电化学测试
实验采用恒电位沉积法,以纯铜为阴极。电沉积前需要对纯铜进行前处理。首先在65 ℃的氢氧化钠(50 g/L)、磷酸钠(10 g/L)和碳酸钠(50 g/L)的混合液中浸泡30 min,以除去表面油污;用去离子水清洗后,室温下放入稀盐酸和稀硫酸的混合液中活化30 s;然后在室温下超声波清洗10 min;最后用去离子水清洗后得到待用试样。沉积温度由DZKW-D-2型电热恒温油浴锅(北京永光医疗器械)控制。电沉积完毕后,沉积片先用乙醇清洗,再用去离子水清洗,室温干燥后备用。
循环伏安和计时电流测试均采用CS350型电化学工作站(武汉科斯特仪器股份有限公司),测试采用三电极体系,以玻碳电极(GC,=3 mm)为工作电极,银电极为参比电极,铂电极(=1 mm)为辅助电极。测试前,用2000#金相砂纸将玻碳电极打磨至光亮,并用去离子水对各个电极表面进行清洗,干燥后使用。循环伏安测试:电位扫描区间为‒1.5~1.5 V,扫描速率为40~80 mV/s。计时电流测试:电位–1.141~ –1.147 V,时间5 s。实验测试温度均为60 ℃。
1.3 镀层表征
采用VEGA3XUM型扫描电子显微镜(SEM,捷克TESCAN公司)研究了不同沉积时间下锌镀层的表面形貌。采用D/max−2200PC型X-射线衍射仪(XRD,Cu Kα靶,=0.154 06 nm,日本日立公司)分析了锌镀层的物相组成。其中,XRD测试电压为40 kV,测试电流为100 mA,扫描范围为10°~100°,扫描速度为8 (°)/min。
2 结果与讨论
2.1 Zn(Ⅱ)的循环伏安行为
2.1.1 Zn(Ⅱ)在ChCl-Urea DES中的还原行为
图1为‒1.5~1.5 V电位范围内ChCl-Urea DES和含0.5 mol/L ZnCl2的ChCl-Urea DES的循环伏安曲线。由图1a可以看出,ChCl-Urea DES的阳极极限电位为0.93 V,阴极极限电位为‒1.11 V,故ChCl-Urea DES的电化学窗口为2.04 V。其中,在‒1.11 V处的还原峰可归因于体系中胆碱阳离子(Ch+)和体系中微量水的还原,而在0.93 V处发生的氧化反应则主要是Cl‒被氧化为Cl2所致[16]。由图1b可以看出,当电位负扫描至‒1.23 V和正扫至‒0.86 V时,各出现了一个还原峰和一个氧化峰,这分别对应于锌的还原(Zn2++2e‒→Zn)和氧化(Zn→Zn2++2e‒)过程。此外,从图1b中还可观察到,在‒1.25~‒0.75 V电位范围内,出现了“电流滞环”现象,这说明在该电位范围内发生了Zn2++2e‒→Zn的电结晶过程,生成了晶体锌[17]。在整个氧化还原的过程中,仅出现了一对氧化还原峰,这说明Zn(Ⅱ)在ChCl-Urea DES中为一步还原及氧化。
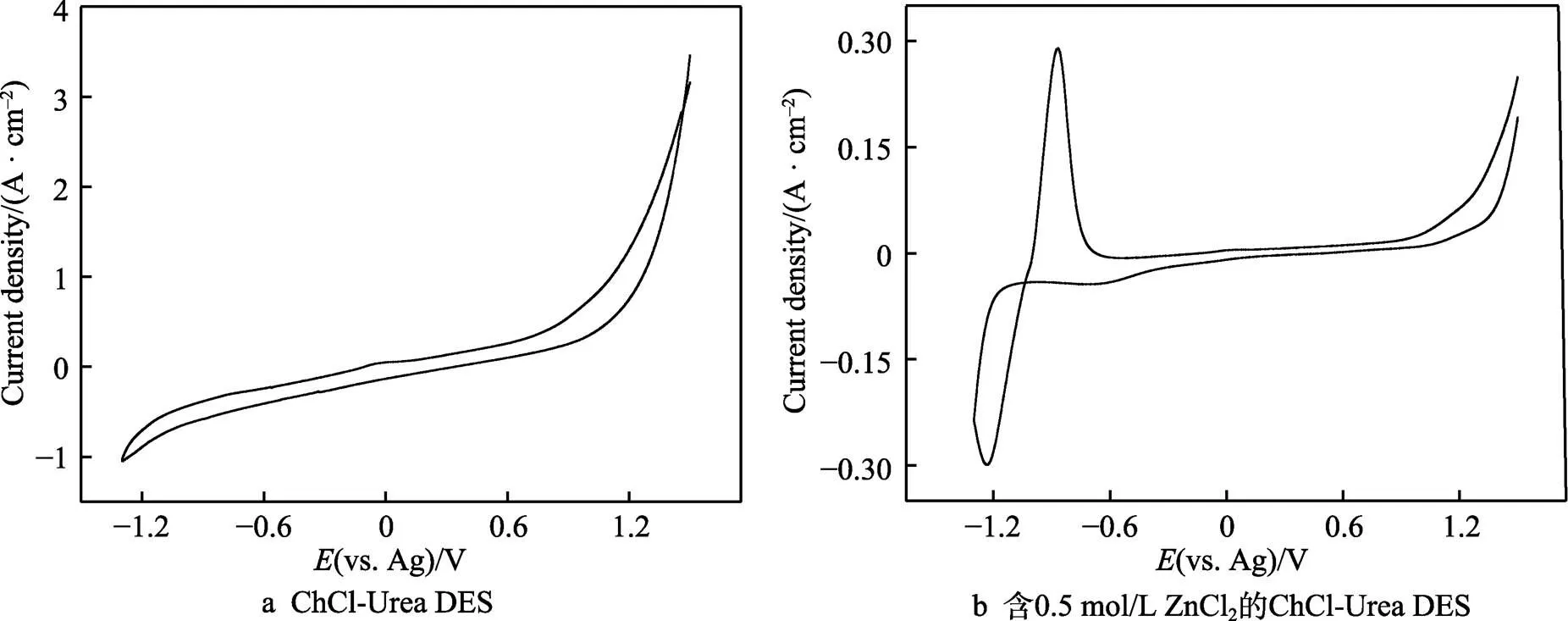
图1 ‒1.5 ~1.5 V电位范围内ChCl-Urea DES和含0.5 mol/L ZnCl2的ChCl-Urea DES的循环伏安曲线
2.1.2 Zn(Ⅱ)还原过程的可逆性及控制步骤分析
图2为–1.5~1.5 V电位范围内含0.5 mol/L ZnCl2的ChCl-Urea DES在不同扫描速率下的循环伏安曲线。根据ChCl-Urea-ZnCl2DES的CV曲线(图2),得到不同扫描速率下的还原峰数据,结果列于表1(其中,为扫速速率;p、p/2和p分别为还原峰的峰值电位、半峰电位和峰值电流)。从图2可观察到,还原峰和氧化峰的峰值电位p均随扫描速率的变化而有规律的偏移,且两者峰值电流p均随扫描速率的增加而有规律的减小。对于可逆电极反应而言,峰值电位和峰值电流均与扫描速率无关[17]。因此,可判断Zn(Ⅱ)在ChCl-Urea DES中的氧化还原反应为不可逆电极反应过程,且不可逆程度较大。为验证上述判断的正确性,作出并拟合了还原峰电位p与lg的关系,如图3a所示。由图3a可看出,还原峰电位p与lg之间为线性关系,进一步证明了Zn(Ⅱ)在ChCl-Urea DES中的还原反应为不可逆电极反应。对氧化峰进行同样处理发现,Zn(Ⅱ)的氧化过程也为不可逆电极反应过程。
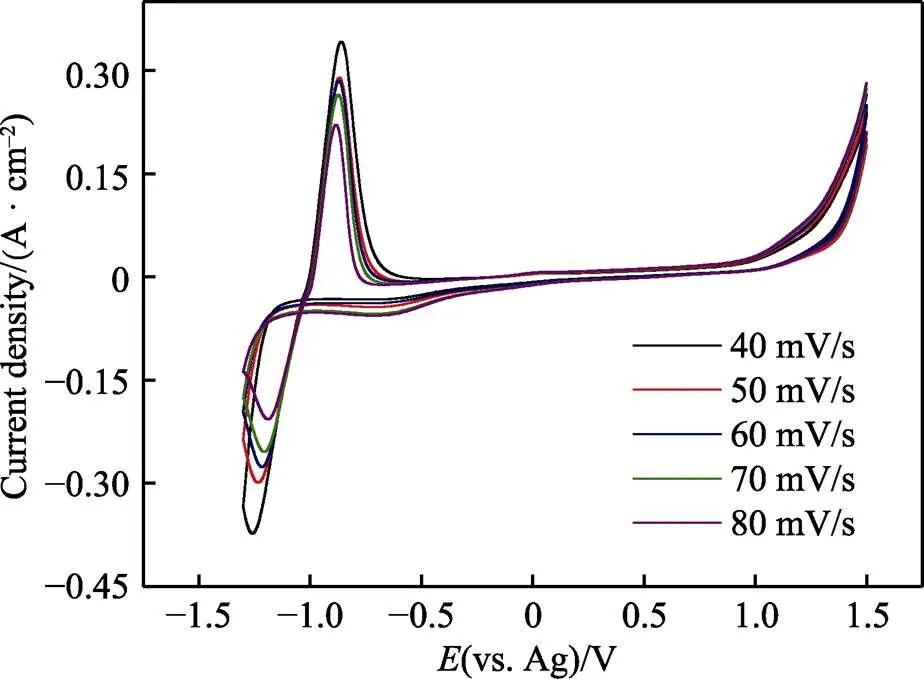
图2 –1.5~1.5 V电位范围内含0.5 mol/L ZnCl2的ChCl-Urea DES在不同扫描速率下的循环伏安曲线
表1 ChCl-Urea-ZnCl2体系在不同扫描速率下的循环伏安曲线还原峰数据
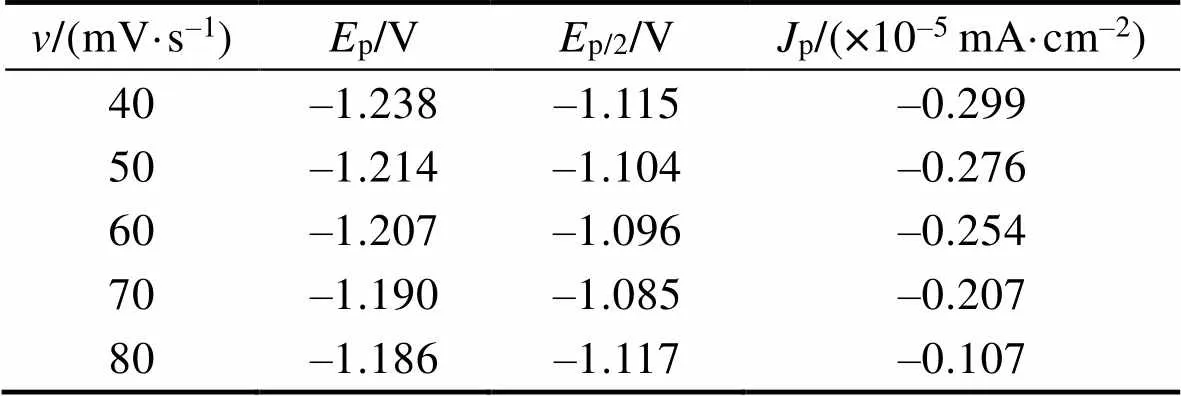
Tab.1 Data of reduction peak of cyclic voltammetry at different scan rates in ChCl-Urea-ZnCl2 system
为进一步研究ChCl-Urea DES中Zn(Ⅱ)还原反应的控制步骤,对还原峰峰值电流p和1/2的关系进行了线性拟合,如图3b所示。还原峰峰值电流p与1/2之间为线性关系,这说明在ChCl-Urea DES中,Zn(Ⅱ)的还原反应是受扩散控制的。在受扩散控制的不可逆电化学反应体系中,数据之间存在以下关系[15]:
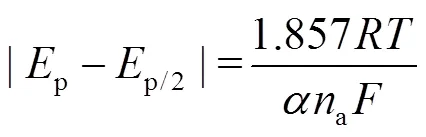
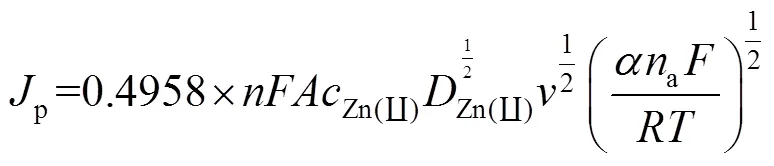
式中:p为峰值电流密度,A/cm2;、a为电子转移数;为法拉第常数,=96 485 C/mol;为Zn(Ⅱ)的浓度,mol/mL;为Zn(Ⅱ)的扩散系数,cm2/s;为扫描速率,V/s;为电子转移系数;为气体常数,8.314 J/(mol·K);为温度,K。
将循环伏安曲线中的数据(表1)带入式1可以得到电子转移系数Zn(Ⅱ)为0.268。假定ChCl-Urea DES中锌离子的还原反应为严格的不可逆电极反应过程,则由式2可以得到扩散系数Zn(Ⅱ)为6.67× 10‒8cm2/s。综上可知,锌在ChCl-Urea DES中发生的氧化还原反应是受扩散控制的不可逆电极反应过程。
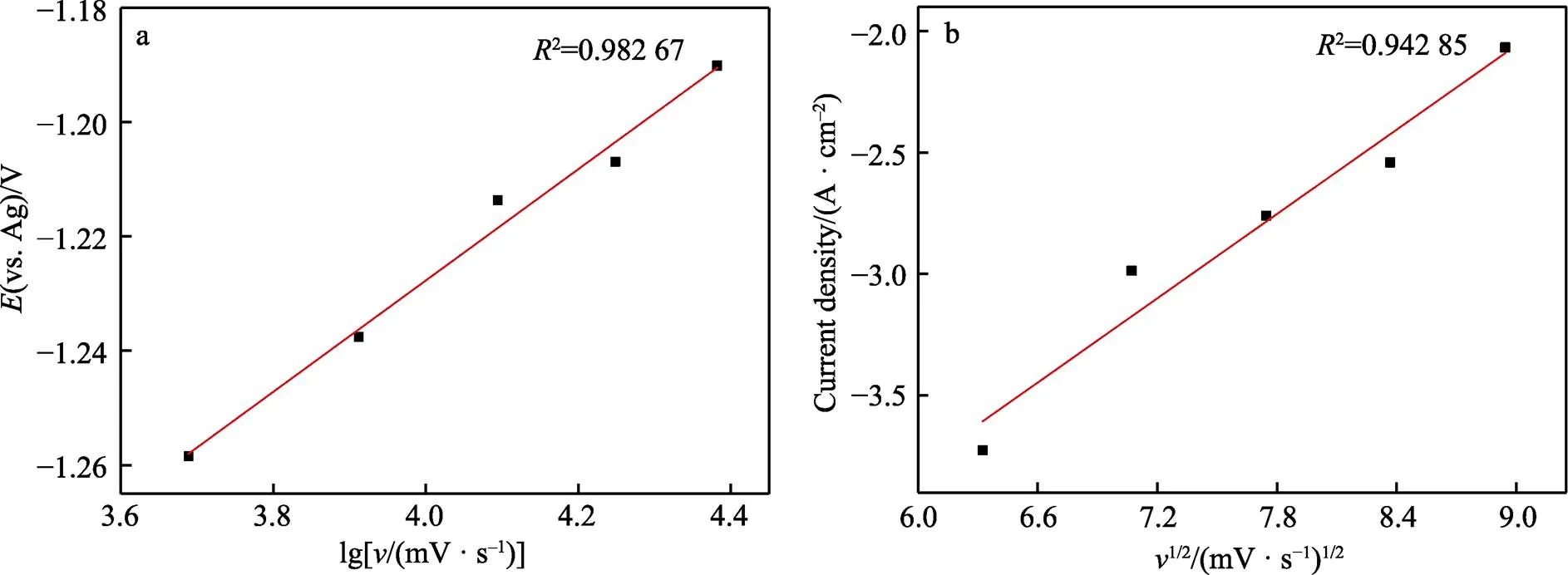
图3 还原峰电位Ep和lgv的关系(a)和还原峰电流Ip和扫描速率v1/2的关系(b)
2.2 Zn(Ⅱ)的电结晶机理研究
液相体系中金属原子的成核方式一般分为二维形核和三维形核,这两种成核方式还可具体分为瞬时成核和连续成核。其中,瞬时成核为晶核快速、大量、均匀地在基体表面形成,成核点的数量与时间几乎无关,金属原子在各个晶核位点上生长;连续成核则是成核位点的数量随时间的增加而逐渐增多,金属原子的生长位置只能伴随时间的变化而从旧位点移到新位点。
图4a为不同电位下ChCl-Urea-ZnCl2DES的计时电流曲线。由图4a可知,曲线均呈现出先升高后降低的趋势。初始阶段,由于金属锌的形核和生长,导致电流密度达到峰值,随后由于扩散控制生长而导致电流密度发生衰减。此外,由图4a可以发现,随着沉积电位的负移,形核驰豫时间m逐渐增大,且m值逐渐减小,这说明过电位的增大导致形核速率降低,从而使得形核诱导时间增加[18]。
金属在异质基体上的成核方式通常符合三维形核模式[19]。根据Scharifker-Hill三维形核模型[20](式3和式4)对计时电流曲线(图4a)进行相应的(2/2m)- (/m)无量纲处理,结果如图4b所示。
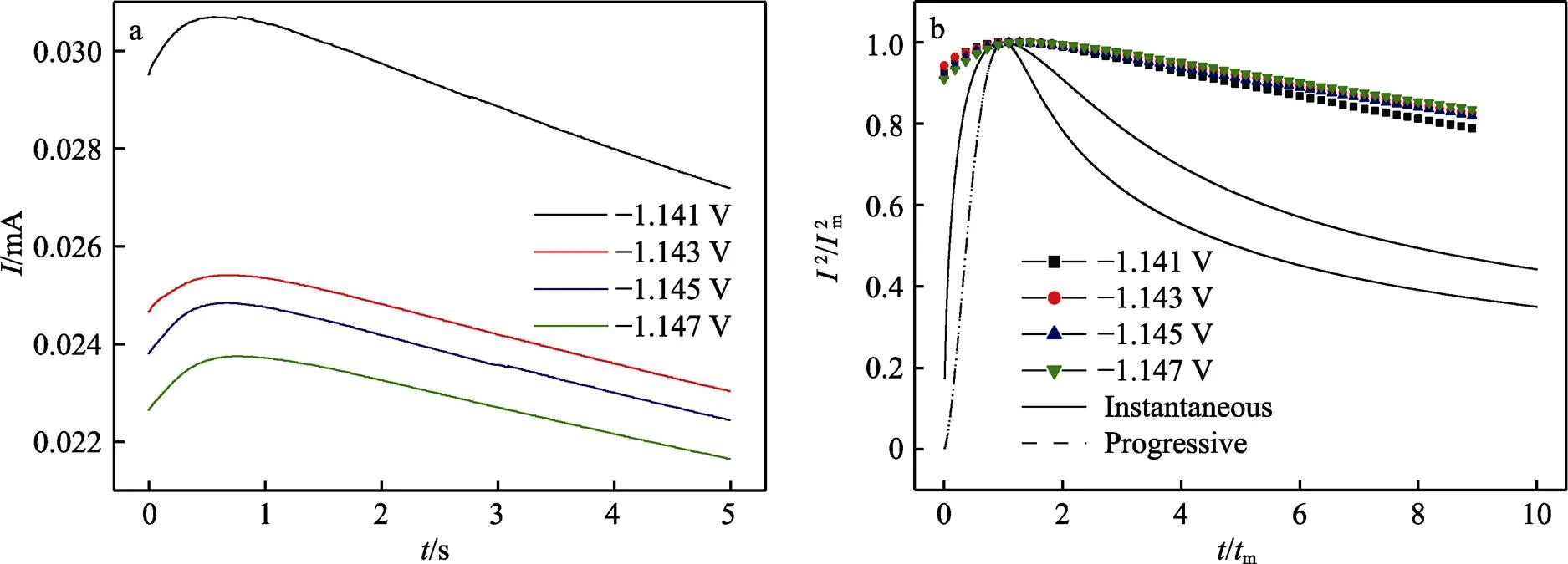
图4 不同电位下ChCl-Urea-ZnCl2 DES的计时电流曲线(a)和(i2/i2m)-(t/tm)曲线(b)
三维瞬时成核:
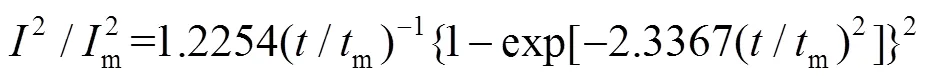
三维连续成核:
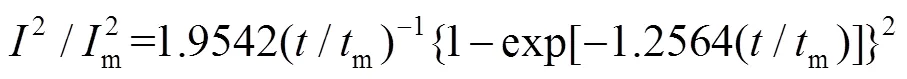
式中:和m分别表示电流和电流的最大值;和m分别表示时间和电流达到最大值时的时间。由图5b可以看出,其初期显示出较高的成核密度,曲线高于三维瞬时成核理论曲线,具有高爆发性,后期则由于扩散控制,曲线呈下降的趋势,整体趋势与三维瞬时成核和三维连续成核类似。但可以发现,Zn(Ⅱ)在ChCl-Urea DES中的形核方式均不满足这两类成核方式,而是一种具有两种成核方式特征的混合成核方式。
2.3 Zn在ChCl-Urea DES中的电沉积历程
为进一步研究ChCl-Urea DES中锌的电沉积历程,在温度60 ℃和沉积电位‒1.145 V的条件下分别沉积10、30、60、90 min,所得微观形貌如图5所示。从图5中可以观察到,沉积时间为10 min(图5a)时,基材表面有灰黑色立体的、细小且粒径均一的颗粒状物质生成,且呈条带状分布,这是由于Zn2+在ChCl-Urea DES中的扩散十分缓慢,且在短时间内锌的电结晶过程主要受瞬时成核的支配。而根据瞬时成核机理,镀层在基体表面逐层生长,容易形成条带状痕迹,这也进一步表明在ChCl-Urea DES中锌初期的成核方式为瞬时成核。当沉积时间增加至30 min(图5b)时,灰色颗粒状物质在原形核位点上生长变大,呈现大小颗粒交叠存在的六方形立体结构。此时,锌的电结晶过程倾向于三维连续成核,即电结晶过程中不断有新形核位点的形成,从而导致锌颗粒大小不一。沉积时间达到60 min(图5c)时,成核速度加快,先前形成的小颗粒极易连成串,故晶粒由六方形结构逐渐变成线状或棒状的结构[21]。沉积时间达到90 min(图5d)时,线状或棒状的结构逐渐堆叠合并,转变为六方形的片晶。这可能是由于电沉积时间较长,体系中Zn2+的浓度降低,Zn2+向电极的扩散速度变慢,从而导致尺寸较小的颗粒逐渐将线状或棒状结构的晶粒连接成六方形片晶。
2.4 锌镀层的截面形貌及物相组成
ChCl-Urea DES中,在沉积温度为60 ℃、沉淀电压为‒1.145 V、沉积时间为90 min的条件下,所得锌镀层的截面形貌见图6。由图6可以发现,锌镀层的厚度约为40 μm,锌镀层均匀致密,无断带裂纹,且与基体结合良好。为了进一步确定ChCl-Urea DES中锌镀层的物相组成,对上述锌镀层进行XRD测试,结果如图7所示。与标准卡比对发现,锌镀层主要由六方结构的多晶锌组成。在36.29°、38.99°、43.22°、54.32°、70.63°、77.05°、82.09°和86.54°可以看到锌镀层的衍射峰,分别对应于(002)、(100)、(101)、(102)、(103)、(110)、(112)、(201)晶面。

图5 不同沉积时间下锌镀层的微观形貌

图6 ChCl-Urea-ZnCl2体系中锌镀层的截面形貌
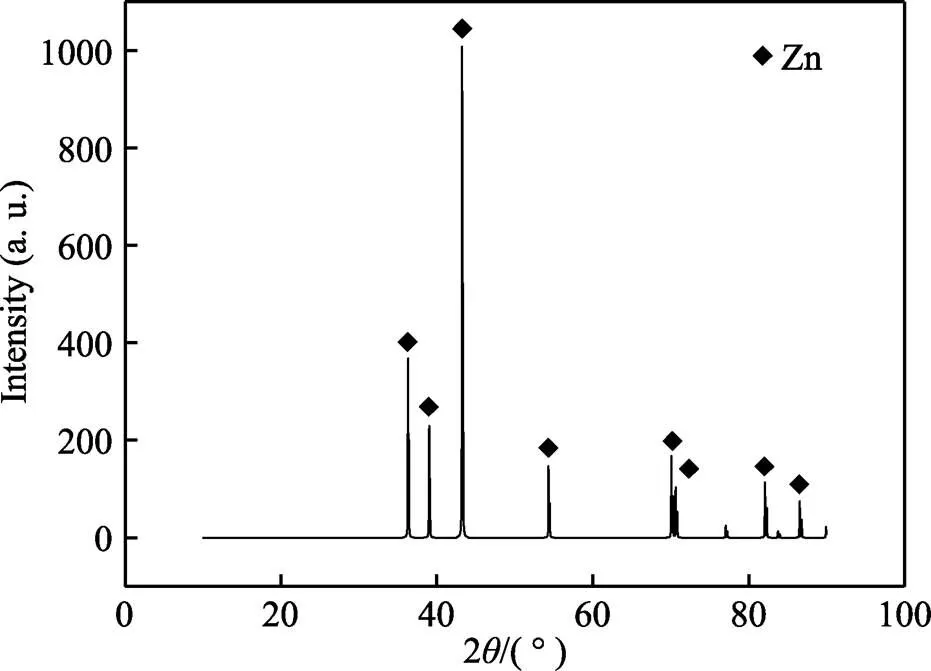
图7 ChCl-Urea-ZnCl2体系中锌镀层的XRD谱图
2.5 耐蚀性结果
2.5.1 动电位极化曲线
在3.5% NaCl溶液中对ChCl-Urea DES和水溶液中得到的锌镀层分别进行动电位极化曲线测试,结果如图8所示。其中,水溶液中的锌镀层是在氧化锌10 g/L、氢氧化钠130 g/L和温度40 ℃的条件下得到的。由图8可以看出,两个体系中锌镀层的动电位极化曲线相似,ChCl-Urea DES和水溶液中的锌镀层均呈现出活性溶解的特征,且两者阴、阳极塔菲尔斜率十分相近。通过塔菲尔直线反推法拟合得到自腐蚀电位corr和自腐蚀电流密度corr,结果列于表2。由表2可以发现,两个体系中锌镀层的自腐蚀电位十分接近,水溶液中锌镀层的自腐蚀电流密度略低于ChCl-Urea DES中锌镀层的自腐蚀电流密度,这表明ChCl-Urea DES中可获得与水溶液中耐蚀性相当的锌镀层。同时通过称量实验得到,ChCl-Urea DES中锌镀层的沉积速率(0.009 13 g/(dm2·min))略高于水溶液中的沉积速率(0.003 03 g/(dm2·min))。
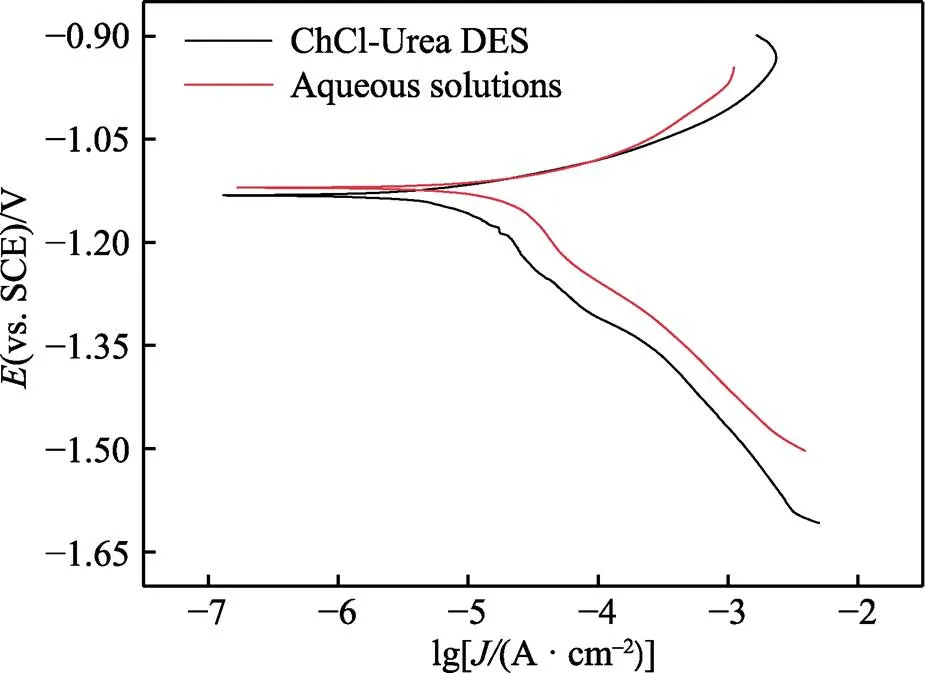
图8 两个体系中锌镀层在3.5% NaCl溶液中的动电位极化曲线
表2 ChCl-Urea DES和水溶液中锌镀层极化曲线的拟合结果
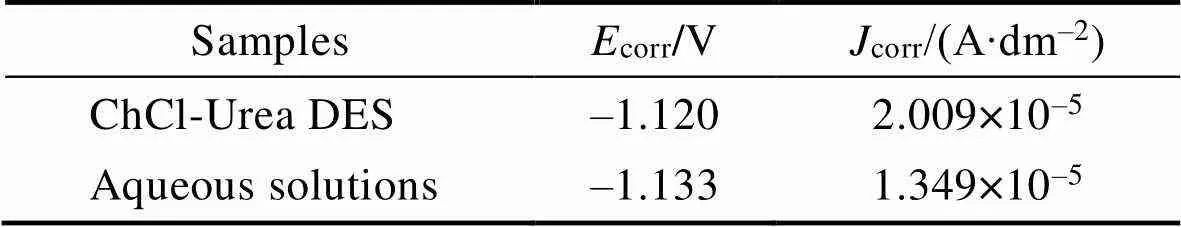
Tab.2 Parameters extracted from potentiodynamic polarization curves of zinc coatings in ChCl-Urea deep eutectic solvents and aqueous solutions
2.5.2 电化学阻抗谱
为了进一步研究ChCl-Urea DES中锌镀层的耐蚀性能,对其进行电化学阻抗谱(EIS)测试,相应的Nyquist曲线如图9所示。从图9可以看出,在整个频率范围内,两个体系的Nyquist图均呈现出相似的特征,即由低频容抗弧和高频容抗弧组成。具体而言,低频容抗弧来自于锌镀层在测试介质中的电荷转移电阻和双电层电容的贡献,而高频容抗弧通常反映锌镀层腐蚀产物膜的信息[22],这表明两个体系中锌镀层在3.5% NaCl溶液中均产生了腐蚀产物膜。此外,两个体系的阻抗谱均呈现出两个时间常数的特征,即表现为电极电位和表面覆盖率两个状态变量的驰豫过程。选取图10所示的等效电路图模型(其中,s为溶液电阻,f为产物膜电阻,ct为电荷转移电阻,f和dl分别为产物膜电容和锌镀层双电层电容)对Nyquist曲线进行拟合,拟合数据如表3所示。由图9可以看出,拟合结果(红线)与实验数据能较好的吻合。
图10所示的等效电路中,一般来说,电荷转移电阻ct可以代表锌镀层电化学反应速度;产物膜电阻f反映产物膜对腐蚀介质的阻挡作用;而它们之和的倒数,即1/(f+ct),一定程度上则可以表示腐蚀速率。由表3的结果可知,ChCl-Urea DES中锌镀层的电荷转移电阻稍低于水溶液,表明ChCl-Urea DES中所得锌镀层的电化学反应速度略慢;而ChCl- Urea DES中锌镀层的产物膜电阻稍大于水溶液,表明ChCl-Urea DES中所得锌镀层腐蚀后膜的阻挡作用略好;而两种体系下1/(f+ct)的值相当,表明两种体系中锌镀层的腐蚀速率相当,这与动电位极化曲线的结果相符。
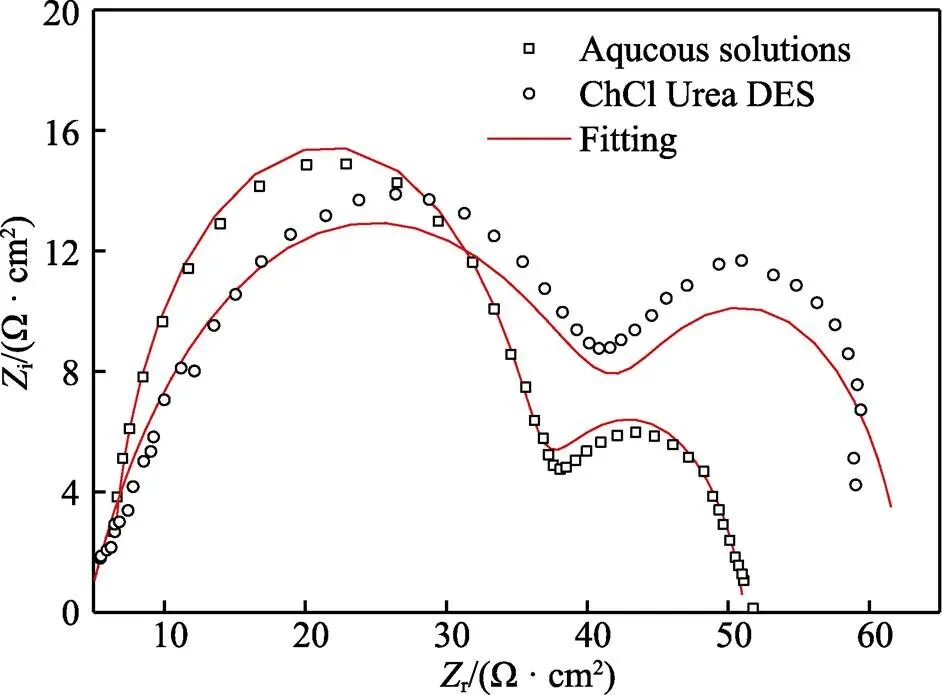
图9 两个体系中锌镀层在3.5% NaCl溶液中的Nyquist图
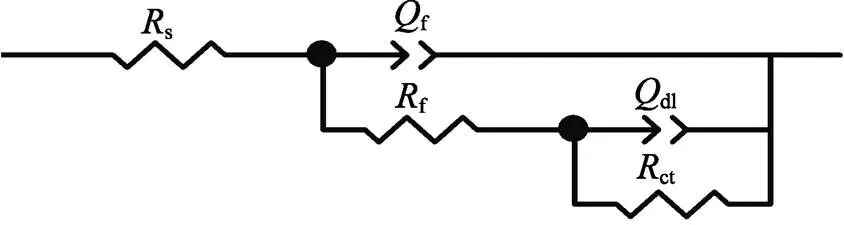
图10 两个体系中锌镀层在3.5% NaCl溶液中EIS结果对应的等效电路图
表3 两个体系中锌镀层在3.5% NaCl溶液中EIS数据的拟合结果
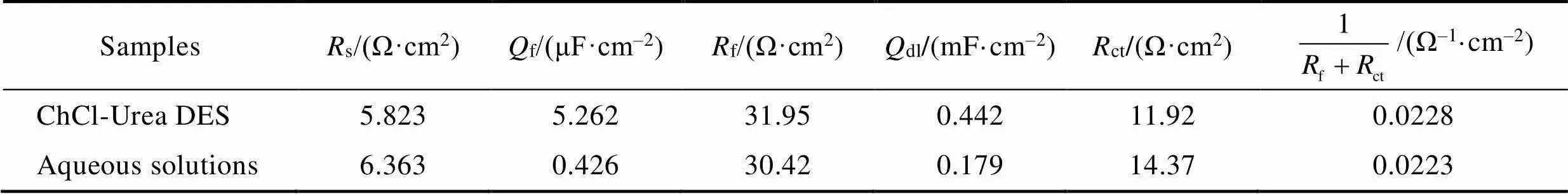
Tab.3 Fitting results of EIS data of zinc coating in eutectic solvent and aqueous solution in 3.5% NaCl solution
3 结论
1)循环伏安测试表明,Zn(Ⅱ)在ChCl-Urea DES中是一步还原及氧化,还原反应是受扩散控制的不可逆电极反应过程,且扩散系数Zn(Ⅱ)为6.67× 10‒8cm2/s。
2)计时电流测试表明,Zn(Ⅱ)在ChCl-Urea DES中的形核方式既不符合三维瞬时成核,也不符合三维连续成核,而是具有两种形核方式特征的混合形核。
3)SEM结果表明,不同沉积时间下锌镀层的微观形貌相差较大。随着沉积时间的增加,锌晶粒由最初细小、粒径均一的颗粒逐渐变化成大小颗粒交叠存在的六方形立体结构,然后又变成线状或棒状的结构,最终转变为六方形的片状晶粒。XRD表明,锌镀层是由六方晶相的多晶锌构成的。
4)动电位极化曲线和电化学阻抗谱表明,在不添加任何添加剂的情况下,ChCl-Urea DES可获得与水溶液耐蚀性相当的锌镀层,且ChCl-Urea DES中锌镀层的沉积速率略高于水溶液。
[1] 张启富, 刘邦津, 仲海峰. 热镀锌技术的最新进展[J]. 钢铁研究学报, 2002, 14(4): 65-72.
ZHANG Qi-fu, LIU Bang-jin, ZHONG Hai-feng. Development Trend of Hot-Dip Galvanizing Technology[J]. Journal of Iron and Steel Research, 2002, 14(4): 65-72.
[2] ALESARY H F, CIHANGIR S, BALLANTYNE A D, et al. Influence of Additives on the Electrodeposition of Zinc from a Deep Eutectic Solvent[J]. Electrochimica Acta, 2019, 304: 118-130.
[3] 安茂忠. 电镀锌及锌合金发展现状[J]. 电镀与涂饰, 2003, 22(6): 35-40.
AN Mao-zhong. Current Development of Zinc and Zinc Alloy Electroplating[J]. Electroplating & Finishing, 2003, 22(6): 35-40.
[4] 焦莎, 刘燕, 万冰华, 等. 碱性无氰镀锌液组成和阴极电流密度对电流效率与锌层外观的影响[J]. 电镀与涂饰, 2015, 34(24): 1395-1399.
JIAO Sha, LIU Yan, WAN Bing-hua, et al. Effect of Bath Composition and Cathodic Current Density on Current Efficiency of Cyanide-Free Alkaline Zinc Plating and Appearance of Zinc Coating[J]. Electroplating & Finishing, 2015, 34(24): 1395-1399.
[5] KUDŁAK B, OWCZAREK K, NAMIEŚNIK J. Selected Issues Related to the Toxicity of Ionic Liquids and Deep Eutectic Solvents—a Review[J]. Environmental Science and Pollution Research International, 2015, 22(16): 11975- 11992.
[6] BRETT C M A. Deep Eutectic Solvents and Applications in Electrochemical Sensing[J]. Current Opinion in Electrochemistry, 2018, 10: 143-148.
[7] TOMÉ L I N, BAIÃO V, DA SILVA W, et al. Deep Eutectic Solvents for the Production and Application of New Materials[J]. Applied Materials Today, 2018, 10: 30-50.
[8] ABO-HAMAD A, HAYYAN M, ALSAADI M A, et al. Potential Applications of Deep Eutectic Solvents in Nanotechnology[J]. Chemical Engineering Journal, 2015, 273: 551-567.
[9] SMITH E L, ABBOTT A P, RYDER K S. Deep Eutectic Solvents (DESs) and Their Applications[J]. Chemical Reviews, 2014, 114(21): 11060-11082.
[10] ABBOTT A P, CAPPER G, MCKENZIE K J, et al. Electrodeposition of Zinc-Tin Alloys from Deep Eutectic Solvents Based on Choline Chloride[J]. Journal of Electroanalytical Chemistry, 2007, 599(2): 288-294.
[11] ABBOTT A P, BARRON J C, RYDER K S. Electrolytic Deposition of Zn Coatings from Ionic Liquids Based on Choline Chloride[J]. Transactions of the IMF, 2009, 87(4): 201-207.
[12] ABBOTT A P, BARRON J C, FRISCH G, et al. The Effect of Additives on Zinc Electrodeposition from Deep Eutectic Solvents[J]. Electrochimica Acta, 2011, 56(14): 5272-5279.
[13] 雷震, 徐存英, 华一新, 等. ChCl-Urea-ZnO低共熔溶剂体系的电化学行为[J]. 化工学报, 2017, 68(8): 3301-3309.
LEI Zhen, XU Cun-ying, HUA Yi-xin, et al. Eelectrochemical Behaviors of ZnO in Choline Chloride-Urea Deep Eutectic Solvents[J]. CIESC Journal, 2017, 68(8): 3301-3309.
[14] YANG H Y, GUO X W, CHEN X B, et al. On the Electrodeposition of Nickel-Zinc Alloys from a Eutectic-Based Ionic Liquid[J]. Electrochimica Acta, 2012, 63: 131-138.
[15] CHU Qing-wei, LIANG Jun, HAO Jing-cheng. Electrodeposition of Zinc-Cobalt Alloys from Choline Chloride- Urea Ionic Liquid[J]. Electrochimica Acta, 2014, 115: 499- 503.
[16] YUE Du-yuan, JIA Yong-zhong, YAO Ying, et al. Structure and Electrochemical Behavior of Ionic Liquid Analogue Based on Choline Chloride and Urea[J]. Electrochimica Acta, 2012, 65: 30-36.
[17] PEREIRA N M, PEREIRA C M, ARAÚJO J P, et al. Zinc Electrodeposition from Deep Eutectic Solvent Containing Organic Additives[J]. Journal of Electroanalytical Chemistry, 2017, 801: 545-551.
[18] 李瑞乾, 梁军, 初青伟. 氯化胆碱-乙二醇低共熔溶剂中电沉积纳米晶镍[J]. 中国有色金属学报, 2014, 24(7): 1839-1845.
LI Rui-qian, LIANG Jun, CHU Qing-wei. Electrodeposition of Nanocrystalline Ni from Choline Chloride and Ethylene Glycol Deep Eutectic Solvent[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(7): 1839-1845.
[19] TSUDA T, NOHIRA T, ITO Y. Nucleation and Surface Morphology of Aluminum-Lanthanum Alloy Electrodepsited in a LaCl3-Saturated AlCl3-EtMeImCl Room Temperature Molten Salt[J]. Electrochimica Acta, 2002, 47(17): 2817-2822.
[20] SCHARIFKER B, HILLS G. Theoretical and Experimental Studies of Multiple Nucleation[J]. Electrochimica Acta, 1983, 28(7): 879-889.
[21] 魏献军, 李红星, 汤宏伟, 等. 混合离子液体中锌的电化学结晶及生长机理[J]. 河南师范大学学报(自然科学版), 2009, 37(5): 83-88.
WEI Xian-jun, LI Hong-xing, TANG Hong-wei, et al. Electrochemical Nucleation and Growth Mechanism of Zn from a Mixed Ionic Liquid[J]. Journal of Henan Normal University (Natural Science), 2009, 37(5): 83-88.
[22] SUN Hai-jing, LIU Li, LI Ying, et al. Effect of Hydrostatic Pressure on the Corrosion Behavior of a Low Alloy Steel[J]. Journal of the Electrochemical Society, 2013, 160(3): C89-C96.
Electrodeposition Studies of Zinc in Choline Chloride-Urea Deep Eutectic Solvents
,,,,,,,,
(School of Environmental and Chemical Engineering, Shenyang Ligong University, Shenyang 110159, China)
The work aims to study the electrochemical behavior, electrocrystallization mechanism, electrodeposition process of zinc and corrosion resistance in the Choline Chloride-Urea deep eutectic solvent (ChCl-Urea DES). The electrochemical behavior and electrocrystallization mechanism of zinc on glass-carbon electrode were studied by Cyclic Voltammetry (CV) and chronoamperometry (CA). The micro-morphology and phase composition of zinc coatings were characterized by scanning electron microscopy (SEM) and X-ray diffraction (XRD). Comparative study of the corrosion resistance and electrochemical impedance spectroscopy of zinc plating in ChCl-Urea DES and aqueous solutions using dynamic potential polarization curves. The CV test shows that only one pair of redox peaks appears in the whole redox process, which indicates that Zn(II) is a one-step reduction and oxidation in ChCl-Urea DES, and the reduction peak potential (vs. Ag) is ‒1.207 V. The CV curves at different scan rates show that the peak potentials of both the reduction and oxidation peaks are regular with the scan rateThe positive shift, and the regular decrease of both peak currentspwith increasing scan rate, are consistent with the irreversible electrode reaction. The relationship betweenpand1/2was fitted linearly, and the relationship betweenpand1/2was found to be good, so the reduction reaction of Zn(II) in ChCl-Urea DES could be considered to be controlled by diffusion, and the diffusion coefficientZn(II)was further calculated to be 6.67×10‒8cm2/s. The nucleation mode of Zn(II) in ChCl-Urea DES is neither three-dimensional instantaneous nucleation nor three-dimensional continuous nucleation, but a hybrid nucleation with two nucleation modes. The microscopic morphology of zinc coatings varies considerably depending on the deposition time. The XRD shows that the coating is composed of polycrystalline zinc with hexagonal crystalline phase. Potentiodynamic polarization curve test and electrochemical impedance spectroscopy showed that without any additives, the corrosion resistance of zinc coating in CHCl urea DES was equivalent to that in aqueous solution, and the formation rate of zinc coating in CHCl urea DES was slightly higher than that in aqueous solution. The electrodeposition of Zn(II) in ChCl-Urea DES is a diffusion-controlled irreversible electrode process with a nucleation mode that is neither three-dimensional instantaneous nor three-dimensional continuous, but rather a hybrid nucleation mode characterized by two nucleation modes. The zinc coating is composed of polycrystalline zinc with a hexagonal crystal phase. Comparable corrosion resistance can be obtained in ChCl-Urea DES as in aqueous solutions.
deep eutectic solvent; ionic liquid; electrodeposition; zinc; nucleation mechanism; micro-morphology; corrosion resistance

TG174
A
1001-3660(2022)02-0268-08
10.16490/j.cnki.issn.1001-3660.2022.02.026
2021-04-02;
2021-07-21
2021-04-02;
2021-07-21
辽宁省教育厅青年科技人才“育苗”项目(LG201928);辽宁省-沈阳材料科学国家研究中心联合研发基金项目(2019JH3/30100021)
Supported by the “Seedling Cultivation” Project for Young Scientific and Technological Talents of Liaoning Education Department (LG201928); the Joint Research and Development Fund of Liaoning-Shenyang National Research Center for Materials Science (2019JH3/30100021)
孙海静(1985—),女,博士,副教授,主要研究方向为表面处理。
SUN Hai-jing (1985—), Female, Ph. D., Associate professor, Research focus: surface engineering.
孙杰(1971—),男,博士,教授,主要研究方向为金属的腐蚀行为及先进防护方法。
SUN Jie (1971—), Male, Ph. D., Professor, Research focus: corrosion behaviors of metal and advanced surface engineering.
孙海静, 王贺, 杨帅, 等. 氯化胆碱-尿素低共熔溶剂中锌的电沉积研究[J]. 表面技术, 2022, 51(2): 268-275.
SUN Hai-jing, WANG He, YANG Shuai, et al. Electrodeposition Studies of Zinc in Choline Chloride-Urea Deep Eutectic Solvents[J]. Surface Technology, 2022, 51(2): 268-275.
