杂交鲷与黑鲷投喂频率的比较研究
2022-03-02仇玉燕张志勇陈淑吟倪可雯贾超峰张志伟汤晓建
仇玉燕,张志勇,陈淑吟,倪可雯,贾超峰,孟 乾,祝 斐,张志伟,汤晓建
1.上海海洋大学/水产科学国家级实验教学示范中心 ,上海 201306
2.江苏省海洋水产研究所,江苏 南通 226007
投喂频率对养殖鱼类的生长、发育有显著影响[1-2]。适宜的投喂频率可以最大程度地促进鱼体生长、降低个体分化差异、提高饵料利用率等[3-4];反之则会对鱼类生长、代谢造成危害,由于关系到养殖效益及生态环境,对集约化鱼类养殖的影响尤为明显[5-6];探究所饲鱼种的最优投喂频率关系到集约化养殖的成败。不同鱼类的最适投喂频率不同;每天3次的饱食投喂频率就可满足11~60 g的牙鲆 (Paralichthys olivaceus) 的最大生长性能[7];而1~16 g的锯盖鱼 (Centropomus undecimalis) 幼鱼的最适投喂频率是每天4~6次[8]。最适投喂频率的确定还受到鱼体年龄、大小的影响,如点带石斑鱼(Epinephelus coioides) 个体规格越大,生长阶段越靠后,其最适宜投喂频率越低[9]。
大量研究表明,投喂频率与鱼体的生长发育[10-14]、消化代谢[15-19]和免疫应激[20-23]等显著相关。如投喂频率采用 1 次·2 d−1和 1 次·3 d−1的大西洋鲑(Salmo salar) 鱼体质量增加率较 3 次·d−1的分别降低了50%和75%[10];(35.5±4.58) g的珍珠龙胆石斑鱼 (E.fuscoguttatus♀×E.lanceolatus♂) 幼鱼以2次·d−1投喂的增重率和特定生长率显著高于1 次·d−1的[11];(55.25±0.61) g 彭泽鲫 (Carassius auratusvarpengze) 幼鱼以 3 次·d−1投喂的增重率、特定生长率和肥满度等生长指标较1次·d−1的显著升高了47%、37%和6.5%[12]。15 g的红鳍东方鲀(Takifugu rubripes) 幼鱼以 3 次·d−1投喂的消化酶活性显著高于 2 次·d−1和 4 次·d−1的[17];(0.57±0.01) g的厚颌鲂 (Megalobrama pellegrini) 幼鱼以 3 次·d−1投喂的肠消化酶活性显著高于2次·d−1的[18];(88.3±2.4) g金头鲷投喂频率超过1次·d−1时其胃蛋白酶活力显著下降[19]。(12.29±0.40) g的青鱼 (Mylopharyngodon piceus) 幼鱼以 3 次·d−1投喂时,其体脂肪含量与抗氧化酶活力显著升高[20];(0.5±0.04) g的黄颡鱼幼鱼投喂频率从 1次·d−1升至 4次·d−1时,其肝脏超氧化物歧化酶和过氧化氢酶mRNA的表达量显著升高[21];投喂频率为4次·d−1时,(4.14±0.74) g的长鳍篮子鱼 (Siganus canaliculatus) 幼鱼的谷草转氨酶、谷丙转氨酶活力显著升高[22]。因此,了解主要养殖鱼类的最适投喂频率及其生理响应情况,有助于开展持续、高效的养殖工作[2,4]。
黑鲷 (Acanthopagrus schlegelii, ♀)×真鲷 (Pagrus major, ♂)的杂交F1在生长方面有优于黑鲷的表现[24-26];以杂交F1为亲本,获得的杂交F2(暂定名为“杂交鲷”),在早期发育阶段亦表现出明显的生长优势[27];笔者有关杂交鲷与黑鲷生长相关基因的检测也得到了相似的结果 (另文发表)。目前尚未见杂交鲷与黑鲷幼鱼在不同投喂频率下生长、生理等方面的差异研究报道。本研究以黑鲷 (♀)×真鲷 (♂) 杂交F2和黑鲷幼鱼为研究对象,探讨比较了杂交鲷和黑鲷幼鱼在不同投喂频率下的生长性能、生理生化指标的差异表现,以期在改善生长性能的同时提高饲料利用率,为杂交鲷的投喂管理和新品种培育技术的开发提供参考依据。
1 材料与方法
1.1 实验鱼来源及规格
实验在江苏省南通市海水种苗繁育及增养殖技术中心进行。选择相同规格的健康个体作为样本,杂交 F2体质量 (6.42±0.14) g,体长 (5.70±0.11) cm;黑鲷体质量 (6.52±0.23) g,体长 (5.86±0.14) cm。
1.2 实验设计
实验在室内4 m×3.2 m×3.2 m水泥池中进行。设置 4 个投喂频率组 (1T:1 次·d−1、2T:2 次·d−1、3T:3 次·d−1、4T:4 次·d−1) 。投喂时间设置为 1T组18:00,2T组 7:00、18:00,3T组 7:00、11:00、18:00 ,4T 组 7:00、11:00、15:00、18:00。采用定制的粗蛋白质量分数≥40.0%的海水鱼配合饲料。根据鱼体规格调整饲料粒径大小,前期投喂定制海水鱼1号配合饲料,后期改喂定制海水鱼2号配合饲料。饱食投喂,记录投喂量,每次持续投喂约40 min,而后回收并记录残饵量。
正式实验前,将实验鱼先暂养适应1周。同一投喂频率的两种鱼饲养于同一水泥池的不同网箱内,网箱尺寸为1 m×1 m×1.2 m,3个网箱并排为一组,即每个实验组设3个重复,2种鱼的放养密度均为每个网箱60尾。各实验组投喂管理一致,实验周期40 d。实验期间观察并记录死亡鱼尾数。
实验期间水质因子采用在线探头监测,水温22~29 ℃,pH 7.5~8.2,盐度29~30,氨氮质量浓度<0.2 mg·L−1。24 h持续充气,水中溶解氧质量浓度>6.0 mg·L−1。每天换水1次,日换水量超过50%,自然光照。
1.3 样品采集与指标测定
分别在养殖的第0 (实验开始)、第15、第30和第40天 (实验结束) 从每个网箱中随机取样6尾(N=6) 进行体长、体质量测量。实验结束 (第40天时),实验鱼停止投喂24 h后开始采样。采样时,随机从每个网箱里取6尾鱼,快速解剖,取胃、肝脏等组织速冻于液氮中,后转移到−80 ℃冰箱冷冻保存。
1.3.1 生长指标测定
投喂实验结束后,根据杂交F2和黑鲷的体长、终末体质量 (Final body mass, FBM),计算实验鱼的增重率 (Weight gain rate, WGR)、特定生长率(Special growth rate, SGR) 和肥满度 (Condition fact,CF);解剖后称取肝脏和内脏质量,计算肝体指数(Hepatosomatic index, HSI)、脏体指数 (Viscera somatic index, VSI);65 ℃烘干每次投喂结束后回收的残饵,称质量以计算摄食量 (Food intake, FI) 与饲料系数 (Feed conversion ratio, FCR),测定残饵溶失率,校正摄食量 (称取与投喂量相同质量的饵料,40 min后收集,65 ℃ 干燥,称量并计算溶失率);清算每个实验组的存活鱼尾数,计算成活率(Survival rate, SR);以体质量样本标准差和样本平均数之比计算体质量变异系数 (Coefficient of variation, CV)。公式如下:
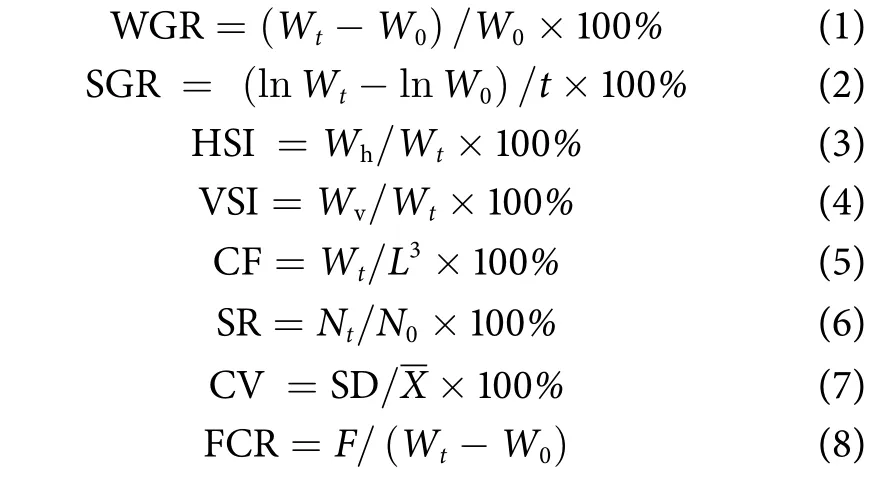
式中:Wt为实验结束时的体质量 (g);W0为实验开始的体质量 (g);t为实验天数 (d);Wh为肝脏质量;Wv为内脏质量;L为体长 (cm);Nt为实验结束时鱼尾数 (尾);N0为实验开始时鱼尾数(尾);SD为体质量样本标准差;X为体质量样本平均数;F为摄食量 (g)。
1.3.2 生理生化指标测定
取胃、肝脏组织测定消化酶及抗氧化酶活力。胃蛋白酶 (Pepsin)、脂肪酶 (Lipase, LPS)、α-淀粉酶 (α-Amylase, AMS)、总超氧化物歧化酶 (TSOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛 (MDA)、谷丙转氨酶 (ALT)、谷草转氨酶 (AST) 及碱性磷酸酶 (AKP) 活力均采用南京建成生物工程研究所试剂盒进行测定,测定方法参照说明书。
1.4 数据统计与分析
实验数据采用Excel 2019和SPSS 22.0软件进行分析,以“平均值±标准误 (±SE)”表示,差异显著 (P<0.05) 时,再采用Duncan's 法进行组间差异的多重比较。
2 结果
2.1 杂交鲷与黑鲷的生长性能和形态指标
实验结束时测得杂交F2和黑鲷的生长、形态与生理指标 (表1)。投喂频率从1T升至2T时,杂交F2与黑鲷的FBW、WGR、SGR、HSI及SR等指标显著升高 (P<0.05);投喂频率超过2T,两种鱼的F B W、W G R、S G R、S R无显著差异(P>0.05),HSI、VSI显著降低 (P<0.05)。投喂频率对两种鱼的CF、CV、FI和FCR无显著影响 (P>0.05)。由此可得出,2T的饱食投喂频率无论对杂交F2还是黑鲷均可获得较好的养殖效果。
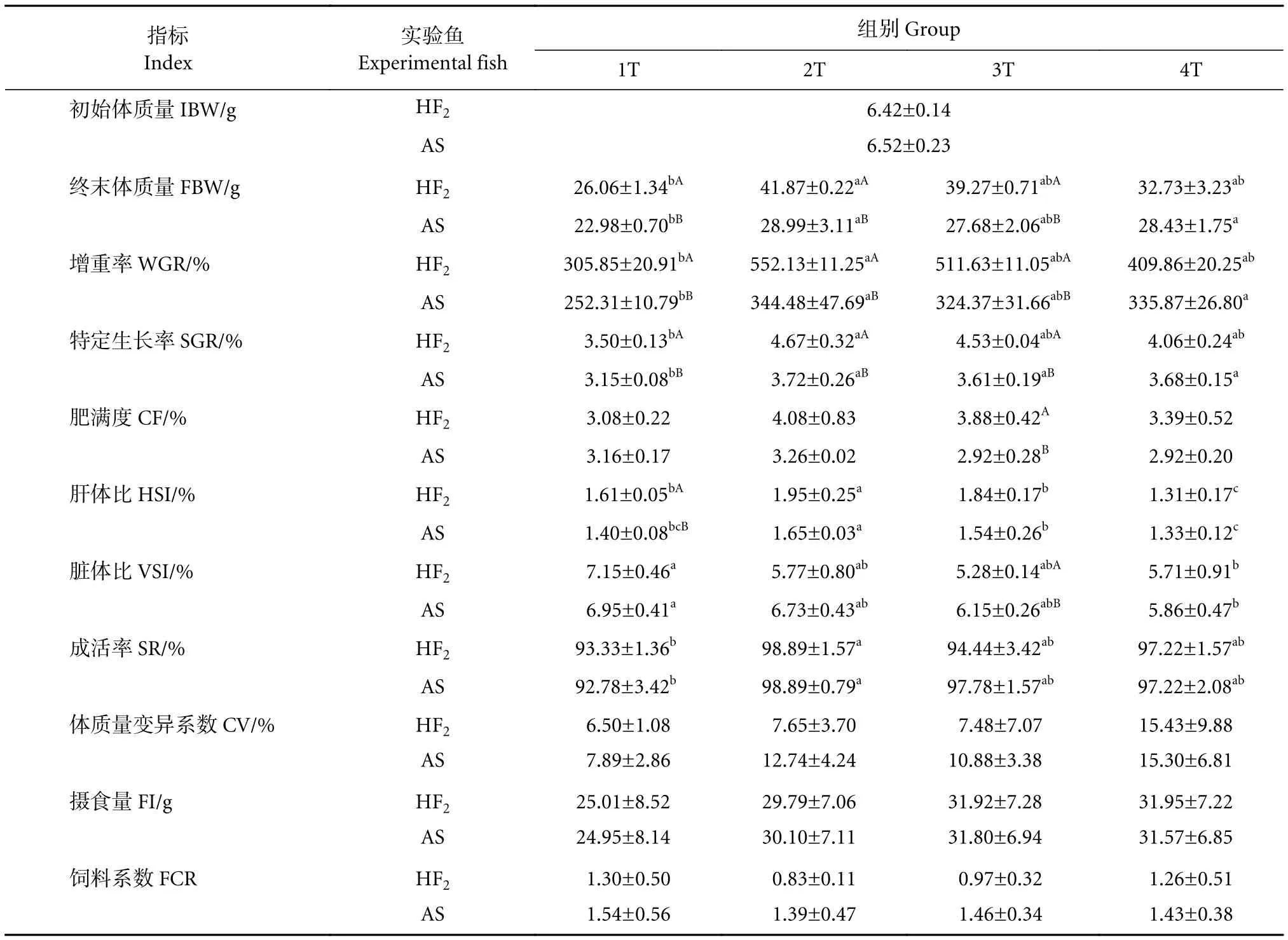
表1 不同投喂频率下杂交鲷与黑鲷生长性能和形态指标的变化差异Table 1 Difference of growth performance and morphological indexes of hybrid porgy of A.schlegelii ♀× P.major♂ and A.schlegelii with different feeding frequencies
相同投喂频率下,杂交F2在1T—3T组的FBW、WGR、SGR等指标均显著高于黑鲷 (P<0.05)。杂交F2在3T组中的CF、VSI和1T组中的HSI均显著高于黑鲷 (P<0.05)。杂交F2的饲料系数也有相对优于黑鲷的表现,其中2T组杂交F2的FCR为0.83±0.11,黑鲷为1.39±0.47。杂交F2的CV也优于黑鲷;相同频率下2种实验鱼的SR、FI等均无显著差异 (P>0.05)。
2.2 杂交鲷与黑鲷消化酶活力变化
投喂频率从1T升至2T时,杂交F2与黑鲷的胃蛋白酶、脂肪酶、α-淀粉酶等消化酶活力显著升高 (P<0.05);投喂频率超过2T,2种鱼的消化酶活力无显著变化 (P>0.05)。杂交F2在2T—4T组内的胃蛋白酶和2T组内的脂肪酶活力均显著高于黑鲷(P<0.05),但2种鱼的α-淀粉酶活力无显著差异(P>0.05,图1)。

图1 不同投喂频率下杂交鲷与黑鲷消化酶活力比较Fig.1 Comparison of digestive enzyme activities of hybrid porgy of A.schlegelii ♀× P.major♂ and A.schlegelii with different feeding frequencies
2.3 杂交鲷与黑鲷肝脏抗氧化指标变化
当投喂频率从1T升至3T时,杂交F2的 CAT、T-SOD活力显著增加 (P<0.05),GSH-Px活力无显著变化 (P>0.05);继续升高投喂频率至4T时,杂交F2的GSH-Px、CAT、T-SOD活力均显著下降 (P<0.05);但杂交F2的MDA活力不受投喂频率的影响。相同的投喂频率下,两种鱼的GSH-Px、MDA活力均无显著差异 (P>0.05);而4T组内杂交F2的CAT、T-SOD活力显著高于黑鲷 (P<0.05,图2)。
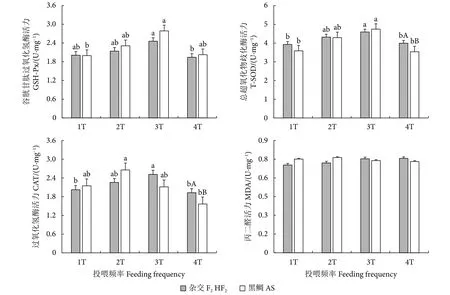
图2 不同投喂频率下杂交鲷与黑鲷肝脏抗氧化指标比较Fig.2 Comparison of liver antioxidant indexes of hybrid porgy of A.schlegelii ♀× P.major♂ and A.schlegelii with different feeding frequencies
2.4 杂交鲷与黑鲷肝功能指标变化
4种不同投喂频率下,杂交F2与黑鲷的ALT、AST和AKP等主要肝功能指标均无显著变化(P>0.05)。且在同一投喂频率下,杂交F2与黑鲷的肝功能指标也无显著性差异(P>0.05,图3)。
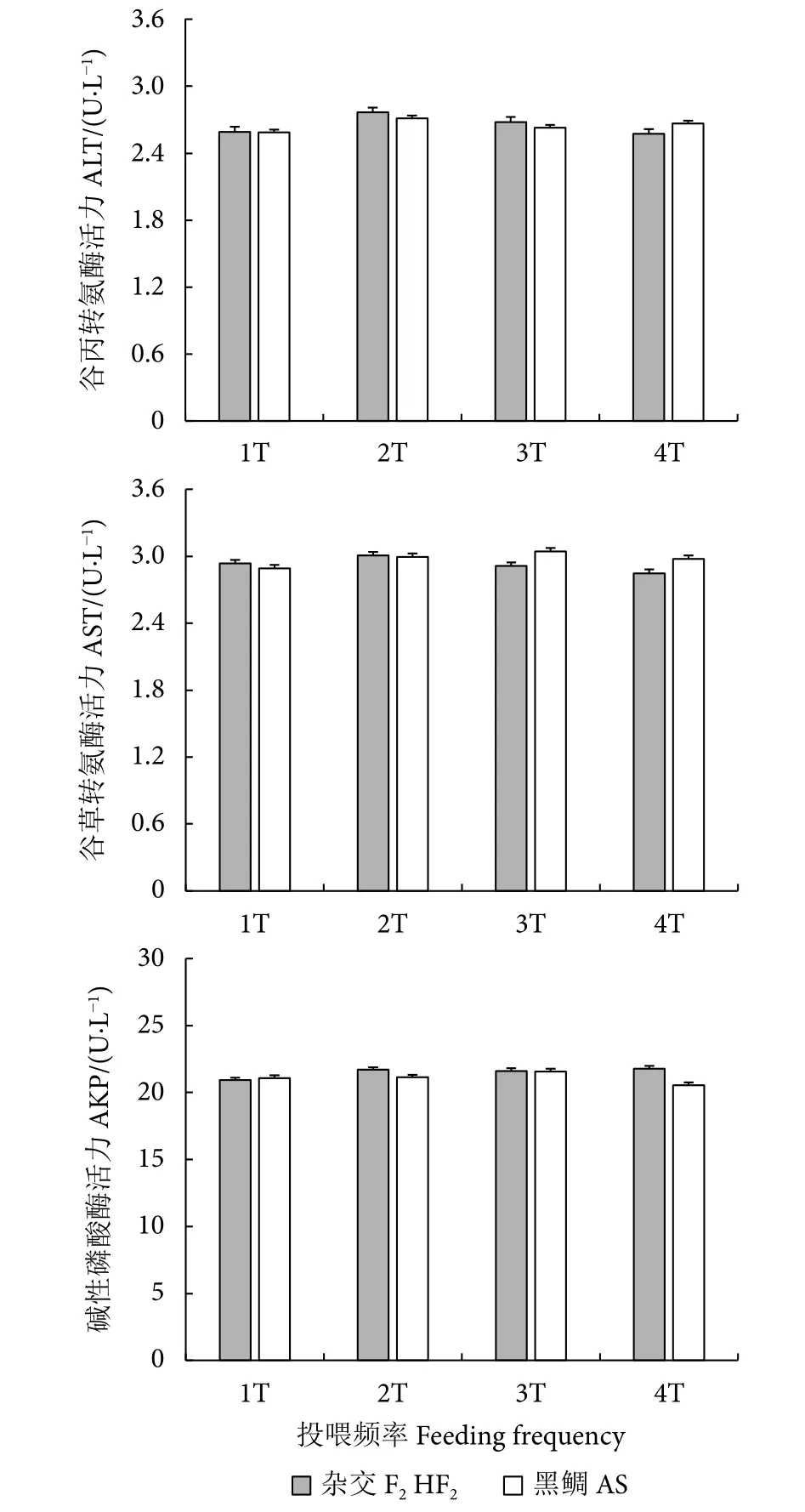
图3 不同投喂频率下杂交鲷与黑鲷肝功能指标比较Fig.3 Comparison of liver function indexes of hybrid porgy ofA.schlegelii ♀×P.major♂ and A.schlegelii with different feeding frequencies
3 讨论
3.1 生长与饲养效果分析
投喂与摄食直接关系到鱼类的生长与代谢。WGR和SGR为反映鱼类生长效果的重要指标。本实验中,杂交F2与黑鲷的生长性能等主要指标,在投喂频率从1T升至2T时显著升高,在投喂频率大于2T时不再升高并趋于稳定,表明两种鱼2次·d−1的投喂频率可以得到相对较好的养殖效果。对杂交鲂 (M.terminalis♀×Erythroculter ilishaeformis♂)[28]、卵形鲳鲹 (Trachinotus ovatus)[29]、鲻鱼 (Mugil liza)[30]及许氏平鲉 (Sebastes schlegeli) 幼鱼[31]的投喂频率研究也得出,在一定范围内升高投喂频率,鱼类的生长性能随之增加,继续升高投喂频率,其生长性能不再增加并逐渐趋于稳定。然而,在90~120 d内大口黑鲈 (Micropterus salmoides) 在2T组的WGR和SGR显著优于其他高投喂频率组[32]。这可能是因为过高的投喂频率导致喂食间隔变短,胃肠中的饲料还未排空又摄入了新的食物,使得胃排空率加快,肠胃负荷加大,进而影响食物中营养的充分吸收。此外,在本实验4个投喂频率组中,杂交F2的FBW、WGR、SGR均高于黑鲷,且在1T—3T组有显著差异;同样的饱食投喂2T,杂交F2的WGR (552.13±11.25)和SGR(4.67±0.32) 分别比黑鲷高 60% (344.48±47.69)和25% (3.72±0.26) 以上,表明杂交F2具有比亲本黑鲷更好的生长优势。
HSI、VSI可以衡量鱼体的能量状态[33]。本实验中,投喂频率超过2 T时,杂交F2与黑鲷的HSI、VSI均显著降低,说明超过一定范围后,继续升高投喂频率,鱼体的营养和能量积累并不会随之增大,甚至还会受到负面影响。对鲤 (Cyprinus carpio)[34]、黄颡鱼 (Pelteobagrus fulvidraco)[35]的研究也得出了类似结论。但对花羔红点鲑 (Salvelinus malma)[36]、大口黑鲈 (Micropterus salmoides)[32]和花鲈 (Lateolabrax maculatus) 幼鱼[37]的研究发现,升高投喂频率,HSI或VSI也随之增加。这可能与投喂频率升高使得鱼体的能量状态得到改善有关。而升高投喂频率,瓦氏黄颡鱼 (P.vachelli) 幼鱼的HSI却无显著变化[38]。另一方面,杂交F2在1T组的HSI、3T组的VSI显著高于黑鲷,这可能与杂交F2摄食与生长速度高于黑鲷有关,因此其肝脏等内脏中积累的脂肪较多,造成了肝体比、脏体比增大。
本实验中,投喂频率频从1T升至2T时,杂交F2和黑鲷的成活率显著增加;继续升高投喂频率,两种实验鱼的成活率无显著变化,其原因可能是1T的投喂频率不能够满足杂交F2和黑鲷生存和生长所需的食物供给,饥饿胁迫使得鱼体间抢食、自相残杀的概率加大,成活率降低。这种现象在养殖实验中也得到了证实。另外,投喂频率对两种鱼的CF、CV和FCR均无显著影响。这与杂交鲟(Acipenser schrenckiiBrandt♀×A.baeriBrandt♂) 的研究结论一致[39],却与大黄鱼 (Larimichthys crocea)的结果不同[40],这些不同的结果可能受到鱼的食性及养殖环境等的影响。而在相同投喂频率下,杂交F2的FCR与CV相对优于黑鲷,表明杂交F2的饲料利用率相对较高,个体差异相对较小,具有较好的品种优势潜力。
3.2 消化能力分析
消化酶活力反映了鱼类的消化能力,投喂频率的改变会引起鱼类消化酶活力的变化[41-42]。本研究通过分析胃蛋白酶、脂肪酶和α-淀粉酶等消化酶发现,低于2T的投喂频率显著影响了杂交F2和黑鲷的消化酶活力,2种鱼1T组的消化酶活力显著高于其他3组,且这3组间无显著差异。结合生长性能的变化趋势,说明在投喂频率较低、食物较少时,鱼体会提高其自身消化能力,达到充分吸收和利用食物的目的,降低因营养摄入不足所带来的生长差异;而在投喂频率较高、食物充足时,其消化酶活力仅维持在正常甚至较低水平便可满足生长和代谢所需[43]。这与许氏平鲉幼鱼[31]、黄斑篮子鱼(S.oramin) 幼鱼[44]的研究结果相似。因此,在饱食状态下,2T的投喂频率完全可以满足实验鱼的正常生长代谢所需。另外,与黑鲷相比,2T组杂交F2的胃蛋白酶、脂肪酶活力均有显著高表达,说明杂交F2的消化吸收营养能力较强,且与个体生长速度较快有关。
3.3 肝脏抗氧化能力与肝脏健康
鱼体内产生的活性氧 (Reactive oxygen species,ROS) 未及时清除时,会使组织和机体产生氧化损伤[45]。SOD 主要催化超氧阴离子 (·O−2) 生成过氧化氢 (H2O2),CAT、GSH-Px主要催化机体内的H2O2分解成CO2和H2O[32,46],MDA为SOD过氧化反应的产物[36]。对于杂交F2与黑鲷,CAT、T-SOD和GSH-Px活力随着投喂频率的增加呈先升高后降低的趋势,这表明机体在应激反应后通过自身的调节恢复平衡,未对机体造成不可逆损伤。这与卵形鲳鲹[47]的实验结果相似。不同的是,在大口黑鲈[25]中,随着投喂频率的升高CAT和T-SOD活力显著降低;而在花羔红点鲑[36]、异育银鲫 (C.auratus gibelio)[42]、大黄鱼[48]中,升高或降低投喂频率,CAT、SOD和GSH-Px活力不发生改变。此外,结合生长性能分析,在适宜的范围内升高投喂频率,抗氧化能力会维持在一个较高且相对稳定的状态,对生长有促进作用;超出此范围后,过低或过高的投喂频率均会使抗氧化能力显著降低,对生长产生抑制作用[46,49]。本实验中,2种鱼MDA活力不受投喂频率的影响。许多研究得出了类似结论[9-10,32],但升高投喂频率,团头鲂 (M.amblycephala) MDA活力显著增加[50]。在4 T组,杂交F2的CAT、T-SOD活力显著高于黑鲷,说明杂交F2的抗氧化能力更强。一般认为,当肝脏病变或受损时,AST和ALT活力升高[51-52]。本实验中,增加投喂频率,杂交F2和黑鲷的肝脏ALT、AST和AKP活力无显著变化,表明本实验所设置的投喂频率未对2种鱼的肝脏造成严重且不可逆损伤。
4 结论
综上所述,不同投喂频率可显著影响杂交鲷与黑鲷幼鱼的生长性能和生理生化指标;在投喂频率为2T时,2种鱼生长快、饲料利用率高、抗氧化能力强。杂交鲷在所有组别中的生长性能及多个生理生化指标均优于黑鲷。
