氮及其化合物考点归纳
2022-02-28金利敏
■金利敏

氮及其化合物知识是高中化学重点内容之一,氮是自然界各种生物体生命活动不可缺少的重要元素,氮的化合物数量众多,应用非常广泛,历来是高考命题的热点。
知识结构
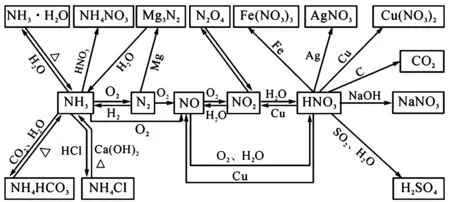
一、考查氮气的分子结构及其化学性质
例1氮气与其他单质化合一般需要高温,有时还需高压等条件,但金属锂在常温、常压下就能与氮气化合生成氮化锂,这是因为( )。
①此反应可能是吸热反应
②此反应可能是放热反应
③反应前可能氮分子无需先分解成为氮原子
④反应前氮分子必定先分解为氮原子
A.①② B.②④ C.②③D.①④
解析
氮分子中存在N≡ N,键能很大,非常牢固,通常情况下很难断裂N≡ N 键成为氮原子与其他物质反应。如果氮分子与某种物质容易反应,只可能是氮分子无需先分解为氮原子这种情况。另外,化学反应中放热反应一般比较容易发生。
答案:C
二、考查氨和铵盐的性质
例2将足量的氨气分别通入下列溶液中,生成沉淀的物质的量(n)与通入NH3的体积(V)符合图1关系的是( )。
A.饱和氯化铵溶液
B.三氯化铝溶液
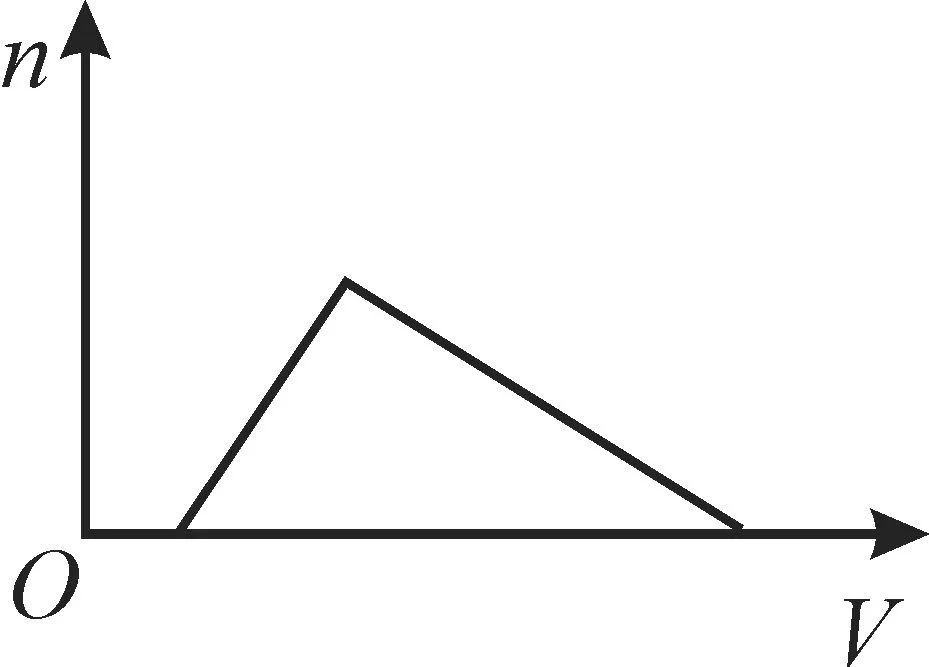
图1
C.硝酸酸化的硝酸银溶液
D.碳酸氢钙溶液
解析
向饱和NH4Cl溶液中通入NH3,一方面NH3与水结合生成NH3·H2O,使水的量减少;另一方面NH3·H2O的电离导致溶液中浓度增大,从而析出NH4Cl固体,且不再溶解。向AlCl3溶液中通入NH3,反应的离子方程式为Al3++3NH3+3H2O==Al(OH)3↓+,产生的沉淀不溶解。向硝酸酸化的硝酸银溶液中通入NH3,刚开始NH3和酸发生反应,当酸反应完全后,开始发生反应,生成的沉淀继续和NH3发生反应Ag(OH)+2NH3==[Ag(NH3)2]++OH-。向Ca(HCO3)2溶液中通入NH3,反应的离子方程式为Ca2++2HCO-3+2NH3==CaCO3↓,产生的沉淀不溶解。
答案:C
三、考查硝酸的性质
例3欲迅速除去铝壶中的水垢又不损坏铝壶,最佳的方法是加入下列物质中的( )。
A.浓盐酸 B.稀硝酸
C.冷的浓硫酸 D.冷的浓硝酸
解析
加入的试剂必须满足以下条件:一是能与水垢[CaCO3、Mg(OH)2]反应,二是不能与铝反应。因浓盐酸和稀硝酸均与铝反应,冷的浓硫酸尽管能使铝钝化,但与CaCO3反应不彻底(生成难溶物CaSO4),冷的浓硝酸不但能与水垢反应,还可使铝钝化。
答案:D
例438.4 mgCu 与适量的浓硝酸反应,铜全部反应后,共收集到22.4mL 气体(标准状况),反应消耗的硝酸的物质的量可能是( )。
A.1.0×10-3mol B.1.6×10-3mol
C.2.2×10-3mol D.2.4×10-3mol
解析
随着反应的进行,硝酸的浓度不断减小,收集的气体应该是NO2和NO 的混合物,可以用极值法讨论求解。n(Cu)==6.0×10-4mol。若38.4mgCu全部与浓硝酸反应,根据反应方程式Cu+4HNO3(浓)==Cu(NO3)2+2H2O+2NO2↑,可求出参加反应的硝酸为6.0×10-4mol×4=2.4×10-3mol。若38.4mgCu全部与稀硝酸反应,根据反应方程式3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O,则可求出参加反应的硝酸为6.0×10-4mol×=1.6×10-3mol。事实上铜先与浓硝酸反应,浓硝酸变稀后,又与稀硝酸反应。因此消耗硝酸的物质的量在1.6×10-3mol和2.4×10-3mol之间。也可以根据氮原子守恒求解。硝酸与金属反应时既表现氧化性又表现酸性,生成的NO2和NO 总的物质的量即是表现氧化性的那部分硝酸的量,表现酸性的那部分硝酸则生成Cu(NO3)2,由于反应前后氮原子守恒,则反应消耗HNO3的物质的量n(HNO3)=2×n[Cu(NO3)2]+n(NOx)==2.2×10-3mol。
答案:C
四、与含氮化合物有关的推断
例5如下流程中,A~J分别代表相关反应中的一种物质,已知A 分解得到等物质的量的B、C、D,已知B、D 为常温下气态化合物,C为常温下液态化合物(流程中有部分生成物未标出)。

请回答下列问题:
(1)A的化学式为____B的电子式为_____。
(2)D+G→H 的化学方程式为_____,F+J→B+C+I的化学方程式为_____。
(3)A+NaOH→D的离子方程式为____。
解析
C为常温下液态化合物,且能与Na2O2反应,则C 为水,B、D 为常温下气态化合物,B 能与Mg反应,则B为CO2,A 与碱反应生成气体D,则D 为NH3,A 为NH4HCO3,E 为MgO,F 为C。水与Na2O2反应生成G,G 为O2,D 与G 反应生成H,H 为NO,I为NO2,J为HNO3。

五、考查有关环境保护知识
例6氮是自然界含量丰富的元素,其氧化物在环境、能源及科学实验中有着重要影响和广泛应用。试回答下列问题:
(1)①向大气中排放NOx可能导致的环境问题有_____(答两点)。
②工业上用洗净的废铜屑作原料来制备硝酸铜。为节约原料和防止污染环境,宜采取的方法是_____。

(2)氮的氧化物尾气处理有多种方法。
①实验室用足量NaOH 溶液能完全吸收NO2生成氮的含氧酸盐,试写出该反应的离子方程式:___。
②小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2和N2,请写出有关反应的化学方程式:____。
③有一种治理工业废气中氮的氧化物污染的方法是通入适量氨气,将其还原为无毒物质N2和H2O,现有含氮氧化物NO 和NO2的混合气体3L,用同条件下的NH33.50L恰好反应完全,则混合气体中NO 和NO2的体积分数之比为____。
A.1∶4 B.1∶3 C.1∶2 D.1∶1
解析
(1)①NOx可能导致光化学烟雾、硝酸型酸雨、臭氧层破坏等。②A、B、D 项都会产生氮的氧化物或二氧化硫污染环境,C项无污染性气体排放。
(2)①NaOH 溶液能完全吸收NO2生成氮的含氧酸盐,故反应必为氧化还原反应,根据氮的化合价有升有降、电子得失守恒原则写出该反应的离子方程式2NO2+2OH-==+H2O。②有关反应的化学方程式为NO+NO2+H2O==2HNO2,CO(NH2)2+2HNO2==CO2+2N2+3H2O。③根据电子得失守恒,设NO 和NO2物质的量分别为xmol、ymol,列式x+y=(电子得失守恒),解出x∶y=1∶3。
答案:略。
