CRISPR/Cas9技术在家禽育种方面的应用
2022-02-26庄重赵龙白皓毕瑜林黄应权陈国宏常国斌
庄重, 赵龙, 白皓, 毕瑜林, 黄应权, 陈国宏, 常国斌*
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.扬州大学农业科技发展研究院,教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;3.江苏绿佳生态科技有限公司,江苏 泰州 221000)
基因编辑,又称基因组编辑或基因工程,能够精确地对基因组中特定的目标基因进行修饰。近年来,随着编辑潜能强大的新型基因编辑技术——规律成簇间隔短回文重复序列(clustered regulatory interspersed short palindromic repeat,CRISPR)被发现,基因编辑效率在本质上有了极大的提升。CRISPR技术2013、2015年连续两次被Science评为年度十大科学突破[1-2];Nature也于2019年将其列为10年内最具影响力的5个重大科学事件之一[3];2020年,埃马纽埃尔·卡彭蒂耶(Emmanuelle CHARPENTIER)和詹妮弗·杜德纳(Jennifer DOUDNA)因对CRISPR基因编辑技术的杰出贡献被授予诺贝尔化学奖。CRISPR/Cas9技术的出现极大地开拓了人们对生物体研究的领域,为生命本质的研究提供了更多的可能。与传统基因编辑技术相比,CRISPR/Cas9技术设计简单、成本低廉、操作方便、效率可观,已成为目前常用的基因编辑技术。本文综述了基因编辑的发展历程,并剖析了CRISPR/Cas9系统的结构与类型以及其在家禽遗传育种中的应用,总结了CRISPR/Cas9技术在家禽研究中存在的一些问题,并提出意见和建议,为CRISPR/Cas9技术在家禽育种中的深入研究提供参考和借鉴。
1 基因编辑技术的发展
目前运用较多的三种基因编辑技术为锌指核酸酶(zinc finger endonuclease,ZFN)[4]、转录激活因子效应物核酸酶(transcription activitor-like effector nuclease,TALEN)[5]以及CRISPR[6],这些基因编辑技术为基因功能、基因改良以及基因治疗的研究拓宽了道路。由于ZFN技术设计复杂、成本高昂,TALEN载体较大、具有高度的重复序列,难以实现多基因敲除,限制了它们的应用和发展,CRISPR逐渐受到人们重视。CRISPR是一种有规律的间隔短回文重复序列,于1987年[7]被发现,随后科学家们对这种重复序列进行了深入研究,发现细菌和古细菌中普遍存在这种序列,在2002年正式将它命名为“clustered regularly interspaced short palindromic repeats(CRISPR)”[8]。然而,最初人们并不知道这种序列的具体作用,2005年,Bolotin 等[9]、Mojica等[10]、Pourcel等[11]在研究中发现,CRISPR的间隔序列与外来遗传物质具有非常高的相似性,他们推测CRISPR在细菌抵抗外来遗传物质入侵的过程中起着一定的作用。2006年,Makarova等[12]使用生物信息学手段对CRISPR进行分析,推测其在细菌与古细菌中作为一种获得性免疫系统而存在。此后,Barrangou 等[13]与Marraffini等[14]分别验证了CRISPR能够在细菌中抵御噬菌体的入侵。
近年来,CRISPR/Cas技术在基因编辑中的应用取得了长足发展,2010年,Garneau等[15]利用间隔序列引导Cas9蛋白对目的基因进行切割,发生了双链断裂,首次证实CRISPR/Cas9具有基因编辑的潜力。此后不久,对哺乳动物基因的成功编辑[16]更是打开了利用CRISPR/Cas9机制进行基因编辑的大门。2014年,Hai等[17]通过将靶向vWF(血管血友病因子)基因的sgRNA显微注射入猪受精卵中,成功制备了首例vWF基因敲除猪,并建立起血管性血友病基因猪模型,该模型的建立对提高猪屠宰和采血的出血效率都具有较大帮助。同年,Han等[18]利用相同方法,成功获得了两只肌肉生长素(MSTN)基因编辑羔羊,由此证明将Cas9:sgRNA直接注射到受精卵中可以广泛应用于构建大型家畜基因敲除模型。在此基础上,Wang等[19]利用CRISPR/Cas9系统成功制备了MSTN和FGF5基因编辑山羊,并证明基因编辑后的山羊次级毛囊数量以及羊绒长度显著增加,这为改良山羊肉品质以及羊毛纤维品质提供了新的思路。2015年,Heo等[20]首次将CRISPR/Cas9技术使用在牛的基因编辑中,成功获得了经过基因编辑的牛多能干细胞(ips)和胚胎,为之后基因编辑牛打下基础。除此之外,Niu等[21]证实,在食蟹猴的单细胞胚胎中同时注射Cas9mRNA和sgRNA,可以使PPAR-γ基因与Rag1基因产生突变,更是让这项技术在人类疾病基因治疗上应用成为了可能。截至目前,CRISPR技术已广泛应用在模式生物,如斑马鱼[22]、小鼠[23]、细菌[24]和农作物玉米[25],以及山羊[26]、牛[27]、猪[28]等家畜的基因编辑中。随着CRISPR/Cas9技术的逐渐成熟,这项技术将对基因修饰、疾病治疗以及动植物品种改良等研究有划时代的意义。
2 CRISPR/Cas9系统的组成和作用机制
CRISPR/Cas9系统是一种自适应性免疫系统,在许多细菌与古细菌中基本分为3个步骤发挥作用(图1)[16,29]:第1步为适应,从外源核酸获得新的间隔区,插入CRISPR 5’端的两重复序列之间;第2步是CRISPRRNA(crRNA)的生物发生,CRISPR基因座被转录成小的干扰型crRNA;第3步是靶向识别,crRNA引导Cas核酸酶进行同源序列的特异性切割[16]。根据CRISPR/Cas9系统中蛋白的种类不同以及识别机制的差异大致可以分为3类[29],其中Ⅰ型与Ⅲ型系统都需要多种Cas蛋白复合体才能发挥作用,比较复杂,而Ⅱ型系统非常简便,其主要由Cas9蛋白、crRNA、tracrRNA组成,自身的下游没有PAM(protospacer adjacent motifs)序列,外源DNA的间隔序列的3’端存在1个PAM序列,Cas9蛋白借此对外源DNA进行识别,从而避免自我免疫[30]。目前,CRISPR/Cas9已成为应用最广泛的基因编辑技术。
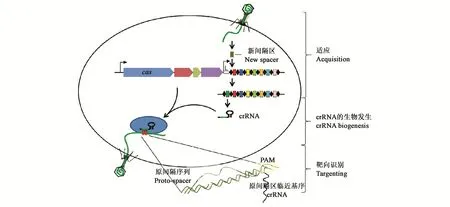
图1 CRISPR/Cas9系统的功能机制(根据参考文献[29]修改)Fig.1 Functional characteristics of CRISPR/Cas9 system(modified on reference[29])
CRISPR/Cas9的基因座5’端为能够与crRNA形成crRNA-tracrRNA复合体的tracrRNA基因,其可以指导Cas9与crRNA-tracrRNA进行结合;Cas蛋白编码基因3’端为CRISPR基因座,由启动子、spacers和重复序列组成,其中,spacers主要负责引导Cas9蛋白精确识别非自身DNA与自身DNA,从而实行定点切割并避免自我免疫。Cas9蛋白对于靶DNA的识别不仅需要crRNA-tracrRNA复合物的引导,靶位点上的PAM序列也是其区分外源和内源DNA的重要标识。首先,crRNA-tracrRNA复合物对外源DNA进行扫描,只有当crRNA与外源DNA互补配对且3’端具有PAM序列时,Cas9蛋白才会对外源DNA进行切割,Cas9蛋白中包含有RuvC结构域、HNH结构域、识别区REC以及位于C端的PAM区,RuvC与HNH分别切割目的外源基因DNA的互补链与非互补链,使DNA的双键断裂。当RuvC中的D10A失活或突变时会导致RuvC失活,HNH中的H840A突变同样可使HNH失活。D10A与H840A都突变会形成dCas9(dead Cas9),而单点突变可使Cas9成为切口酶,切割外源DNA后会造成DNA单链断裂[31-32]。
3 CRISPR/Cas9技术在家禽育种中的应用
家禽作为一种农业经济动物,具有生长周期短、饲料报酬率高、繁殖力强等特点,是生物学领域重要的蛋白质来源[33],也是脊椎动物发育生物学非常有价值的模型[34]。与传统育种相比,CRISPR/Cas9技术可以给育种者提供更多的遗传选择,并通过基因组编辑快速提高后代的生产性能、繁殖性能和抗病性能,以满足消费者对家禽日益增长的需求。此外,利用CRISPR/Cas9技术在家禽上还可以进行性别决定,不仅降低生产成本,而且可以改善动物福利。因此,通过CRISPR/Cas9技术进行基因改造,进而推动家禽业发展具有广阔发展前景。以下将对近些年CRISPR/Cas9技术在家禽功能基因研究中的应用进行总结,并重点介绍一些具有经济价值的基因编辑模型。
3.1 在家禽功能基因研究中的应用
3.1.1 在细胞中的应用 CRISPR/Cas9系统已广泛应用于家禽细胞基因编辑中(表1),其中在鸡成纤维细胞(DF-1)、鸡胚胎干细胞(ESCs)、鸡原始生殖细胞(PGCs)上应用较多。随着CRISPR/Cas9的快速发展,细胞培养系统能够更容易地靶向不同基因,研究者在探究不同功能基因效应的同时,也不断证明利用CRISPR/Cas9对家禽进行基因编辑从而进行性状改良与育种研究具有可行性。
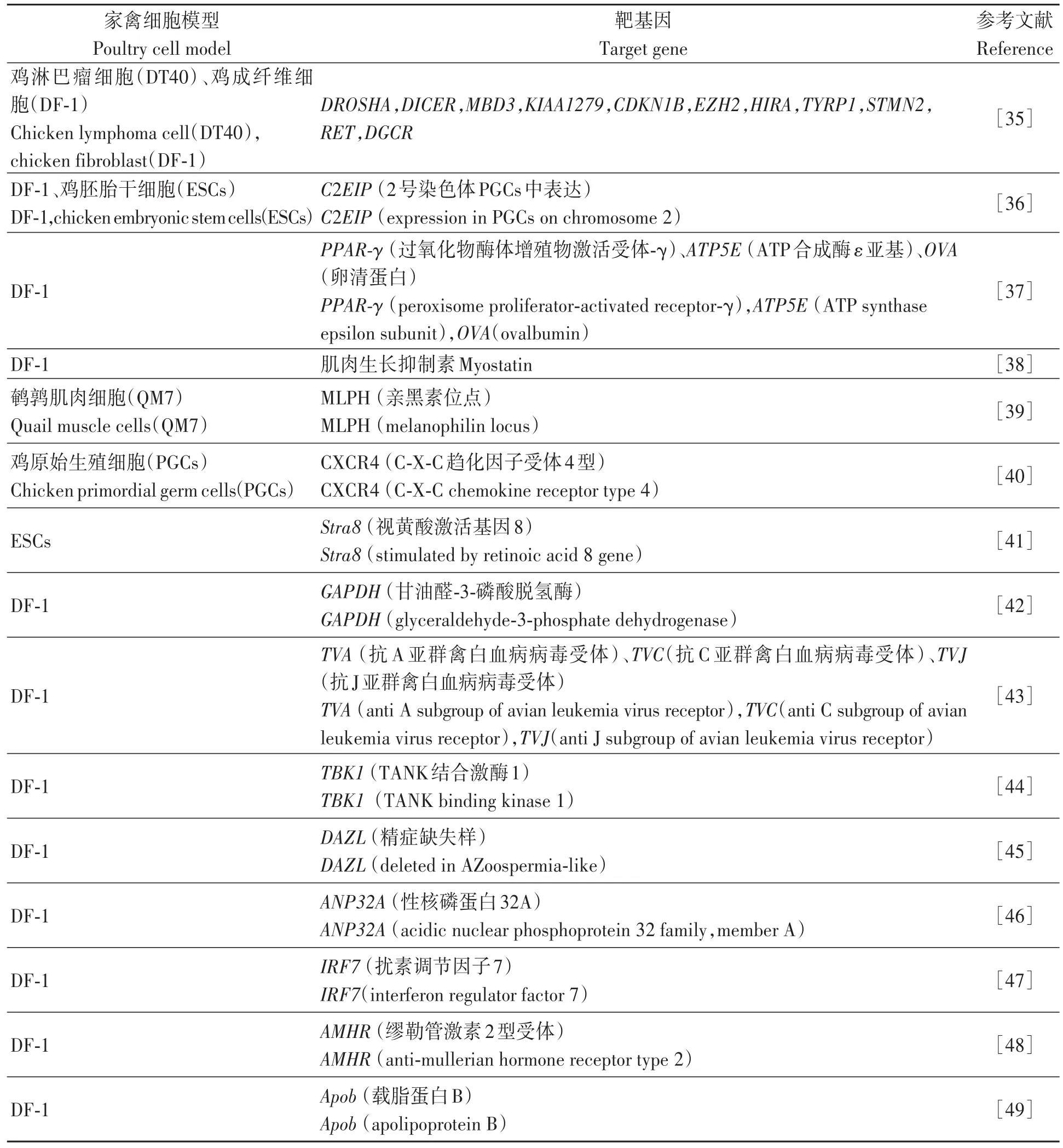
表1 CRISPR/Cas9系统在家禽细胞系模型上的应用Table 1 Application of CRISPR/Cas9 system in poultry basal cell model
3.1.2 在胚胎发育模型中的应用 与其他动物胚胎相比,鸡胚发育过程清晰、来源方便、易于操作、利于大量实验样本同时观测[50],是经典的胚胎发育模型,其对于研究脊椎动物胚胎学的生理、病理以及毒理学等也具有重要的指导意义[51-52]。近年来,使用CRISPR/Cas9技术在探究胚胎相关功能基因功能方面取得了丰硕的成果。
2015 年,Véron 等[53]通过电穿孔胚胎以及CRISPR/Cas9技术得到了敲除PAX7基因的鸡胚,首次证明了利用CRISPR/Cas9系统对鸡胚体细胞进行基因编辑具有可行性。随后,Abu-Bonsrah等[35]在Véron等[53]的基础上再次结合两种技术,敲除了两个细胞系中DROSHA、DICER、MBD3、KIAA1279、CDKN1B、EZH2、HIRA、TYRP1、STMN2、RET和DGCR共计11个与胚胎发育或胚胎患病相关的基因,并将其转染入胚胎中,结果表明,CRISPR技术能对鸡胚进行有针对性地基因改造,且所有靶基因的切割效率均在20%~68%之间,为胚胎发育过程中的疾病模型研究提供思路。此外,Zuo等[36]还将含有被PEI包裹的gRNA-3载体注射到鸡胚胎中,建立了敲低效率为15%的稳定细胞、胚胎CRISPR/Cas9基因敲低系统,为利用CRISPR/Cas9系统在鸡胚胎中进行基因改造建立基础。Williams等[54]构建并优化了鸡U6启动子体内介导sgRNA表达的微型载体系统,创建了能够对内源性增强子和启动子进行表观基因组操作并带有Citrine报告基因的野生型Cas9表达载体。通过观察发现,CRISPR/Cas9技术可以对内源性增强子起到调节作用,为接下来探究鸡胚中基因间的相互调控作用提供了参考。
3.2 在家禽基因编辑模型制备中的应用
由于难以获得和操纵合子,传统基因编辑技术难以应用到家禽上,因此对家禽的基因改造远远落后于其他动物。近年来研究发现,通过结合基因编辑技术与PGC体外培育技术,极大地提高了制备家禽基因编辑模型的效率。2013年,Schusser等[55]首次从鸡胚胎中获得PGC细胞,将其体外培养后导入已编辑的基因,再把处理后的PGC细胞显微注射入受体胚胎血管中,最终完成受体孵化,生产出了第1只敲除JH基因的无B细胞基因编辑鸡。2016年,Oishi等[56]通过嘌呤霉素和博来霉素实现了对鸡PGC中的卵清蛋白(ovum albumin,OVA)和卵类黏蛋白(ovomucoid,OVM)基因的敲除,并将成功敲除了OVA、OVM基因的PGC细胞注入鸡胚血管中,得到3个可以产生突变精子转基因嵌合体的公鸡种系,突变效率高达90%。此后,不同基因编辑模型的研究进程大大加快,为开发家禽优质育种资源提供了更多选择。
3.2.1 在家禽疾病中的应用 疾病对于家禽的生产有较大的限制,随着CRISPR/Cas技术在基因编辑方面日渐成熟,使用该技术对家禽抗病性能进行品种改良便成为热点课题。
禽白血病病毒(avian leukosis virus,ALV)是生产中对家禽危害较大的病原之一,给家禽业造成了严重的经济损失。2017年,Lee等[57]通过将CRISPR/Cas9载体与单链寡脱氧核苷酸(singlestranded oligonucleotide nucleotide,SSODN)组合的同源定向修复(homology directed repair,HDR)对NHE1进行精确地基因组编辑,致使DF-1细胞对ALV-J感染产生抗性,为抗病鸡品种培育奠定了基础。之后不久,Lee等[58]又使用相同的方法对TVA基因外显子2进行敲除,得到了可以增强ALV-A的抗性的DF-1细胞。他们还准备采用相同的方法对PGC以及ECS细胞进行基因组编辑,以获得新型的多抗病基因组编辑鸡。2020年,Koslová等[59]使用CRISPR/Cas9完成了对NHE1基因的精确敲除,制备出的基因编辑模型对禽白血病病毒J亚群产生抗性。这些研究表明,使用CRISPR/Cas9对家禽基因组进行编辑可以培育出高抗病性的基因编辑品系,为缓解疾病对家禽生产的影响提供了新的思路。
火鸡疱疹病毒(herpesvirus of turkeys,HVT)是一种α疱疹病毒,因其与马立克式病毒(Marek’s disease virus,MDV)抗原相关而被广泛用作预防马 立 克 病(MD)的 活 疫 苗 。 Tang等[60]使 用CRISPR/Cas9技术代替传统的重组和BAC重组技术,将IBDV的VP2插入HVT的基因座,快速高效地制备了表达VP2基因的重组HVT疫苗,证明通过在病毒的不同基因座位置插入其他病毒抗原基因来开发多价重组HVT载体疫苗是可行的,为使用CRISPR/Cas9系统平台开发新型多价载体疫苗奠定基础。2020年,Tang等[61]又在此基础上使用CRISPR/Cas9技术在HVT的基因座中插入IBDV的VP2基因、ILTV的gDgI基因和H9N2流感病毒的HA基因,构建出HVT-VP2-gDgI-HA三重插入重组HVT疫苗,为生产可预防多种禽类疾病的疫苗提供参考。
在鸭疾病中主要是利用CRISPR/Cas技术进行鸭乙肝病毒[62]、禽孢疹病毒疫苗[60]及禽类流感病毒的相关研究[56]。CRISPR/Cas9技术在家禽病毒方面的应用和贡献也说明了这项技术在家禽的致病性基因的编辑和治疗方面拥有广泛的应用前景。
3.2.2 在家禽生长发育和性别决定中的应用
CRISPR/Cas9技术也广泛地用于研究家禽生长发育和性腺分化,Myostatin(肌肉生长抑制素)于1997年被发现,其参与肌肉生长发育及分化的各个阶段,与肌肉质量有较高的相关性[63]。2017年,Lee等[38]对肌生成过程中抑制肌肉细胞生长和分化的鸡Myostatin进行靶向缺失和突变,通过检测发现突变效率为100%,这为进一步探讨Myostatin对鸡肌肉质量的影响奠定基础。邱桂如等[64]利用CRISPR/Cas9技术敲除鸡DF-1细胞中IHH基因,并证明了该基因与鸡的匍匐性状关系密切,为解决生产中鸡的匍匐性状问题提供了思路。载脂蛋白B(apolipoprotein B,Apob)主要在小肠和肝脏中合成,在甘油三脂的合成和分泌中发挥重要作用,对鸡的生长和脂肪沉积有较大影响[65],吉琳等[49]通过构建Apob基因敲除载体转染DF-1细胞,得到了成功敲除Apob基因的DF-1细胞,并证明亚克隆细胞的mRNA表达量显著降低,这为继续研究Apob基因对鸡脂肪沉积的影响建立了平台。
2017年,Zhang等[41]设计了3个sgRNA来完成对鸡DF-1、ESCs细胞中Stra8基因的敲除,发现ESCs向 SSCs(spermatogonia stem cells,精原干细胞)的分化受到抑制,由此证实Stra8基因对控制ESCs向SSCs分化起着决定性的作用,这为家禽性别控制提供可能。同年,Zuo等[66]通过RNA测序发现C1EIS基因在SSCs优先表达,随后构建了C1EIS基因敲除载体以探究其在ESCs向SSCs分化过程中所起的作用。结果表明,经T7EI酶切和TA克隆测序检测敲除效率为40%,当C1EIS缺乏时,ESCs向SSCs分化受到抑制,这证明了C1EIS基因在鸡性腺发育过程中起着重要的作用,为家禽性腺发育与诱导发育的研究拓宽了思路和视野。作为鸡性腺分化和生长发育的候选基因,DMRT1一直被广泛关注,杨秀荣等[67]利用sgRNA平台进行DMRT1基因敲除,成功构建了一个DMRT1基因敲除模型,为接下来进一步研究DMRT1基因功能奠定基础。研究表明,抗缪勒氏管激素(anti-mullerian hormone,AMH)对卵泡选择有重要影响,黄思嘉等[48]通过靶向构建AMRH2敲除载体,成功敲除了DF-1细胞中的AMRH2基因,为继续研究AMHR2基因在细胞中的作用构建了敲除模型。
4 CRISPR/Cas9技术在家禽应用中存在的问题
CRISPR/Cas9基因编辑技术设计简单、便于操作、成本低廉,且能够高效地对目的基因进行编辑修饰,不断地推动着人类对生命的探究,但其也逐渐暴露出一些关键问题。下面分析CRISPR/Cas9系统在家禽应用中存在的部分问题,并总结一些具有可行性的优化方法,以期为问题的解决提供参考。
4.1 脱靶效应
无论是传统的还是新型的基因编辑技术都存在一定的脱靶问题,虽然CRISPR的脱靶率相较传统基因编辑技术有所降低,但是其脱靶效应仍然给研究工作带来了诸多的困扰。已经有多项研究表明,在使用CRISPR/Cas9技术对目的基因进行敲除的过程中存在着较为明显的脱靶现象,但是目前还未能找到有效控制脱靶效应的方法,这是限制CRISPR技术发展的主要因素,也是目前该技术的瓶颈。CRISPR/Cas9技术在家禽方面应用的脱靶效应尤为明显,编辑效率仅有26%[36],远低于在哺乳动物以及植物中的基因编辑效率,并且脱靶效应还会对家禽随机位点产生不利突变,这会对生产中转基因家禽的安全性和有效性产生重大影响,因此解决脱靶效应是当前亟待解决的问题。为了降低脱靶效应,研究者们已经从各个方面对CRISPR/Cas9系统进行优化,下面将从Cas9核酸酶优化、载体传递优化、实验设计优化等方面进行总结,为此后家禽基因编辑研究中最大程度降低脱靶效应提供思路和参考。
4.1.1 Cas9核酸酶优化 对Cas9核酸酶变异体优化来说,目前应用在家禽中最为广泛的Cas9核酸酶是来源于化脓性链球菌(SpCas9),但是其对于全基因组会产生非靶标突变。近年来人们一直努力开发Cas9变异体以及其他同源基因来代替SpCas9,使系统表现出更小的突变性以及更高的特异性,从基础上改善脱靶效应。2018年,Kumar等[68]利用金黄色葡萄球菌Cas9核酸酶(SaCas9)开发出一种AAV(腺相关病毒)载体工具包,并将其对体外细胞基因编辑后发现,SaCas9可以识别较长的PAM序列,相对只能识别较短PAM序列的SpCas9来说,使用SaCas9基因编辑可能会产生非常小的非目标突变。除此之外,研究者还发现XCas9[69]、Cas9-NG[70]和 evoCas9[71]等 SpCas9 变异体都表现出比SpCas9更低的脱靶效应,并且已经逐渐将其应用于目前的CRISPR/Cas9技术中。
4.1.2 载体传递优化 改变病毒载体传递方法也是降低脱靶效应的手段,由于现行的CRISPR/Cas9系统进行基因编辑时会一直存在于目的细胞中,很容易导致细胞基因组改变,从而影响目标效应。因此,腺病毒由于其难以整合到靶细胞基因组的特点[72]而被逐渐用于传递病毒载体构建中,通过腺病毒传递病毒载体可以很大程度地避免目的效应偏离,降低脱靶效应。使用非病毒进行载体递送研究近年来也逐渐兴起,研究者们通过直接向靶细胞递送核糖核蛋白复合物(ribonucleoprotein,RNP)发现,RNP随着时间延长逐渐降解[73],这对于利用优化载体传递方法最大限度地减少基因组改变,从而减少靶外突变、降低脱靶效应具有重要意义。
4.1.3 实验设计优化 除了以上优化方法,未来研究还可以通过对靶点的慎重筛选、适当缩小sgRNA长度以及设计成对sgRNA结合单切口酶或者dcas9-fokI融合酶等来降低CRISPR技术的脱靶效应。尽量确保CRISPR/Cas9系统的稳定性和重复性,并在提高CRISPR/Cas9技术精准性的同时深入探索cas9基因的特异性,在破除技术壁垒的同时逐渐完善CRISPR/Cas9在家禽基因功能以及基因组的应用。
4.2 其他问题
除了脱靶效应,转染效率[74]、生殖系传递效率较低[75]也是限制家禽CRISPR/Cas9技术发展的重要因素。随着PGC介导的转基因和基因组编辑的广泛应用,这方面问题已经逐渐得到解决。通过先对PGC进行转染,再将体外培养的PGC细胞注射到宿主体内的方法,可以大大提升细胞转染效率以及生殖系传递效率(高达90%)。伴随该技术的逐渐优化与成熟,转染效率以及生殖系传递效率在此基础上还会再进一步提升。此外,不同的物种所需要的cas9基因以及sgRNA启动子也不尽相同,RNA聚合酶Ⅲ依赖的U6和U3便可较好地在时间和空间上表达原核生物的gRNA[76],而非U6和U3启动子就可能出现在动物中不正常表达的gRNA。所以通过寻找家禽最适启动子这一方法来提高CRISPR技术的稳定性和高效性也值得研究者们重视。
5 结语
CRISPR/Cas9技术的出现打破了传统基因工程技术效率低、成本高、稳定性差的局面,推动家禽基因编辑技术快速发展,对家禽基因组编辑模型的发展以及生产性能的提高作出杰出贡献。但脱靶效应很大程度上制约了CRISPR/Cas9技术在家禽中的应用,应尽快找到控制其脱靶效应的突破口,大力推广CRISPR/Cas9技术在家禽遗传育种中的应用,提升家禽生产效率,相信其在家禽的各项研究领域必然拥有很广阔的发展空间。近几年,能够切割出黏性末端便于插入连接的CRISPR/cpf1系统的发现与应用[77],以及基于失活的Cas9系统利用FokⅠ酶进行切割从而提高切割效率等方法的发现[78],都展现出CRISPR/Cas9系统的强大潜力与开发和利用的空间。科学家们也在不断努力地寻找可以控制CRISPR/Cas9系统的开关蛋白[79],并且已有一些成功降低脱靶效应的效应蛋白得到了验证[80]。这些都展现出CRISPR技术还拥有巨大的改进空间和广阔的发展前景。通过人们不断地努力探索和完善,CRISPR技术变得更加精确之后必然会得到广泛的应用,成为探索生命本质的利器从而带来更大的效益。
