“海洋化学资源的综合利用”中的几个问题思考
2022-02-25付明广
付明广
(江苏省南京师范大学第二附属高级中学 211900)
1 粗食盐中常见杂质的去除问题
问题1 能否直接用氢氧化钡溶液来代替氢氧化钠溶液和氯化钡溶液,即用1种试剂一次性将2种杂质离子一起除去,从而简化实验步骤?
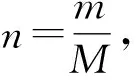

可知,每沉淀1份镁离子需要2份氢氧根离子,所以将每千克海水中镁离子沉淀完全大约要0.053mol氢氧化钡,由离子反应
可知,将每千克海水中硫酸根离子沉淀完全大约需要0.027mol氢氧化钡,因此为了将镁离子沉淀完全,必将导致引入大量的钡离子,为了除去新引入的钡离子,就需要再加过量的碳酸钠来除去.综上所述,由于海水中镁离子和硫酸根离子的含量比例不同,所以工业上一般不采用直接加氢氧化钡溶液来除去镁离子和硫酸根离子.
问题2 粗盐提纯过程中,最后需要加入盐酸去除过量的氢氧根离子和碳酸根离子,是否需要控制盐酸滴加量?如若要控制,量为多少?
在粗盐提纯过程中,为了去除多余的氢氧根离子和碳酸根离子,一般最后都需要加入盐酸,若盐酸加多了,会影响最后粗盐提纯产品的酸碱度,若盐酸的量加少了,也会导致杂质离子除不尽,那么如何控制滴加盐酸的量呢?通过分析碳酸的两步电离平衡常数:Ka1=4.30×10-7;Ka2=5.61×10-11,可知碳酸第一步电离远远大于第二步电离,这反过来就可以说明碳酸根离子与H+结合的程度很大,而碳酸氢根离子与H+结合的程度相对较小,所以如果溶液的酸的浓度不够大时,会导致碳酸氢根因H+浓度不够而未除尽.一般默认为离子浓度小于等于10-5mol/L即视为除尽,通过查表可知常温常压下,饱和碳酸溶液的浓度大约为0.04mol/L,要使碳酸氢根离子完成除尽,根据碳酸的第一步电离

不难发现,只要c(H+)≥0.0017mol/L,即pH≪2.8时就可保证溶液中的碳酸氢根离子除尽.
2 从海水中提取金属镁所涉及问题
苏教版必修一中关于从海水中提取金属镁的流程如图1所示.

问题1 为什么选择石灰乳来沉淀海水中的镁离子?实际工业生产中石灰乳是否真的来源于煅烧贝壳吗?
因为氢氧化镁的溶度积Ksp非常小(也即溶解度很小),所以一般选择碱来沉淀镁离子;又由于工业上要考虑经济效益,从而选择价格相对较低和来源广泛的氢氧化钙,而不选择氢氧化钠或氢氧化钾等.当然选择氢氧化钙还有其他好处,例如氢氧化钙与海水中的氯化镁反应生成氢氧化镁的同时也生成了氯化钙,而氯化钙在工农生产生活中还有很多应用,可谓一举多得.
书本中提到除去镁离子所需的氢氧化钙来源于煅烧贝壳,因为海边有大量的贝壳,这样设计更能让学生体会与理解,也符合本单元所设计海水的综合利用的总思路.但通过实际走访调查,现在工业上沉淀镁离子所需的石灰乳并不完全是以贝壳为原料,更多的仍然是以大理石为原料,这就有成本的考虑,也有贝壳的来源考虑,因为贝壳还有其他更好的经济用途.
问题2 MgCl2·6H2O为什么要在HCl气流中加热才能得到MgCl2?
氯化镁属于强酸弱碱盐,在水溶液发生水解

根据盐类水解规律:加酸可以抑制强酸弱碱盐的水解,所以要在HCl气流中加热才能得到MgCl2.当然如果直接讲这个结论对于学生有很大的认知障碍,教师在处理这个问题的时候,要认清学生的认知发展区,可以适当地讲一讲可逆反应的特点:改变浓度,可以让可逆反应朝着想要的方向进行.其实在本专题氯气制备中讲如何除去氯气中混有的氯化氢时.为什么要用饱和氯化钠溶液,就可以适当地提前向学生讲解这一个知识点:

增加某一生成物的浓度,比如增加氯离子浓度,可逆反应朝着逆反应方向进行,这样就可减少氯气与水的反应.有了这样的知识生成过程,既可以帮助学生更好地理解,使之知其然更要知其所以然,又能更进一步激发学生学习化学的热情.因此,教师在平时的授课过程中,要关注学生的认知发展区,适当地调整教材中的部分知识结构框架,不断地激发学生的求知欲.
问题3 工业上为什么通过电解熔融的氯化镁而不选用氧化镁?
因镁的化学性质很活泼,一般采取电解的方法来制取金属镁,电解熔融的氯化镁和氧化镁都可以得到金属镁,那为什么工业上选择电解熔融的氯化镁而不是氧化镁呢?主要原因是氧化镁的熔点很高,熔点为2800℃,是常见的耐高温材料,而氯化镁的熔点为714℃,熔融氧化镁需要更多的能量,所以工业上选择电解熔融的氯化镁.
3 在海水里提取溴或碘的过程中,从溴水和碘水中提取溴单质和碘单质所涉及的问题
苏教版必修一中关于工业上从海水中提取溴单质和碘单质的流程如图2所示.
实验室从海带中提取碘单质的流程一般如图3所示.
对比工业和实验室提取碘单质的流程,有几处明显不一样的方法:
(1)从海带中获取I-的水溶液的流程不一样.实验室通过灼烧、溶解、过滤的方式来获取I-的水溶液,工业上是加水浸泡,再加碱来去除有机杂质的方式来获取I-的水溶液.
(2)将I-氧化为碘单质所选的氧化剂一般也不一样.工业上一般通入氯气,用氯气来氧化I-,因为氯气的来源是电解饱和食盐水,也是以海水为原料.而实验室可以选择用氯气,也可以用更好的氧化剂,比如用双氧水.用双氧水最大的好处就是它作为氧化剂,被还原成水,不带来新的杂质.
(3)从碘水中提取碘单质的流程不一样.实验室从溴水或碘水中提取溴单质和碘单质一般采取的方法是先加入四氯化碳或苯等萃取剂将溴和碘单质萃取出来,然后通过分液的方法得到含有溴或苯的有机溶剂,最后再进行蒸馏即可得到溴单质和碘单质.在工业上,从溴水中得到粗溴一般采取通入热空气或水蒸气的方法,利用溴的易挥发特性,目前此方法是普遍采用的生产工艺,但方法适合从浓度很小的母液中提取溴,而且此方法也受到温度限制;从碘水中得到粗碘一般采取结晶过滤的方法来获得,利用碘单质在水中的溶解度比较小,而对于高浓度的碘的母液,也可以用空气将碘从母液中吹出,因为碘也是一种易形成蒸气的物质.工业上不采用实验室的方法来提取溴单质和碘单质,其中一个原因是工业上是大规模生产溴单质和碘单质,若用有机溶剂,则需求量很大,且这些有机物都具有一定的毒性.
