黄瓜CsMADS08及其下游调控基因的功能与表达分析
2022-02-25许双双安玉兰温梦梅胡克玲甘德芳
许双双,安玉兰,温梦梅,胡克玲,杨 咏,甘德芳
(1 安徽农业大学 园艺学院,安徽 合肥 230036;2 太湖县江塘乡农业综合服务中心,安徽 太湖 246417)
MADS-box家族基因是一类广泛存在于真核生物中的转录因子,在植物生长发育,如种子萌发[1]、芽休眠[2-3]、根营养吸收[4]、叶片分化[5]、花器官发育[6-7]、果实成熟与开裂[8-9]和逆境胁迫响应[10-12]等过程中发挥着重要的调控作用。目前有关MADS-box转录因子的研究主要集中在花器官及果实的发育调控方面。如拟南芥AtAGL6具有双重作用,通过负向调控开花位点FLC及正向调控花启动子FT来控制开花时间[13];荷花NnMADS6主要在花芽组织中表达,参与花萼、花瓣及心皮的发育[14];Boss等[15]从葡萄中得到4个MADS-box基因,发现VvMADS3在葡萄花和种子发育中起作用,VvMADS4参与花器官及果实的发育过程,VvMADS5则可能影响胚珠发育;研究还发现,突变SlMADS-RIN会使番茄果实无法成熟且外源乙烯也不能诱导果实成熟;同样,沉默基因FaMADS9-RIN后草莓果实也不能成熟,说明 MADS-box家族基因是调控果实成熟的上游基因,其功能在物种间相对保守[16-17]。
AP1-FUL类基因属于MADS-box亚家族基因,在植物生长发育过程中发挥着重要作用。拟南芥FRUITFULL(FUL)基因属于APETALA1(AP1)/SQUA基因亚家族,在调控开花时间、维持花序分生组织特异性、控制心皮及角果发育、调节叶片细胞组织和维管束的分化等过程中都有重要作用;玉米ZMM4、ZMM15属于FUL1亚家族,具有诱导玉米开花、促进花序发育的作用[18];金鱼草中FUL同源基因DEFH28能够调控心皮壁细胞分裂及果实成熟[19];异源表达桃树FUL同源基因PpMADS6能促进提早开花,减少分枝,控制角果裂合处细胞木质化,影响果荚的开裂[20]。黄瓜(CucumissativusL.)是葫芦科1年生攀援性草本植物,是我国夏季主要的蔬菜作物之一。Hu等[21]从黄瓜中鉴定出43个MADS-box家族基因,将其划分为AG、SEP、AP1-FUL、FLC等9个亚家族。目前对黄瓜FUL基因的研究多集中在其果实发育调控作用方面。Zhao等[22]发现,黄瓜CsFUL1基因在控制细胞分裂及扩张的同时,可以抑制生长素运输基因的表达,进而减少生长素积累,从而有效调节黄瓜果实的长度;蒋励[23]证实了CsFUL1与其他转录因子可共同调控黄瓜果实长度的发育。本课题组前期在黄瓜中获得3个AP1-FUL类MADS-box家族基因(CsMADS08、CsMADS10和CsMADS21),与葡萄VvFUL基因和拟南芥AtAGL8基因高度同源。Calonje等[24]发现,VvFUL能促进葡萄卷须的分化和发育;而拟南芥AtAGL8基因主要调控心皮的发育及分裂组织的分化[25]。表达模式分析显示,CsMADS08在黄瓜不同发育时期及不同组织中均有表达,且在茎和叶中表达量较高[26-27],但CsMADS08是否具有VvFUL和AtAGL8类似的功能还有待验证。鉴于此,本研究以拟南芥agl8突变体为材料,采用农杆菌介导法在突变体中导入CsMADS08基因,检测转基因后代拟南芥的表型变化,并分析CsMADS08及下游调控基因的组织表达情况,以期为进一步探讨黄瓜CsMADS08基因的功能提供理论依据。
1 材料与方法
1.1 试验材料
重组质粒pCAMBIA1305-CsMADS08由安徽农业大学园艺学院瓜菜育种创新团队实验室保存,拟南芥agl8突变体种子购自ABRC(ArabidopsisBiological Resource Center)。Trizol试剂购自Takara公司,植物基因组DNA提取试剂盒及质粒抽提试剂盒购自北京全式金生物技术有限公司。利福平(Rif)、卡那霉素(Kan)购自BBI生命科学有限公司,潮霉素(Hyg)购自北京强欣博瑞生物技术有限公司,乙酰丁香酮(AS)购自上海信裕生物科技有限公司。
1.2 方 法
1.2.1 拟南芥agl8纯合突变体的验证 拟南芥agl8突变体是由DsE转座增强子捕获元件插入到AGL8转录核苷酸序列5′UTR的46和47位碱基所致[25],使用三引物法[28]验证突变体的纯合性,引物序列见表1。提取拟南芥agl8突变体植株叶片基因组DNA,利用三引物(AGL8-1、AGL8-2和Ds3-2)进行PCR扩增。PCR反应体系为50 μL:10×PCR Buffer 5 μL,dNTPs (10 μmol/L) 1 μL,AGL8-1 (10 μmol/L) 1 μL,AGL8-2 (10 μmol/L) 1 μL,Ds3-2 (10 μmol/L) 1 μL,模板DNA 1 μL,TaqDNA聚合酶(5 U/μL)0.5 μL,ddH2O补足至50 μL。PCR反应条件为:94 ℃ 预变性5 min;94 ℃ 变性1 min;50 ℃ 退火45 s;72 ℃ 延伸45 s,30次循环;72 ℃ 延伸10 min;10 ℃停止,4 ℃保存。由于野生型拟南芥染色体无DsE转座增强子捕获元件插入,所以PCR扩增只有1条长度约500 bp的片段(AGL8-1到AGL8-2之间片段长496 bp);而杂合突变体拟南芥的1条染色体上有DsE转座增强子捕获元件插入,PCR扩增应该得到2条片段(AGL8-1到AGL8-2以及Ds3-2到AGL8-1或AGL8-2);纯合突变体拟南芥由于2条染色体上均插入了DsE转座增强子捕获元件,较长的DsE转座增强子捕获元件会阻碍目的基因特异性扩增产物的产生,所以PCR扩增只能得到1条片段(Ds3-2到AGL8-1或AGL8-2)。

表1 扩增目的基因的PCR引物序列Table 1 PCR primer sequences for amplification of target genes
1.2.2 拟南芥种子的消毒及处理 取适量拟南芥agl8突变体种子放入1.5 mL离心管中,加入1 mL体积分数12%的次氯酸钠溶液,上下颠倒清洗种子8 min,用枪头吸除溶液。然后向离心管中加入1 mL无菌水,上下颠倒清洗1 min并吸除溶液,重复清洗3次。用剪去尖嘴的小枪头吸取洗净的种子,铺于1/2 MS培养基上,封口膜密封后置于4 ℃冰箱春化处理。3 d后取出置于光照培养箱中,培养条件为:16 h光照/8 h黑暗,光照强度4 000 lx,温度22 ℃。待植株长出6~8片叶时,选取生长一致的幼苗移栽到营养钵中,基质中黑土与蛭石质量比为2∶5,盖上保鲜膜,缓苗3 d后揭膜,常规管理。
1.2.3 拟南芥的遗传转化 在纯合拟南芥agl8突变体植株开花时进行侵染。取1 mL含重组质粒pCAMBIA1305-CsMADS08(含35S启动子)的农杆菌菌液,加入50 mL YEP液体培养基,28 ℃下220 r/min培养至OD600为2.0,于4 ℃、 6 000 r/min离心10 min。取菌体加入Buffer缓冲液(100 mL纯水中加入0.22 g MS、5 g蔗糖及0.05 g MES,调pH至5.8,加入30 μL体积分数0.05%的表面活性剂Silwet-77,磁力搅拌30 min)吸打混匀,重悬至OD600为0.8,将拟南芥花序浸入悬浮液中2 min,并用胶头滴管吸取悬浮液滴到未侵染花上,遮光保湿1 d后正常培养。每隔7 d侵染1次,共侵染3次。种子成熟时采收,37 ℃烘干,4 ℃保存,此为T0代转CsMADS08基因拟南芥种子。
1.2.4 转CsMADS08基因植株的筛选及表型观察 取agl8突变体和T0代转CsMADS08基因拟南芥种子,消毒后铺于含30 mg/L潮霉素的1/2 MS培养基上,4 ℃冰箱春化3 d,22 ℃培养。待植株长出6~8片叶时,将长势良好的幼苗移栽到营养钵中,盖上保鲜膜缓苗3 d。正常培养7 d后提取植株叶片基因组DNA,PCR扩增潮霉素抗性基因Hyg及目的基因CsMADS08。扩增潮霉素基因Hyg反应体系为25 μL:10×PCR Buffer 2.5 μL,dNTPs (10 μmol/L) 0.5 μL,上、下游引物(10 μmol/L)各0.5 μL,模板DNA 0.5 μL,TaqDNA聚合酶(5 U/μL)0.25 μL,ddH2O补足至25 μL。反应条件为:94 ℃ 预变性5 min;94 ℃ 变性1 min;57.5 ℃ 退火45 s;72 ℃ 延伸45 s,30次循环;72 ℃ 延伸10 min;10 ℃停止,4 ℃保存。CsMADS08基因与潮霉素基因Hyg的PCR反应体系相同,仅将引物改为扩增CsMADS08的上、下游引物。PCR反应条件也与潮霉素基因Hyg的相同,仅将退火温度降为55 ℃。以重组质粒pCAMBIA1305-CsMADS08为阳性对照,agl8突变体植株为阴性对照,经检测呈阳性的植株即为T1代转CsMADS08植株,经留种和潮霉素抗性筛选并检测后分别得到T2、T3代。观察并统计野生型植株(9 株)、agl8突变体植株(12株)和T3代转CsMADS08植株(18株)的形态参数,包括根长、株高、侧枝数、叶片特征(形状、大小和数目)、抽薹和开花时间、果荚特性等。采用IBM SPSS Statistics 25进行差异显著性分析。
1.2.5 茎生叶石蜡切片的制备及显微观察 取T3代转CsMADS08植株、agl8突变体植株及野生型拟南芥植株同一部位的成熟茎生叶,立即投入FAA固定液(福尔马林5 mL、冰醋酸5 mL、体积分数70%酒精90 mL)中固定。经酒精梯度脱水处理后,再进行透明处理,然后置于60 ℃恒温箱中用石蜡包埋,番红-固绿染色后切片,荧光显微镜下观察切片横切面并拍照记录。
1.2.6CsMADS08及其下游调控基因表达模式的分析 采用Trizol试剂法提取拟南芥T3代转CsMADS08植株、agl8突变体植株及野生型植株不同组织(根、茎、莲座叶、茎生叶、花、果实)的总RNA,微量核酸测定仪(ND2000)检测RNA纯度及浓度。参照大连宝生物公司的PrimeScriptTMRT Reagent Kit gDNA Eraser反转录试剂盒去除基因组DNA,将RNA反转录成cDNA。将cDNA浓度稀释10倍后作为模板,以UBQ10(表1)为内参基因,用实时荧光定量PCR分析CsMADS08的组织表达情况。同时,根据AGL8的4个下游调控基因SHATTERPROOF1(SHP1)、SHATTERPROOF2(SHP2)、ALCATRAZ(ALC)、INDEHISCENT(IND)序列设计特异性引物(表1),检测SHP1、SHP2、ALC、IND在不同组织中的表达情况。目的基因CsMADS08、内参基因UBQ10及下游调控基因SHP1、SHP2、ALC、IND的实时荧光定量PCR反应体系为20 μL:SYBR Green Master mix 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板(原液稀释10倍) 1.6 μL,RNA-Free Water补足至20 μL。反应条件为:50 ℃反应2 min;95 ℃反应10 min;95 ℃反应15 s;60 ℃反应1 min,40次循环。试验设3个生物学重复、4个技术重复。采用2―ΔΔCt法计算各基因的相对表达量[29]。
2 结果与分析
2.1 拟南芥agl8突变体的验证
为验证拟南芥agl8突变体的纯合性,提取突变体植株叶片基因组DNA,利用三引物法进行PCR扩增,并以野生型植株为对照,结果(图1)显示,野生型植株扩增出1条长度约500 bp的条带,其他突变体植株中只扩增出1条长度小于500 bp的条带,说明这些植株均为纯合突变体。
2.2 转CsMADS08植株的抗性筛选
取agl8突变体和T0代转CsMADS08拟南芥种子,消毒后平铺于含30 mg/L潮霉素的1/2 MS培养基中。结果发现,agl8突变体植株在含潮霉素的培养基上不能正常生长,而转CsMADS08植株在含潮霉素的培养基上可以正常生长,说明CsMADS08基因已整合到突变体拟南芥中并使植株具备潮霉素抗性。提取转CsMADS08植株及agl8突变体植株叶片基因组DNA,PCR扩增目的基因CsMADS08和潮霉素基因Hyg,结果(图2)显示,在转CsMADS08的抗性植株中分别得到相应的扩增条带。
2.3 CsMADS08基因的表型调控功能
将拟南芥agl8突变体植株、转CsMADS08植株及野生型植株同时移栽至相同基质中,定期观察其生长状况,结果见图3。
由图3可以看出,同一时期不同类型植株根长差异不明显;转基因植株、突变体植株、野生型植株从播种到抽薹分别历时13,19,17 d;从播种到第1朵花开放分别历时20,24,21 d。说明CsMADS08基因具有促抽薹和开花的作用。观察成花时不同类型植株的叶片变化情况发现,莲座叶的数目及形状无明显差异,茎生叶大小表现为野生型植株>agl8突变体植株>转CsMADS08植株,其中agl8突变体植株只有基部2片茎生叶较大,且部分叶片轻微卷曲;茎生叶叶片数量表现为转CsMADS08植株>agl8突变体植株>野生型植株。从叶片形状看,野生型植株叶片细长,agl8突变体植株叶片较宽且呈椭圆形,转CsMADS08植株叶片接近圆形。说明CsMADS08基因对茎生叶的形态特征具有调控作用,促使转化株叶片增多、变小。观察嫩果荚及成熟果荚的生长状况发现,agl8突变体植株果荚变短,种子未成熟时果荚便开裂,成熟后果荚较瘦瘪;转入CsMADS08基因后,果荚长度及饱满度均有一定恢复,但仍不及野生型植株,且果荚未成熟时无提前开裂现象。说明CsMADS08基因能部分恢复突变体的表型,对果荚长度、果荚饱满度及果荚开裂等性状有调控作用。
由表2可见,agl8突变体植株最高,转CsMADS08植株次之,野生型植株最低,但三者之间差异不显著;与野生型植株相比,agl8突变体植株及转CsMADS08植株的侧枝数和茎生叶数均显著增加,说明CsMADS08基因能够促进侧枝发育,增加茎生叶数。
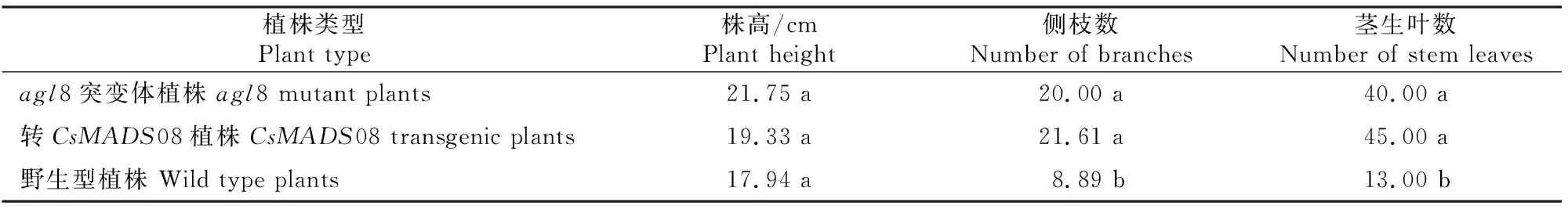
表2 不同类型拟南芥植株株高、侧枝数及茎生叶数比较Table 2 Comparison of plant height as well as numbers of branches and stem leaves of different Arabidopsis plants
2.4 不同类型拟南芥植株茎生叶结构的显微观察
观察agl8突变体植株、转CsMADS08植株及野生型植株同一部位成熟茎生叶细胞结构(图4)发现,相较于野生型植株,agl8突变体植株叶片细胞变小,维管束细胞减少,叶片明显变薄;转入CsMADS08基因后,叶片细胞变大,排列整齐,维管束细胞有所增加,叶片厚度恢复。说明CsMADS08基因是通过调控叶片细胞及维管束细胞的发育来改变叶片形态。
2.5 CsMAD08及其下游调控基因的表达特性
采用Trizol法提取野生型植株、agl8突变体植株及转CsMADS08植株根、茎、莲座叶、茎生叶、花及果实总RNA,反转录成cDNA,采用实时荧光定量PCR检测目的基因CsMADS08在植株各组织中的表达情况。结果(图5)表明,agl8突变体植株各组织中CsMADS08基因表达量均较低,且与野生型植株差异不显著,但二者均显著低于转CsMADS08植株。转CsMADS08植株中,CsMADS08基因在各组织中均有大量表达,且在茎生叶中表达量显著高于其他组织。
用实时荧光定量PCR检测agl8突变体植株、转CsMADS08植株及野生型植株下游调控基因SHP1、SHP2、ALC、IND在不同组织中的表达情况。结果(图6)表明,与野生型植株相比,agl8突变体植株各组织中SHP1、SHP2、ALC、IND基因表达总体上均上调,且以茎生叶表达量最高。与agl8突变体植株相比,这4个基因只在转CsMADS08植株花中表达上调,尤以IND基因上调明显;而在其他组织中均下调,且以茎生叶和莲座叶降幅明显。说明CsMADS08基因对下游基因具有双向调控作用,在花中正调控SHP1、SHP2、ALC、IND基因的表达,而在其他组织中则具负调控作用,且在茎生叶中作用最明显。
3 讨论与结论
3.1 黄瓜CsMADS08基因对植株生长发育的调控
研究发现,拟南芥开花过程是由一连串信号转导及家族基因协同调控的,其中FUL参与调控芽顶端分生组织向花序分生组织的转变,并与AGL20/SOC1在发育的花序原形成层中共同表达,进一步诱导花器官发育,从而调控开花时间[30]。本研究发现,与野生型植株相比,拟南芥agl8突变体植株抽薹及开花时间延迟,CsMADS08基因在突变体植株花器官中表达量无显著变化;而转CsMADS08植株抽薹及开花时间较突变体植株提早4~6 d,且CsMADS08基因在花器官中表达量显著增加。说明CsMADS08基因作为FUL的同源基因,具有促进开花的作用,其调控开花时间的信号途径及基因调控网络还需进一步研究。
MADS-box家族基因能调控植株叶片的形状和数量。如从薄壳山核桃中克隆出的MADS-box基因CiMADS9,异源转化拟南芥后会使其叶片数量增多[31];过表达太行花TrAP1基因的拟南芥莲座叶呈黄绿色,边缘呈锯齿状[32];过表达黄瓜AGL15亚家族CsMADS26及SEP3同源基因CsMADS02的拟南芥叶片形态均发生改变,出现叶片变小、莲座叶及茎生叶卷曲等表型[2,33]。还有研究发现,拟南芥开花诱导基因FT的产物可以促进FUL基因在叶片中的表达,而FUL产物的积累会使叶片细胞排列紧密,体积变小[25]。本试验中,野生型、agl8突变体及转CsMADS08基因拟南芥植株莲座叶的数目及形状无明显差异,而茎生叶数量及形状均有明显差异;其中野生型拟南芥叶片细长,茎生叶大而少;agl8突变体植株茎生叶呈椭圆形,只有基部2片茎生叶较大,叶片较宽且数量变多,有部分叶片轻微卷曲;转CsMADS08植株叶片小而密集,形状接近圆形。经显微观察发现,拟南芥agl8突变体植株叶片细胞变小,排列松散,维管束细胞减少,叶片变薄;转CsMADS08植株叶片细胞变大,排列整齐,维管束细胞增加,叶片变厚。这与Gu等[25]的研究结果相似,即转化株中细胞变大且排列紧密,因此体积明显变小而无卷曲现象。实时荧光定量PCR检测结果显示,CsMADS08基因表达量在茎生叶中最高,推测CsMADS08基因通过影响叶片细胞及维管束细胞的发育来调控茎生叶的形态。
目前,研究者已经在葡萄、草莓、香蕉等多种植物中发现MADS-box转录因子参与调控果实成熟,如番茄LeMADS-RIN、与番茄RIN基因高度同源的香蕉MaMADS2、葡萄VvTM6等均参与了果实成熟的调控[34]。拟南芥FUL基因既可控制角果的伸长,也会影响裂片细胞的发育[35]。蒋励[23]研究发现,拟南芥CsFUL1可能作为黄瓜果实长短发育的负调控因子,通过调控细胞分裂而影响果实发育。本试验中,拟南芥agl8突变体果荚较短,较瘦瘪,未成熟时便开裂;转入CsMADS08基因后,果荚长度及饱满度有一定恢复,且未成熟时无果荚开裂现象。说明CsMADS08基因可能参与了果实发育的调控过程。
目前,有关黄瓜MADS-box转录因子的研究多集中在调控叶片形态、花及果实发育方面,对于侧枝发育的调控研究较少。本课题组前期研究发现,过表达CsMADS08基因的拟南芥植株侧枝减少[36]。本研究也发现,转CsMADS08基因拟南芥侧枝数最多,其次是agl8突变体植株,野生型植株侧枝数最少。说明CsMADS08基因可能参与了调控植株侧枝的发育,而侧枝多的植株可分化形成更多的茎生叶叶片。侧枝为黄瓜的一个重要农艺性状,因此研究CsMADS08在黄瓜侧枝发育中的作用,可为今后黄瓜品种改良研究提供理论依据。
3.2 CsMADS08下游调控基因的表达特性
FUL基因是前人在拟南芥中发现的第1个与果荚开裂相关的基因,SHP1和SHP2是FUL的下游基因,与离层的形成和裂片边缘木质化有关。ALC和IND是SHP的下游基因,其中ALC控制角果裂片边缘和胎座连接处离层细胞的形成,IND控制两个裂片之间离层细胞的分化[37]。野生型拟南芥中FUL基因负调控SHP1和SHP2,而SHP正向调控ALC和IND的表达,使果荚木质化受阻,直至成熟开裂[38]。而当FUL基因功能缺失时,SHP1、SHP2、ALC、IND在裂片边缘中大量表达,加速裂片细胞分化,从而导致果荚提前开裂。本试验中,拟南芥agl8突变体未成熟时果荚即开裂,转入CsMADS08基因后恢复正常。实时荧光定量PCR检测结果显示,与野生型植株相比,拟南芥agl8突变体中SHP1、SHP2、ALC、IND均上调表达,且在茎生叶中表达量均最高;转入CsMADS08基因后,SHP1、SHP2、ALC、IND在根、茎、叶及果实中表达均下调,其在茎生叶中下调最为明显。说明CsMADS08基因与FUL基因功能一致,能够负调控SHP1、SHP2、ALC、IND在植株中的表达,抑制果荚木质化,使其正常开裂。
