甘蓝尾菜与干水稻秸秆混贮的发酵品质、菌群演替及关键菌群研究
2022-02-25张静娴杜桂林史吉平马治国袁辰阳刘相岑张保国
张静娴,杜桂林,3,史吉平,3,马治国,袁辰阳,3,刘相岑,张保国
(1中国科学院 上海高等研究院,上海 201210; 2中国科学院大学,北京 100049; 3上海科技大学 生命学院,上海 201210)
随着人口数量增加、人民生活水平逐渐提高,一系列社会问题日益凸显,比如农业和食品加工业的固体废弃物骤增带来的环保压力,耕地面积锐减导致粮食和饲料用地竞争、饲料成本上升[1-2]。水稻和蔬菜是维持人类营养需求的两大类主要作物,据统计我国每年因生产和销售产生的蔬菜废弃物及水稻秸秆约8亿和9亿t[2-3],蔬菜废弃物通常含水率高,易腐烂,比如甘蓝、花椰菜、苋菜;而水稻秸秆含水量低,降解速度慢。据报告我国每年约有20%作物秸秆和70%蔬菜废弃物未被合理利用,而是采用焚烧或者掩埋方式处理,从而引起大气和土壤污染、温室气体排放、病原体传播等环境污染问题,所以这两类农业固体废弃物的减量化和资源化利用方式亟待开发[2,4-6]。这两类作物废弃物的产生具有季节性、区域性的特点,利用两者含水率互补的特点将其饲料化利用是一种被普遍认可的资源化方式[1,3,7-9]。事实上,蔬菜废弃物干物质中富含维生素、粗脂肪,而作物秸秆富含反刍动物能够消化利用的多糖,所以蔬菜废弃物和作物秸秆可作为廉价的饲料原料来应对饲料短缺、成本高的问题;此外将二者混合贮存不仅可以有效延长饲料贮藏时间,而且还可以有效降低饲料原料附生的病原菌、改善感官品质和营养成分[7,10]。因此,研究甘蓝尾菜和干水稻秸秆混贮发酵方式,对于缓解农业固废带来的环境压力和饲料短缺问题具有重要意义。
混合青贮是一个厌氧固体发酵过程,通常伴随着微生物群落演替、新陈代谢,从而改变饲料原料的理化特性。发酵良好的青贮饲料往往是以乳酸菌为优势和关键物种,通过同型乳酸发酵降低原料pH和病原菌含量,使干物质含量不变[10]。据报道,新鲜青贮饲料原料中的乳酸菌数量达到105CFU/g,可有效保留饲料中的养分[2-11]。在青贮过程中,附生乳酸菌将水溶性碳水化合物代谢为有机酸(如乳酸、乙酸、丁酸),以迅速降低pH值并抑制有害微生物以及青贮过程不需要的其他微生物。然而,还有一些附生病原体(如肠杆菌属Enterobacter、曲霉菌属Aspergillus)和产孢细菌(如梭状芽孢杆菌Clostridium、芽孢杆菌属Bacillus)可以存在于酸性和厌氧环境中,导致微生物毒素积累和乳酸发酵生产效率降低[10,12-13]。系统地研究青贮饲料发酵过程中的微生物群落演替、多样性及其表型功能,可以促进对青贮饲料生产过程的了解。前人在分析微生物多样性时应用了多种分子生物学的方法,如16S rRNA克隆建库、变性梯度凝胶电泳技术(PCR-DGGE)、限制性片段长度多样性(T-RFLP)等[14]。目前,新一代高通量测序技术在微生物多样性分析中应用较多,其直接根据样品中提取的DNA,同时进行几十万到几百万条DNA分子进行序列测定,不仅能够分析样品中的微生物种类以及相对丰度(RA),而且能够对样本中的微生物实现精准的分类,挖掘分析样品中低丰度的菌群,最大限度地保留样品中微生物的信息[14-15]。与此同时,新一代测序技术(如16S rRNA基因克隆文库、宏基因组学)和生物信息学注释工具(如BugBase、FUNGuild)的开发使得环境微生物研究更加方便[16-20],例如Du等[21]在甘蓝尾菜厌氧发酵过程中,基于OTU测序数据首次利用BugBase和FUNGuild注释工具预测微生物群落功能多样性。研究报道,生态环境中微生物群落的演替以及环境因子的变化主要受到关键物种而非优势物种的影响[20,22],而在青贮饲料领域很少有学者关注关键物种的作用机制。
本研究将蔬菜废弃物甘蓝尾菜与干水稻秸秆混合贮存厌氧发酵30 d,分析厌氧发酵过程中发酵指标、营养成分、微生物群落演替和表型功能变化,同时探究影响微生物群落演替及其青贮性能的关键微生物物种,旨在为甘蓝尾菜和干水稻秸秆饲料化利用提供参考。
1 材料与方法
1.1 材 料
干水稻秸秆购自长远秸秆加工厂(中国安徽),均匀粉碎至长度为1~2 cm。甘蓝(BrassicaoleraceaL.)尾菜收集于上海市浦东新区北蔡农产品批发市场,切碎至大小为2 cm×2 cm。玉米粉购自河北保定涞水县金谷粮油食品有限公司。3种原材料的主要理化特性(以干物质计)见表1。
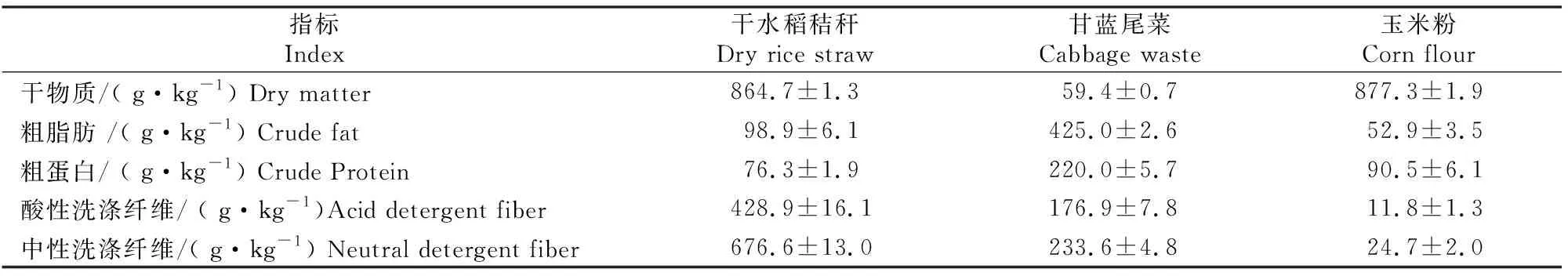
表1 3种原材料的主要理化特性Table 1 Physicochemical parameters of the three raw materials
EM菌剂(产品编号:OKH0601;粪肠球菌≥10亿 CFU/g,枯草芽孢杆菌≥100亿CFU/g)购自洛阳欧科拜克生物技术股份有限公司(中国河南),主要包括泛菌属Pantoea和肠球菌属Enterococcus。
1.2 青贮试验设计
将10.0 g EM菌剂和100 mL无菌8.0 g/L NaCl溶液于500 mL锥形瓶中混合,30 ℃恒温条件下振荡1 h,获得液体接种剂。每袋混贮发酵样品由180 g甘蓝尾菜、40 g干水稻秸秆、40 g玉米粉和5 mL上述液体接种剂组成,自然pH值和含水率。将混合原料装入青贮发酵袋(23 cm×30 cm,PET塑料)中,用真空封口机抽尽空气并封口,共15个平行,将青贮发酵袋置于30 ℃恒温培养箱中,避光厌氧发酵30 d。在发酵的第0,3,7,15,30天取样,每次取样3个平行,并于-20 ℃冰箱保存。
1.3 分析样本的制备
第一份浸提液沉淀的收集:将20.0 g青贮样品与180 mL无菌8.0 g/L NaCl溶液在500 mL锥形瓶中混合,30 ℃恒温条件下振荡1 h,之后将上述溶液用4层无菌医用纱布抽滤,将滤液在4 ℃、10 000×g离心20 min,收集沉淀物用于微生物群落分析。
第二份浸提液的上清液收集:收集方法与第一份浸提液类似,只是用无菌水代替无菌8.0 g/L NaCl溶液,于4 ℃、10 000×g离心20 min后收集上清液,用于分析后续的理化指标(水溶性碳水化合物(WSC)、pH、乙酸、丁酸、乳酸、乙醇、氨氮、总氮含量)[23]。
1.4 理化特性分析
1.4.1 发酵品质 取100 g左右混贮发酵样品于65 ℃下干燥72 h以测定干物质(DM)含量。参考Gu等[24]的方法,使用岛津20AVP液相色谱系统(日本京都岛津公司)检测有机酸(乳酸、乙酸、丁酸)和乙醇含量。使用数字pH计(美国Sartorius PB-10)测定pH值。使用纳氏试剂(美国Hach公司)测定氨氮含量,使用元素分析仪(Perkinelmer系列Ⅱ 2400,英国)检测总氮含量,铵态氮含量用氨氮与总氮含量之比计算。WSC含量采用蒽酮法[25]测定。
1.4.2 营养成分 取100 g左右混贮发酵样品于65 ℃下干燥72 h,之后将样品用小型粉碎机粉碎后过孔径0.037 mm筛,并用自封袋保存于干燥避光处,用于测定营养成分(粗蛋白(CP)、粗脂肪(CF)、酸性洗涤纤维素(ADF)、中性洗涤纤维素(NDF))含量,具体检测方法参考张丽英的《饲料分析及饲料质量检测技术》[26]进行分析。
1.5 样品DNA的提取和PCR扩增
称取0.25 g第一份浸提液沉淀,参考E.Z.N.A.®soil DNA Kit (Omega Bio-Tek,Norcro-ss,GA,USA)说明书提取基因组DNA,DNA样品的纯度和浓度用NanoDrop 2000 UV-vis spectrophotometer (Thermo Scientific,Wilmington,USA)检测,所有DNA样品均保存在-80 ℃冰箱。以上述基因组DNA为模板进行PCR扩增,扩增原核生物16S的V3-V4可变区域和真核生物的内源转录间隔区ITS1-ITS2,使用的引物分别为带有条形码融合引物的338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTC-TAAT-3′)以及ITS1F(5′-CTTGGTCATTTAGA-GGAAGTAA-3′)和ITS2R(5′-CTTGGTCATTTAGAGGAAGTAA-3′)。使用1.5%琼脂糖凝胶电泳检测PCR产物的质量,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)回收PCR产物,操作流程参考AxyPrepDNA凝胶回收试剂盒说明书进行。将回收的PCR产物送至上海美吉生物医药科技有限公司进行Illumina文库构建和Illumina MiSeq平台(Illumina,San Diego,USA)测序,具体流程参考任海伟等[5]的方法进行。本研究中的所有原始序列集已上传到NCBI(BioProject ID:PRJNA686717,https://www.ncbi.nlm.nih.gov/sra)。
1.6 生物信息学分析
使用QIIME(版本1.9.1,http://qiime.org/)对原始Illumina fastq文件进行解复用、质量过滤和分析。使用UPARSE(版本7.1)将质量过滤后的序列聚类作为操作分类单元(OTU),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。用UCHIME去除嵌合序列,使用RDP Classifier2.2将测序序列与数据库silva138 (https://www.arb-silva.de/)和Unite 8.0(https://unite.ut.ee/)中的序列进行比对和物种注释,置信阈值为70%。质控后的序列以OTU为最小分类单元进行抽平,每个OTU对应序列数除以总序列数即为该OTU对应的相对丰度(RA)。生物信息学分析均在Majorbio云平台上(https://www.majorbio.com)进行操作。青贮过程中细菌和真菌的Alpha多样性指数(Coverage指数、Shannon指数、Chao1指数)使用Mothur 1.30.2分析。青贮过程中微生物物种的差异使用PCoA和Adonis检验(OUT水平999个随机排列,Bray-Curtis相异)进行评估。用BugBase(https://bugbase.cs.umn.edu/)预测和分析细菌表型[17],利用FUNGuild(http://www.funguild.org/)对真菌的表型、营养模式和生态公会进行注释[18]。基于物种属水平的相对丰度,分析物种之间Spearman相关性,并构建共现性网络图,使用Gephi 0.9.2绘制其共现性网络图,红色和绿色的点(nodes)分别代表细菌属和真菌属,红色和绿色的边(edges)分别代表相连的两个属的正相关和负相关关系,共现性网络图仅展示RA>1%的属之间的相关性(Spearman相关性系数>0.7,P<0.05)[27]。利用冗余分析(RDA,Canoco 5)评估甘蓝尾菜与干水稻秸秆混贮发酵过程中样品理化指标与微生物优势物种间相关性,并计算了理化指标pH、CF、WSC等对微生物优势物种变化的解释度[28]。
1.7 数据统计与分析
利用SPSS 26.0软件计算和分析数据,Origin 2021绘制图形,Excel 2019绘制表格。数据之间的差异性用单因子ANOVO模型分析,并用Tukey事后检验进行多重比较分析(P<0.05)。
2 结果与分析
2.1 甘蓝尾菜与干水稻秸秆混贮发酵过程中发酵品质的变化
甘蓝尾菜与干水稻秸秆混贮发酵过程中发酵品质的变化如表2所示。
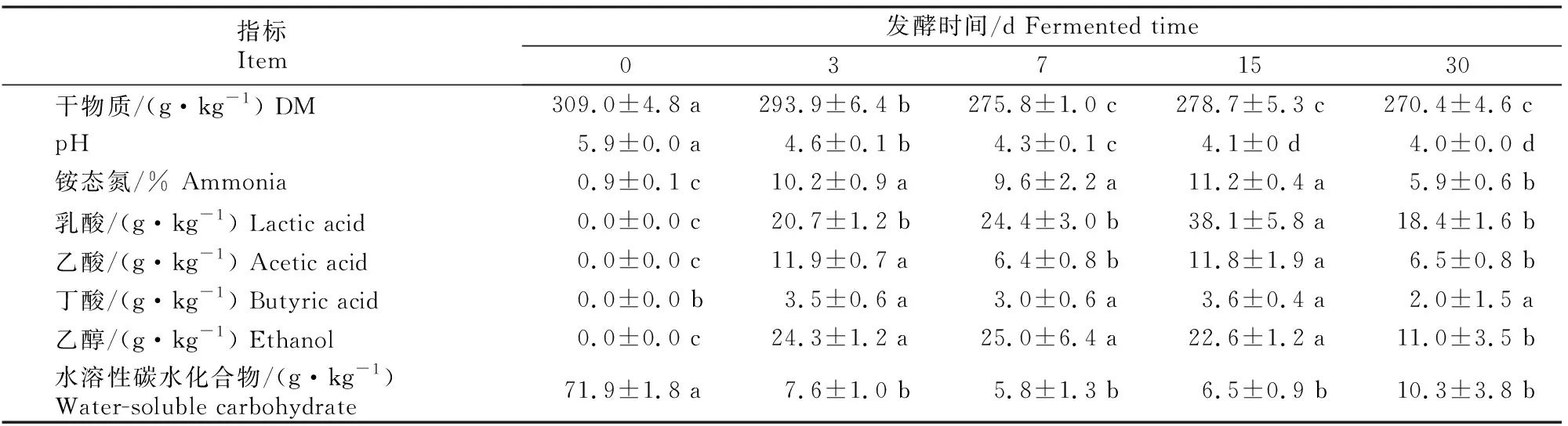
表2 甘蓝尾菜与干水稻秸秆混贮发酵不同时间后发酵品质的变化Table 2 Variation of fermentation characteristic indicators with different fermentation times in co-ensiling of cabbage waste and dry rice straw
表2显示,与发酵前(第0天)相比,发酵结束时(30 d)pH、干物质和水溶性碳水化合物含量显著下降,乳酸、乙酸、丁酸和乙醇含量显著积累(P<0.05)。随着发酵时间的增加,干物质含量逐渐降低,发酵结束时为270.4 g/kg,干物质含量保留了87.5%。pH值由初始的弱酸性5.9迅速降低到4.6(第3天),并于腐熟阶段(第30天)降低至4.0。与发酵前相比,第3~15天铵态氮含量显著增加,但在发酵结束时降低到5.9%。微生物发酵代谢产物有机酸和乙醇含量的变化趋势与铵态氮相似,即发酵前期迅速增加而发酵结束时明显降低。上述结果表明甘蓝尾菜和干水稻秸秆混贮发酵过程中,发酵品质明显改善,但15 d之后发酵品质会略有下降。
2.2 甘蓝尾菜与干水稻秸秆混贮发酵过程中营养成分的变化
甘蓝尾菜与干水稻秸秆混贮发酵过程中主要营养成分的变化如表3所示。表3显示,与发酵前相比,发酵结束时粗脂肪、粗蛋白、酸性洗涤纤维素含量无显著变化(P>0.05),而中性洗涤纤维素含量显著上升(P<0.05)。随着发酵时间的增加,粗脂肪含量总体上先降低后增加,粗蛋白含量无明显变化,酸性洗涤纤维素和中性洗涤纤维素含量总体上均先增加后降低。

表3 甘蓝尾菜与干水稻秸秆混贮发酵不同时间后营养成分的变化Table 3 Variation of nutrition indicators with different fermentation times in co-ensiling of cabbage waste and dry rice straw g/kg
2.3 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落演替的变化
微生物Alpha多样性指数(Coverage指数、Shannon指数、Chao1指数)可以反映物种的多样性,其中Coverage指数表示测序和处理后的数据是否能代表样本中微生物群落的真实情况;Shannon指数越大,说明群落多样性越高;Chao1指数越大,说明群落丰富度越高。甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落演替的变化见表4和表5。
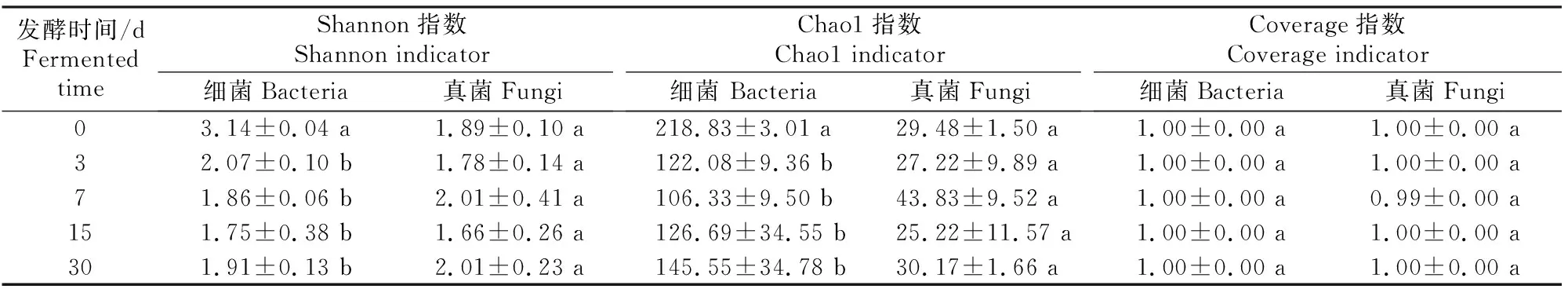
表4 甘蓝尾菜与干水稻秸秆混贮发酵不同时间后微生物群落Alpha多样性指数的变化Table 4 Variation of Alpha diversity indicators of microbial community with different fermentation times in co-ensiling of cabbage waste and dry rice straw
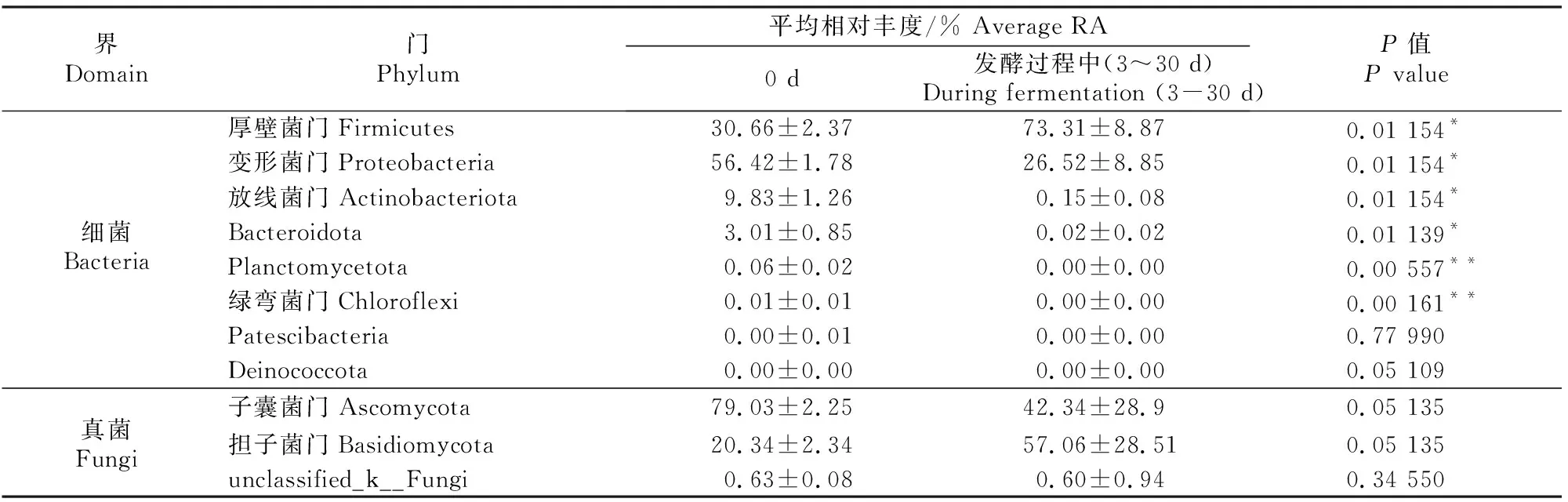
表5 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落门水平上的物种相对丰度比较Table 5 Comparison of species RA differences of microbial communities at the phylum level in co-ensiling of cabbage waste and dry rice straw
由表4可知,细菌和真菌群落的Coverage指数为0.99~1.00,说明研究结果准确地反映了贮存过程中的微生物群落的变化。细菌群落的Shannon指数、Chao1指数均于发酵第3天之后显著下降(P<0.05),真菌群落的Shannon指数和Chao1指数无显著变化,可知与真菌群落相比,混贮发酵过程对细菌群落的影响更显著。
表5显示,发酵前(0 d)门水平上的优势物种(RA>5%)包括细菌界的厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)和真菌界的子囊菌门(Ascomycota)、担子菌门(Basidiomycota)。与发酵前(0 d)相比,发酵过程中(3~30 d)细菌界优势物种放线菌门和变形菌门相对丰度显著下降(P<0.05),厚壁菌门相对丰度显著增加(P<0.05);真菌界的优势物种子囊菌门和担子菌门相对丰度无显著变化(P>0.05)。
表6显示,发酵前(0 d)属水平上的优势物种(RA>5%)包括细菌界的泛菌属(Pantoea,RA 33.42%)、芽孢菌属(Bacillus,RA 18.98%)、肠杆菌属(Enterobacter,RA 10.15%)和真菌界的节担菌属(Wallemia,RA 20.14%)、镰孢菌属(Fusarium,RA 44.28%)、曲霉属(Aspergillus,RA 19.53%)、未分类的酵母目(unclassified_o__Saccharomycetales,RA 13.77%)。与发酵前(0 d)相比,发酵过程中(3~30 d)细菌界的片球菌属(Pediococcus)、未分类的肠杆菌科(unclassified_f__Enterobacteriaceae)、肠球菌属(Enterococcus)、魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、未分类的乳杆菌科(unclassified_f__Lactobacillaceae)相对丰度均显著增加(P<0.05),泛菌属、芽孢菌属和葡萄球菌属(Staphylococcus)相对丰度均显著下降(P<0.05);发酵过程中真菌界的unclassified_f__Dipodascaceae相对丰度显著增加,镰孢菌属(Fusarium)、曲霉属(Aspergillus)、未分类的酵母目(unclassified_o__Saccharomycetales)、帚枝霉属(Sarocladium)相对丰度均显著下降(P<0.05)。
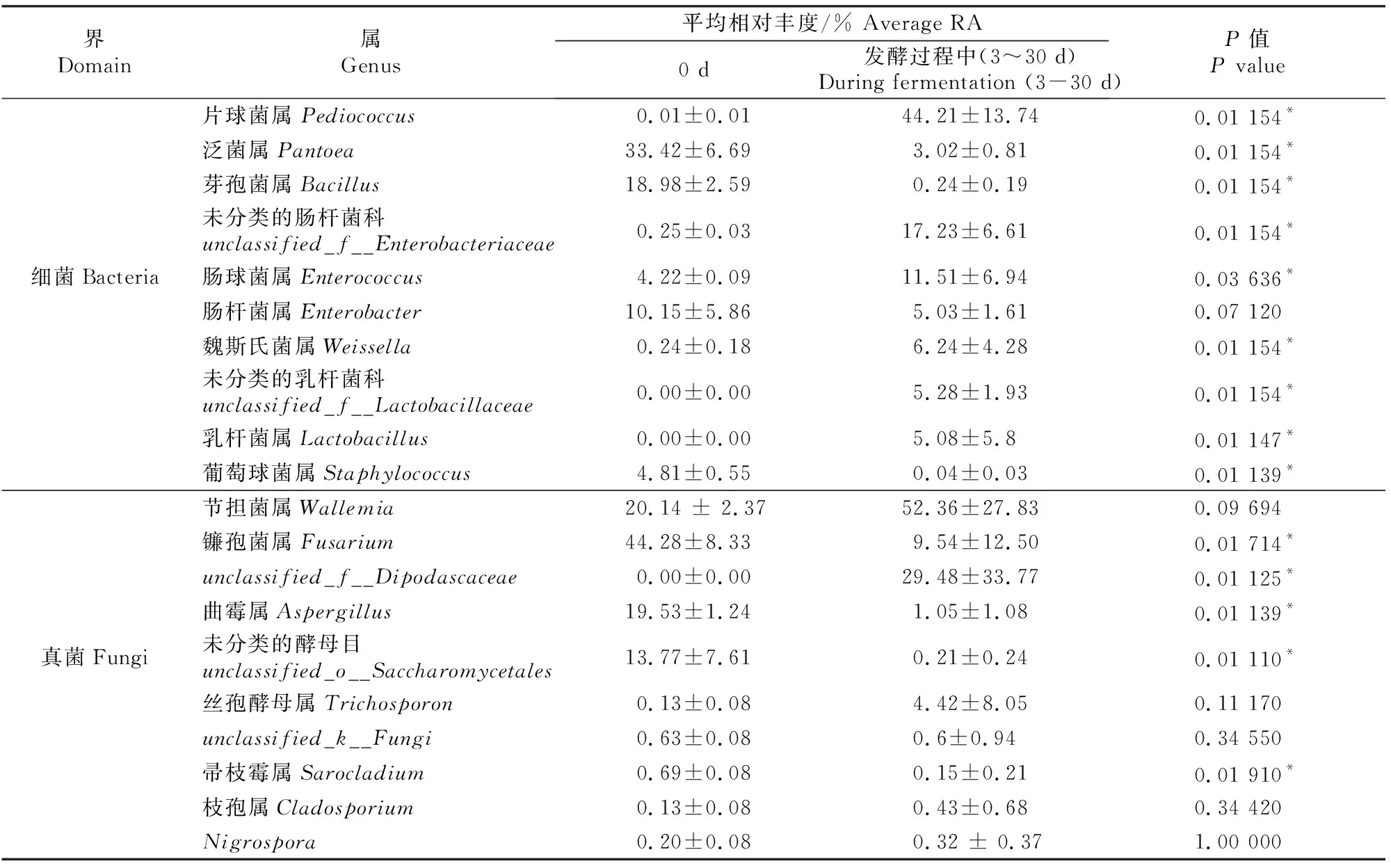
表6 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落属水平上的物种相对丰度比较Table 6 Comparison of species RA differences in microbial communities at the genus level in co-ensiling of cabbage waste and dry rice straw
2.4 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落功能多样性的变化
微生物群落组成的变化可能引起其功能多样性的变化。基于细菌16S的V3-V4可变区域和真核生物的内源转录间隔区ITS1-ITS2的测序结果,对甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落的功能表型进行注释,结果见图1。图1显示,9种细菌功能表型被注释,包括耐氧性(需氧型、厌氧型、兼性厌氧型),革兰氏阳性/革兰氏阴性,形成生物膜,包含移动原件,潜在致病型,氧化胁迫耐受;同时12种真菌功能表型被注释,包括未定义的腐生型、土壤腐生型、植物致病型、动物致病型、未知型以及致病型1~7。初始阶段(第0天),原材料中细菌群落的主要类型包含兼性厌氧型(RA 81.1%)、需氧型(RA 18.8%)、厌氧型(RA 0.2%)、形成生物膜(RA 66.3%)、革兰氏阴性(RA 59.5%)、潜在致病型(RA 74.5%);发酵过程中,需氧型、形成生物膜、潜在致病型、革兰氏阴性细菌相对丰度总体上均显著降低(P<0.05),并在第30天时相对丰度分别为8.0%,31.5%,31.8%,31.3%。发酵0 d时,原料中富集两类真菌群落,分别为未定义的腐生型真菌(RA 54.60%)和动物致病型-植物内生型-地衣寄生型-植物病原型-土壤腐生型-木腐型(致病型4,RA 44.28%),发酵过程中致病型真菌相对丰度显著下降,未定义的腐生型真菌显著富集(P<0.05);青贮第30天时,真菌群落的表型主要包括动物致病型(RA 15.64%)和未定义的腐生型真菌(RA 80.55%)。
2.5 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物群落间的互作关系
为了观测微生物群落演替过程中物种间的互作关系,基于物种属水平相对丰度的变化构建了共现性网络,结果见图2。图2显示,共现性网络由38个点(代表细菌属或真菌属)和91条无向的边(代表相连细菌属或真菌属之间的相关性)组成,包含72个显著较强的正相关关系和19个显著较强的负相关关系;网络直径为7.0,平均维度4.8,模块性0.424,仅1个连接的组分。片球菌属、肠球菌属、乳杆菌属、未分类的乳杆菌科4类乳酸菌与其他物种多呈负相关关系;节担菌属Wallemia和unclassifi-ed_f__Dipodascaceae2类腐生型真菌与其他物种多呈负相关关系。细菌属的维度(单个属具有的相关性)普遍高于真菌属,尤其是鞘氨醇单胞菌属Sphingomonas、类芽孢杆菌属Paenibacillus、短杆菌属Brevibacterium、芽孢杆菌属Bacillus。优势物种片球菌属与泛菌属Pantoea、葡萄球菌属Staphylococcus、曲霉菌属Aspergillus呈负相关关系,与unclassified_f__Dipodascaceae呈正相关关系。乳杆菌属Lactobacillus与未定义的酵母目unclassified_o__Saccharomycetales、假单胞菌属Pseudomonas、曲霉属Aspergillus呈负相关关系,与假丝酵母属Candida呈正相关关系。肠球菌属Enterococcus与短状杆菌属Brachybacterium、小单胞菌属Micromonospora、短杆菌属呈负相关关系,与魏斯氏菌属Weissella、未分类的乳杆菌目unclassified_o__Lactobacillales呈正相关关系。未分类的乳杆菌科unclassified_f__Lactobacillacea与泛菌属、Lapillicoccus呈负相关关系。优势真菌节担菌属Wallemia与类芽孢杆菌属Paenibacillus、鞘氨醇单胞菌属、短状杆菌属呈负相关关系;优势真菌unclassified_f__Dipodascaceae与Methylobacterium-Methylorubrum、葡萄球菌属、镰孢菌属Fusarium、曲霉属呈负相关关系,与片球菌属、假丝酵母属Candida呈正相关关系。
2.6 甘蓝尾菜与干水稻秸秆混贮发酵过程中微生物优势物种与理化指标的相关性
利用冗余分析(RDA)研究混贮发酵过程中优势微生物物种相对丰度与理化指标的相关性,以及理化指标对优势物种变化的解释度,结果见图3。图3显示,RDA前两个轴共解释了86.76%的优势物种的变化,此外pH、WSC、CF是影响微生物优势物种演替的关键理化因子,分别解释了微生物优势物种演替的73.7%,10.2%,4.7%。pH、CF、WSC、DM之间呈正相关,其与微生物代谢产物有机酸(乳酸、乙酸、丁酸)以及乙醇和铵态氮含量之间呈负相关。pH、WSC与优势物种镰孢菌属、曲霉属、泛菌属、肠杆菌属相对丰度之间呈正相关关系,与片球菌属、未分类的肠杆菌科unclassified_f__Enterobacteriaceae的相对丰度之间呈负相关关系。CF与优势物种肠球菌属、节担菌属相对丰度之间呈负相关关系。
3 讨 论
3.1 混贮发酵过程中理化指标的变化
混贮发酵过程中充足的DM (>200 g/kg)和WSC (>50 g/kg)是反映青贮饲料品质优劣的基础指标[29]。本研究中,甘蓝尾菜与干水稻秸秆发酵0 d时DM(309.0 g/kg)和WSC含量(71.9 g/kg)均达标,发酵结束时(30 d)DM、WSC含量以及pH均显著下降,可能是因为微生物降解了原料中的碳水化合物,尤其是易降解的WSC代谢产生了乙醇、铵态氮和有机酸(LA、AA和BA)。pH值是评价青贮饲料品质优良的重要指标[5]。一般优良青贮饲料的适宜pH为3.8~4.2。本试验中,pH值在发酵15 d时为4.1,发酵结束时为4.0,在适宜pH范围内。Cao等[11]发现,蔬菜废弃物贮存过程中,有机酸的积累会导致pH迅速下降,并且抑制霉菌、肠杆菌、芽孢杆菌的富集,这与本研究结果一致。此外,研究发现,优良品质的青贮饲料中铵态氮含量应低于10%,而青贮饲料中铵态氮是由粗蛋白和多肽降解产生的,过高的铵态氮含量可能表征青贮饲料中蛋白质和多肽水解反应迅速,营养流失过快[7]。本试验中,铵态氮含量在青贮3~15 d过程中较高,表示青贮前半阶段饲料中蛋白质和多肽流失较快;青贮结束时铵态氮含量保持在5.9%,达到适宜铵态氮含量范围。本试验中,与发酵15 d相比,发酵结束(30 d)时乳酸含量显著下降,可能是酵母菌与乳酸菌存在共生机理作用,酵母菌可以分泌水解酶代谢脂肪、蛋白质和乳酸盐,产生乳酸,为乳酸菌代谢提供了更多的底物[30-31]。本研究中,随着发酵时间的增加,CF含量总体上先降低后增加,CP含量无明显变化,ADF和DNF含量总体上均先增加后降低。可能是因为微生物优先代谢易降解的营养成分,如CP、CF、WSC,而ADF和NDF在厌氧条件下难以分解,所以在混贮发酵过程中ADF和DNF含量会略有上升。
3.2 混贮发酵过程中微生物群落的演替
微生物群落的演替及其代谢作用在青贮过程中起到至关重要的作用,尤其是关键乳酸菌可以将底物中的碳水化合物代谢为乳酸,并抑制病原菌在发酵过程中的富集。Alpha多样性指数可以反映微生物物种的多样性。本试验中,真菌和细菌群落Coverage指数均大于0.99,表示测序结果准确地反映了贮存过程中的微生物群落变化;细菌Shannon指数和Chao1指数在混贮发酵过程中均显著下降(P<0.05),真菌Shannon指数和Chao1指数在整个混贮发酵过程中无显著变化(P>0.05),说明本试验中发酵过程对细菌群落影响较大,对真菌群落影响较小。
混贮发酵样品的品质与微生物菌群结构有密切联系。本试验中,发酵结束时优势细菌(RA>5%)由初始的泛菌属、芽孢菌属、肠杆菌属转变为乳酸菌(片球菌属、肠球菌属、魏斯氏菌属、未分类的乳杆菌科)和肠杆菌类(未分类的肠杆菌科、肠杆菌属)。据报道,乳杆菌属、片球菌属、肠球菌属和魏斯氏菌属是青贮饲料中常见的乳酸菌,与发酵过程中有机酸的积累密切关联[2,32];而肠杆菌类细菌由于其具有较低的产有机酸效率和蛋白质水解产铵态氮能力,通常被认为是非理想菌群。在本试验中,主要的乳酸菌和肠杆菌类细菌平均相对丰度分别是72.3%和22.2%,而相对丰度较高的肠杆菌类细菌可能造成干物质损失和铵态氮积累,所以为了提高青贮品质,建议选用更适用的接种物,比如植物乳杆菌Lactobacillusplantarum[2]。本研究中,发酵结束时真菌群落的优势物种由腐生型的节担菌属、曲霉属、未分类的酵母目以及致病型的镰孢菌属转变为腐生型的节担菌属、致病型的镰孢菌属,其中致病型的镰孢菌属和腐生型的曲霉属相对丰度在发酵过程中显著下降,可能是因为较低的pH不利于其生长。Keshri等[16]发现,在小麦秸秆青贮曝气过程中乳酸的降解和pH上升会导致镰孢菌属、曲霉属2类霉菌显著富集,造成混贮发酵样品养分流失[16]。本试验中,青贮厌氧条件良好,混贮发酵样品发酵特征指标良好,发酵结束时镰孢菌属、曲霉属的相对丰度也明显下降。unclassified_f__Dipodascaceae属于酵母目,在混贮发酵过程中相对丰度显著增加,而原材料中的未分类的酵母目unclassified_o__Saccharomycetales相对丰度显著下降,这2个属都是腐生型真菌,不具备致病性。
3.3 混贮发酵过程中微生物群落功能的变化
在以往研究中,由于微生物群落较为复杂,故研究优势物种的功能表型效率很低,而BugBase、FUNGuild、PICRUSt2等生物信息学工具的开发,使预测微生物群落功能表型的效率得到明显提高,且准确性更高。本试验中,与发酵前(第0天)相比,发酵结束(30 d)时需氧型、形成生物膜、革兰氏阴性、潜在致病型细菌相对丰度均显著下降(P<0.05),同时动物致病型的真菌群落的相对丰度也显著下降(P<0.05)。据前人报道,如果新鲜蔬菜废弃物中乳酸菌的含量低于105CFU/g 新鲜原料,或者新鲜原料需氧型细菌含量大于106CFU/g ,可能会造成发酵过程中低效率的乳酸发酵和好气性败坏[2,10-11],其中能形成生物膜的细菌可以紧密吸附到材料表面并且抵抗恶劣的外界环境,比如高温、低pH和抗生素环境,这类细菌本身不一定具有致病性,但会给一些致病菌提供适宜的生长和传播环境,从而引起寄主的一系列侵袭性疾病[33]。革兰氏阴性细菌往往是潜在致病菌,由于其外膜上带有的内毒素会在细胞裂解后释放出来,对于反刍动物以外的动物来说,饲料中富集这类细菌可能会造成动物的食物中毒反应[10]。而对于动物致病性真菌,例如镰孢菌属在青贮过程中通常会产生镰刀霉毒素,会严重影响畜牧行业动物的生长性能和产品品质[12]。本试验中,上述几类非理想微生物的相对丰度明显下降,推测可能与混贮发酵过程中产有机酸的乳酸菌和产乙醇的酵母菌的富集有关[10]。
3.4 微生物优势物种与理化指标间的互作关系
微生物群落的演替不仅受到生物物种间的相互作用,同时发酵底物理化指标的变化也会影响微生物菌群结构。Banerjee 等[20]认为,微生物共现性网络中,物种间显著的相关性可能代表了物种间的协助共生作用,或物种间具有共同的捕食者、负相关的底物竞争关系。本试验中,正相关普遍存在于相对丰度较低的微生物之间,比如芽孢杆菌、泛菌属,推测可能是这些物种在混贮发酵过程中被优势物种显著抑制从而具备正相关关系;一些乳酸菌和腐生型真菌与其他物种之间存在明显的负相关关系,推测这些物种在混贮发酵过程中改善了青贮饲料品质并抑制病原菌的富集。然而很少有学者同时研究青贮饲料中细菌、真菌群落的互作关系以及关键物种的作用。研究表明,在环境微生物群落中关键物种不一定是优势物种[18-19],有些优势物种与微生物群落演替和发酵品质改善没有明显的相关性。本研究中,节担菌属真菌在混贮发酵过程中一直保持较高的相对丰度(11.5%~95.9%),但其对于有机酸、乙醇的积累和木质纤维素的降解等未起到明显作用,反而降低了粗脂肪含量;此外,片球菌属和未分类的肠杆菌科可能促进了WSC转化为有机酸(LA、AA、BA),同时降低了pH值和镰孢菌属、曲霉属、泛菌属、肠杆菌属的相对丰度,但一般认为肠杆菌类产LA效率较低,实际生产中应该降低该物种的丰度[10]。本研究中,unclassified_f__Dipodascaceae抑制了镰孢菌属、曲霉属富集,与片球菌属相互促进,该结果与共现性网络图中的结果一致。综上所述,片球菌属、unclassified_f__Dipodascaceae是甘蓝尾菜和干水稻秸秆混贮发酵过程中改善青贮品质的关键物种。
4 结 论
与发酵前相比,甘蓝尾菜与干水稻秸秆混贮发酵后发酵品质明显改善,营养成分无明显改善,干物质含量被有效保存。贮存过程中细菌群落的多样性和丰富度显著下降,乳酸菌群和腐生型真菌作为优势物种显著富集,并有效抑制非理想菌群(尤其是需氧型和潜在致病微生物)的积累。此外,片球菌属、unclassified_f__Dipodascaceae是甘蓝尾菜和干水稻秸秆混贮发酵过程中改善青贮品质的关键物种。混贮发酵是资源化处理甘蓝尾菜与干水稻秸秆的有效方式。
