β-胡萝卜素的体内代谢及与维生素A的生物转化*
2022-02-25李若茗陈哲晖陈超阳杨艳玲崔一民
李若茗 董 慧 陈哲晖 魏 然 陈超阳 周 颖 杨艳玲 崔一民,4,*
1.北京大学第一医院药学部 (北京 100034)
2.北京大学药学院药事管理与临床药学系 (北京 100191)
3.北京大学第一医院儿科 (北京 100034)
4.北京大学临床药理研究所 (北京 100191)
β-胡萝卜素是类胡萝卜素的一种,也是人类饮食中维生素A的重要来源。关于β-胡萝卜素的推荐摄入量仍存在争议。一方面,一些研究认为较高的β-胡萝卜素水平可能降低慢性疾病的风险;另一方面,β-胡萝卜素蓄积也可能导致脏器损伤。β-胡萝卜素的代谢过程具有较大的个体差异,编码代谢酶的基因变异及疾病等多种因素可能导致β-胡萝卜素的病理性积累。本文综述了β-胡萝卜素代谢与生物转化的研究进展。
1 β-胡萝卜素
类胡萝卜素是在植物、真菌、藻类和细菌中发现的C40亲脂性色素[1]。自然界中有600余种不同类型的类胡萝卜素[2]。人类自身不能合成类胡萝卜素,需要通过食物或膳食补充剂摄取[3]。在人类血液样本中发现了30余种类胡萝卜素,其中番茄红素、叶黄素、玉米黄质、β-隐黄质和β-胡萝卜素含量最高[3]。
类胡萝卜素是膳食维生素A的重要来源。维生素A原指的是可在小肠和肝细胞内转化为维生素A的类胡萝卜素,其化学特征是含有未取代的β环和C11结构,如β-胡萝卜素。一项对8个发达国家(约120000名参与者)的研究结果表明,预先形成的维生素A占维生素A总摄入量的近65%,维生素A原仅占35%,其中β-胡萝卜素占86%,α-胡萝卜素占10%[4]。在发展中国家,膳食类胡萝卜素提供了约80%的每日维生素A摄入量[5]。
既往一些研究证明,类胡萝卜素有助于降低慢性疾病(如心血管疾病、某些类型的癌症和眼部疾病)的风险[6]。也有临床研究表明,健康人长期补充β-胡萝卜素对降低恶性肿瘤和心血管疾病的发病率没有显著的影响[7],甚至可能增加发病风险[8]。β-胡萝卜素的生物学特性可能取决于β-胡萝卜素的剂量、机体的生理状态和遗传背景之间复杂的相互作用。
2 β-胡萝卜素的体内过程
2.1 吸收类胡萝卜素如β-胡萝卜素有高度疏水的骨架,很难分散在消化道的体液环境中。在胆汁和胰酶的作用下,β-胡萝卜素可与脂质形成混合胶束,通过肠上皮细胞吸收。多种因素影响β-胡萝卜素的吸收,如共食脂肪的量[9]和共食脂肪的种类[10]。当在同时摄入脂肪的情况下,β-胡萝卜素和维生素A能很好地从肠腔吸收。β-胡萝卜素在肠细胞刷状缘主要在细胞膜上的胆固醇转运蛋白SR-BI和CD36的作用下转运进入细胞,也有部分通过被动扩散的形式吸收[11]。
2.2 分布类胡萝卜素的化学结构的不同导致分子间极性的差异,影响组织间的分布和脂蛋白间的分配[12]。由于类胡萝卜素的亲脂性,胡萝卜素在循环中与各种类型的脂蛋白一起运输,被纳入各种脂蛋白颗粒的疏水核心,如极低密度脂蛋白(very low density lipoproteins,VLDL)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)和乳糜微粒等。机体摄入类胡萝卜素后,最初以乳糜微粒和VLDL的形式存在于血浆;24~48h后,会出现在脂蛋白中,如LDL和HDL。大部分循环β-胡萝卜素和番茄红素(70%)存在LDL中,而大部分叶黄素或玉米黄质(50%)存在于HDL中。
2.3 代谢肠道是将β-胡萝卜素转化为维生素A的最重要部位。然而,体外研究表明,肝脏、脂肪、肺和肾脏都能够将β-胡萝卜素转化为类视黄醇[13],β-胡萝卜素的代谢途径见图1。β-胡萝卜素15,15'-单加氧酶(β-carotene 15,15'-monooxygenase,BCMO1)和β-胡萝卜素9',10'-双加氧酶(β-carotene 9'10'-dioxygenase,BCDO2)以中心或偏心裂解的方式对一部分吸收的β-胡萝卜素进行酶促转化[14]。
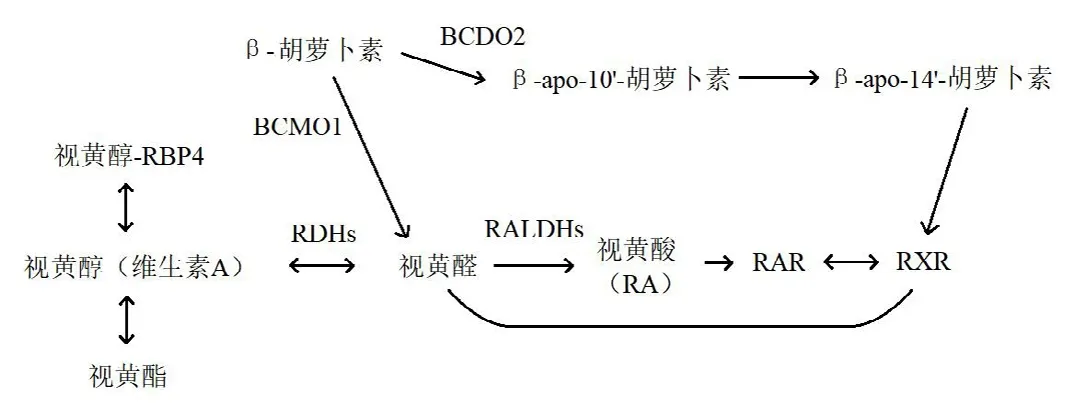
图1 β-胡萝卜素的代谢途径
BCMO1是一种可溶性胞质酶,在结肠的黏膜、肝脏、腺细胞及角质形成细胞中表达,空肠细胞中的活性最高[15]。β-胡萝卜素经BCMO1代谢释放视黄醛,可在视黄醛脱氢酶的作用下转化为视黄醇(维生素A),以脂肪酸酯的形式储存在细胞(主要是肝星状细胞)中。视黄醇可与血浆视黄醇结合蛋白可逆结合,将人体血清中的视黄醇浓度维持在2μmol/L左右。一部分视黄醛也通过视黄醛脱氢酶不可逆地氧化为视黄酸,与视黄酸受体和类视黄醇X受体结合。类视黄醇X受体可以作为异源二聚体与许多其他核受体相互作用并调节基因表达。另一部分经BCDO2偏心裂解的β-胡萝卜素,可生成β-apo-14'-胡萝卜素,也被认为可调节类视黄醇X受体的活性[16]。
有研究表明,肠道中吸收的膳食来源类胡萝卜素没有被BCMO1酶裂解,提示在日常的膳食条件下,BCMO1酶是饱和的[17]。经BCMO1酶代谢产生的视黄醇酯,与未经BCMO1酶代谢的类胡萝卜素以乳糜微粒的形式运输到肝脏,储存在肝星状细胞中。未被肝脏吸收的乳糜微粒中的视黄醇可被靶组织吸收,包括脂肪组织、脑、胰腺、心脏、肌肉、肺、生殖器官和骨髓[18-19]。

李若茗,女,1996年6月生,山西太原人。2019年中国药科大学临床药学专业本科毕业,现北京大学药学院药事管理与临床药学系临床药学专业型硕士研究生在读。

崔一民,教授、博士生导师。现任北京大学第一医院临床药理研究所所长、临床试验中心主任、药学部主任。任教育部高等学校药学类专业教学指导委员会副主任委员,国家药典委员会委员,国家食品药品监督管理总局仿制药质量和疗效一致性评价专家委员会委员,NMPA药品审评中心咨询专家,中国药理学会副秘书长,中国药理学会临床药理学专业委员会主任委员等。先后主持国家重点研发计划精准医学研究重点专项、国家重大新药创制-科技重大专项,以及多项国家级自然科学基金,发表SCI论文200余篇,发明专利和软件著作权30余项。获中国药学会科学技术一等奖、药明康德生命化学研究奖学者奖、吴阶平-保罗-杨森医学药学奖、中国药学发展奖创新药物突出成就奖等。
2.4 排泄β-胡萝卜素主要通过粪便排出(20%~60%),部分从尿液排除(10%~30%),视黄酸也可从呼吸中排出(10%)[20],在唾液、汗液或眼泪中的排泄情况尚不清楚。
3 β-胡萝卜素与维生素A的生物转化
已有多项研究发现,β-胡萝卜素与维生素A的转化率存在显著的个体差异,变异系数高达221%[21-24]。在接受6 mg的β-胡萝卜素后,转化成维生素A的平均转化系数为4.8∶1(以物质的量计)或9.1∶1(以重量计)[25]。低或差的应答者定义为在摄入单次高剂量的β-胡萝卜素后,血浆β-胡萝卜素水平变化不大的患者。约45%的西方人可以归类为低应答者[26],可出现β-胡萝卜素蓄积以及维生素A缺乏的表现。β-胡萝卜素的剂量、体内维生素A水平、编码代谢酶的基因变异以及体重指数等因素可能影响β-胡萝卜素的转化率。
3.1 β-胡萝卜素的剂量对生物转化的影响β-胡萝卜素转化为维生素A的效率随β-胡萝卜素剂量的增加而受到限制。研究发现,β-胡萝卜素剂量从20mg/d增加到40mg/d,健康志愿者β-胡萝卜素的血浆药物浓度-时间曲线下的面积(area under curve,AUC)增加了2倍,但维生素A的血浆AUC增加了36%,即随着膳食中β-胡萝卜素剂量的增加,β-胡萝卜素向维生素A的转化率降低。当β-胡萝卜素的剂量≤6mg时,β-胡萝卜素与维生素A的转化率约为2∶1 至9∶1,而当β-胡萝卜素剂量≥16.1mg时,该比值≥16∶1[27]。
3.2 体内维生素A水平对生物转化的影响研究发现视黄酸可通过负反馈机制将BCMO1的mRNA水平下调高达90%,因此,体内维生素A水平较高的个体,β-胡萝卜素的转化率可能降低。这种反馈调节可能涉及肠道上皮细胞特异转录因子[28]。体内维生素A水平较高时,细胞内升高的视黄酸浓度可诱导肠道上皮细胞特异转录因子基因表达,减少β-胡萝卜素的吸收,从而减少了维生素A的生成。
3.3 代谢酶的基因变异β-胡萝卜素代谢存在遗传变异性,编码β-胡萝卜素代谢的酶(如BCMO1和BCDO2)的基因变异可能导致β-胡萝卜素的转化不良表型。动物研究结果显示,BCMO1-/-小鼠在接受含有极少量维生素A的β-胡萝卜素饮食喂养后,血浆β-胡萝卜素浓度较野生型小鼠升高35倍,且BCMO1-/-小鼠肝脏、肺、睾丸、子宫等表达BCMO1的组织中的维生素A及视黄酯水平很低,甚至检测不到[29]。
国外案例报道1位BCMO1基因变异(p.T170M)的患者,血液β-胡萝卜素明显升高,高达14.8μmol/L(正常范围约0.9~3.7μmol/L),体外试验发现p.T170M突变可使BCMO1酶的活性降低约90%[26]。另有在健康志愿者中开展的研究表明,携带BCMO1p.A379V、p.R267S和p.A379S的变异的女性,肠道内β-胡萝卜素的转化率降低。p.R267S和p.A379V双突变体细胞的实验结果证实,BCMO1的体外催化活性降低了57%。细胞研究结果与与体内试验的结果一致,即携带p.R267S和p.A379V变异等位基因的女性将β-胡萝卜素转化为视黄酯的能力降低了69%[30]。β-胡萝卜素的转化不良表型患者常伴随高胡萝卜素血症。与野生型等位基因携带者相比,女性p.A379V和p.R267S+p.A379V等位基因携带者的血浆β-胡萝卜素浓度分别升高1.6倍(P<0.05)和2.4倍(P<0.05)。在汉族人群中,BCMO1基因rs11646692位点的基因多态性对血液β-胡萝卜素水平没有显著影响。然而,若每日蔬菜摄入量高于150g,rs11646692位点为GG的人群中血液β-胡萝卜素水平显著高于其他基因型[31]。上述研究结果提示,BCMO1基因在β-胡萝卜素转化中起到关键作用,BCMO1基因的遗传变异影响着β-胡萝卜素的转化效率,可能与高胡萝卜素血症的发生相关。另一参与β-胡萝卜素代谢的类胡萝卜素加氧酶BCDO2的基因多态性也影响着体内β-胡萝卜素的水平。在BCDO1-/-小鼠的肝线粒体中,检测到了明显的类胡萝卜素及其代谢物的积累,而在BCDO2野生型小鼠的肝线粒体中未检测到类胡萝卜素。
3.4 体重指数有研究得出体重指数与转化效率呈负相关[25]。身体脂肪较多的受试者,大部分的β-胡萝卜素可能被储存在脂肪中,而被储存的β-胡萝卜素转化为维生素A的能力较低[25]。
4 高胡萝卜素血症
4.1 高胡萝卜素血症的临床表现高胡萝卜素血症为血液中胡萝卜素水平升高导致的生化异常,患者皮肤黄橙色色素沉着[32-33],过量(β-胡萝卜素摄入超30mg/d)食用富含胡萝卜素的水果和蔬菜是常见的原因[34]。但类胡萝卜素摄入量与高胡萝卜素血症之间没有显著的相关性[35],说明相关代谢酶的遗传变异性也是高胡萝卜素血症发生发展的可能病因。
斯里兰卡的一项研究发现,在615名高类胡萝卜素饮食的儿童中,高胡萝卜素血症的患病率为2%[35]。高胡萝卜素血症的发病年龄在7个月至11岁之间,就诊时的中位年龄为13个月[36]。类胡萝卜素可沉积在角质层,体格检查时可见手掌、脚底、前额、鼻尖和鼻唇沟皮肤颜色变黄,但黄色色素不影响巩膜和黏膜,因此可与黄疸区分。实验室检查可见血清胡萝卜素水平升高,血清转氨酶和胆红素正常。若参与β-胡萝卜素生物转化的酶功能缺陷,可能并发维生素A缺乏。治疗的主要方法是减少饮食中类胡萝卜素的摄入,黄色色素沉积可随时间逐渐消退[37]。
4.2 β-胡萝卜素的剂量对生物转化的影响在成年哺乳动物中,BCMO1基因转录受过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors,PPARγ)的控制,PPARγ是成熟脂肪细胞中脂肪分化和脂肪生成的关键转录因子,源自β-胡萝卜素裂解的内源性视黄酸降低了PPARγ的表达,具有抑制脂肪生成的作用[38],故脂肪酸的调节代谢可能与β-胡萝卜素之间存在联系。组织学分析显示,与BCDO2+/+小鼠相比,BCDO2+/-和BCDO2-/-小鼠体内类胡萝卜素蓄积明显,甘油三酯含量显著增加,并出现肝脏脂肪变性。国内一项临床研究的结果显示,BCMO1基因的多态性可影响机体的血脂代谢,BCMO1基因位点rs7501331的CT和TT基因型是高LDL的危险因素[39]。因此,与代谢酶基因变异相关的高胡萝卜素血症可能影响脂肪酸的代谢。
β-胡萝卜素的病理性积累还可能诱导线粒体相关信号通路的氧化应激。参与β-胡萝卜素代谢的类胡萝卜素加氧酶BCDO2是一种线粒体蛋白,在保护组织免受类胡萝卜素诱导的线粒体功能障碍方面起着关键作用。在野生型小鼠(BCDO2+/+)中,类胡萝卜素被BCDO2分解代谢,避免在线粒体中积累。在突变小鼠(BCDO2-/-)中,类胡萝卜素在线粒体中积累,可损害线粒体呼吸链(复合物Ⅰ~Ⅳ),并以剂量依赖性方式诱导活性氧产生,导致氧化应激反应[40]。临床研究表明,高剂量补充β-胡萝卜素会伤害处于氧化应激相关疾病风险的个体,如增加吸烟者发生肺癌的风险[41]。若高胡萝卜素血症的患者携带BCDO2功能丧失的等位基因,可能导致细胞内类胡萝卜素积累,从而引起线粒体功能障碍,导致与氧化应激相关的疾病。
4.3 高胡萝卜素血症和其他疾病的相互作用甲状腺激素可促进胡萝卜素转化为维生素A,可能有助于维生素A的吸收[36]。与甲状腺功能正常对照组相比,甲状腺功能减退症患者血清中的β-胡萝卜素水平显著升高,而甲状腺功能亢进的患者血清β-胡萝卜素水平显著降低[42]。神经性厌食症患者也常合并高胡萝卜素血症。一项回顾性病例对照研究显示,在101名患有神经性厌食症的女性患者中,62%的患者合并有高胡萝卜素血症,与对照组相比,患者的血清β-胡萝卜素明显升高[43]。
5 结论与展望
β-胡萝卜素是人类饮食中维生素A的主要来源。近年来,已经确定了这组编码关键代谢酶的基因,包括类胡萝卜素转运蛋白和代谢酶。β-胡萝卜素代谢的关键酶基因的多态性影响着体内β-胡萝卜素的水平,相关基因变异可能导致高胡萝卜素血症的发生。在评估β-胡萝卜素的生理作用时,需考虑个体的遗传变异型。随着研究的深入,未来β-胡萝卜素代谢和生物转化的相关的研究结果有助于理解这种重要微量营养素的生化、生理和医学作用。
