电化学氧化水处理技术研究进展
2022-02-24周雨珺吉庆华胡承志曲久辉
周雨珺,吉庆华,胡承志,曲久辉,
(1. 中国科学院 生态环境研究中心;环境水质学国家重点实验室,北京 100085;2. 中国科学院大学,北京 100049;3. 清华大学 环境学院,北京 100084)
电化学水处理技术具有绿色、高效、易操作等优点,是推动水处理技术绿色发展,实现“碳中和”的重要途径。针对特征行业水质复杂,难以生化处理,以及消毒(包括饮用水、游泳池水、污水及医疗废水)、阻断疾病传播等要求,电化学氧化技术因其独特的优势而受到了越来越多的关注。如图1所示,在过去的15 a内,全世界范围内以电氧化为主题的期刊论文和专利发表数量不断上升,电氧化水处理技术受到广泛关注。电化学氧化技术作为一类重要的电化学水处理技术,具有无需外源添加药剂、反应条件温和、易于调节和自动化控制、使用方便等[1-2]优点,此外,还可耦合光催化、膜处理方法,实现高效处理,尤其适用于低浓度废水的深度净化处理[3],在污染物超低排放和资源化方面具有突出的优势。
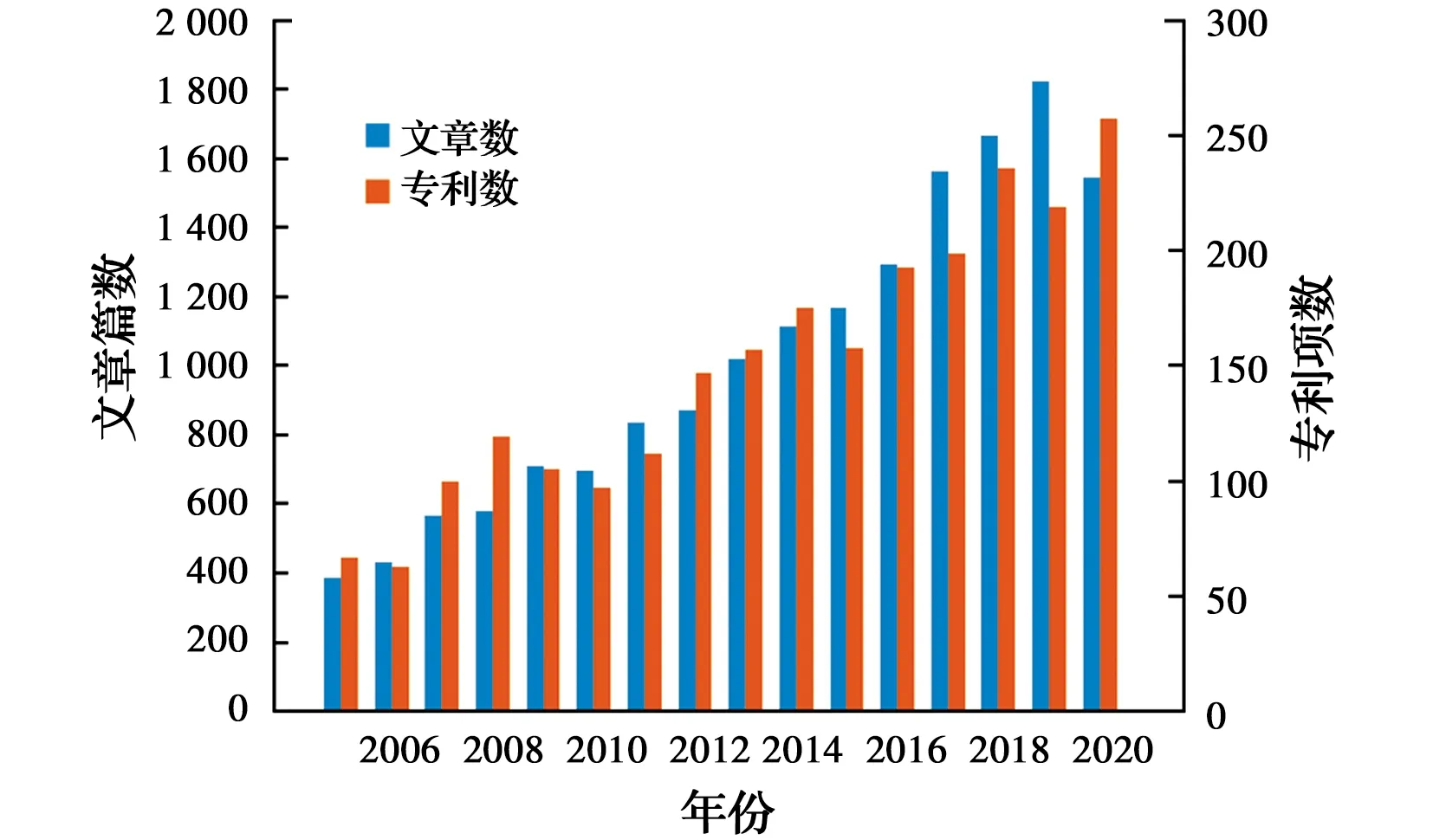
图1 2005—2020年电氧化水处理技术相关期刊论文发表量及专利申请数量
笔者根据不同的电氧化过程原理分类,综述不同电氧化反应的原理和过程,对电催化氧化的研究进展进行回顾和总结,对电氧化净水技术的反应器构型和体系进行梳理,并对电氧化技术的发展脉络和方向进行展望。
1 电化学直接氧化
电化学氧化水处理技术降解有机物的反应在阳极,根据其作用机理的不同,可分为直接氧化机理和间接氧化机理[1]。直接氧化过程是指有机污染物吸附在阳极表面,然后通过阳极电子转移过程,实现污染物的氧化去除[4],一般在高浓度时发生。常见的电氧化性能和污染物去除效果的评价指标如表1所示。而根据污染物降解程度的不同,发生在阳极表面的有机污染物氧化过程分为电化学转化(conversion)和电化学燃烧(combustion)[2]。电化学转化主要是将有毒物质转化为无毒物质或低毒物质,电化学燃烧可以使有机物完全矿化成CO2和H2O。在电化学直接氧化过程中,污染物直接在阳极失去电子而发生氧化,转化为无毒、低毒或易生物降解的物质,甚至达到完全矿化,实现了水质净化。电化学直接氧化对于处理含氰化物、含氮、含酚等有机废水有很好的污染物氧化降解效果。然而,直接电氧化存在两个问题,一是污染物从本体溶液向电极表面迁移是限速步骤,二是阳极表面钝化(passivation)对直接电氧化过程速率的限制作用[4]。

表1 常见的电氧化性能和污染物去除效果的评价指标
2 电化学间接氧化
间接氧化是指电极产生氧化剂,如通过在阳极表面产生活性中间产物(如·OH、·OCl、O3)或具有高氧化性的高价态金属氧化物(电化学媒介)来氧化降解水中有机污染物。间接氧化是阳极氧化的最主要形式,可以缓解直接氧化中由于大多数有机物与水的低混溶性和电极表面的污染而带来的有机物从本体溶液到阳极表面的低传质效率问题[5-6]。
2.1 阳极产生·OH的电催化氧化
2.1.1 基本原理与过程 间接氧化中羟基自由基·OH氧化能力强(标准电势为2.8 V),可没有选择性地氧化分解有机污染物直至完全矿化成CO2、H2O和无机离子,是一类最主要的活性物种。典型的电化学高级氧化(EAOP)包括在阳极表面产生异相·OH的阳极氧化(AO)以及进入液体介质中均相·OH引发的电芬顿(electro-Fenton,EF)、光电芬顿(photoelectro-Fenton,PEF)。
反应过程中产生的·OH在电极(M)表面发生化学吸附(MO)或/和物理吸附(M(·OH))。化学吸附是利用金属氧化物阳极(MO)晶格中的氧形成羟基自由基,化学吸附型·OH(MO)主要将难降解有机物转化为易生物降解物质;而物理吸附态的羟基自由基·OH(M(·OH))则可将有机污染物彻底矿化[7]。Comninellis[8]认为,H2O或OH-在阳极上放电产生物理吸附型的·OH,·OH与有机物发生电化学作用使其完全矿化或电化学转化作用变成小分子有机物。
M+H2O →M(·OH) + H++ e-
有机物+·OH→产物
影响电化学氧化对有机污染物降解效果的因素有很多,包括电极材料、pH值、电解质、电流密度、有机污染物的种类等。
2.1.2 常见的阳极电极材料 阳极材料种类对·OH的产生量及类型起决定性的作用,同时影响到电极的析氧过电位。根据其催化性能可将阳极材料分为活性电极和非活性电极。析氧过电位较低的电极材料在电解过程中容易发生析氧副反应,这类电极被称为活性电极。反之,析氧过电位高的电极材料析氧副反应较少,称之为非活性电极[9]。常见的阳极材料见表2。
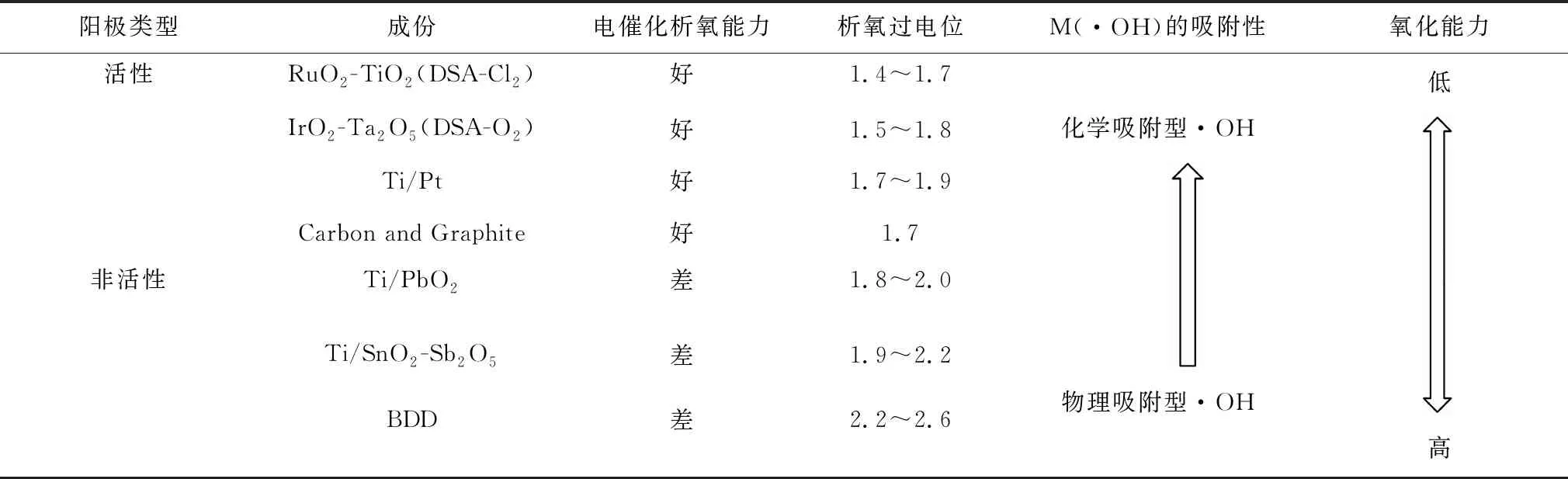
表2 常见的活性和非活性阳极材料及其分类[9]
常见的活性电极包括DSA电极(Dimensionally stable anode,形稳电极),又称为钛基涂层电极,它是Ru-、Ti-类钛基金属氧化类电极(如Ti/RuO2-IrO2、Ti/RuO2-TiO2)、铂电极和石墨电极等。非活性电极主要包括Pb-、Sn-、Sb-类金属氧化性电极,如SnO2、PbO2、Ti4O7以及掺硼金刚石薄膜电极(boron-doped-diamond,BDD)[10]。活性电极表面易产生化学吸附型·OH,极板(M)与电解过程中产生的·OH发生相互作用形成超氧化物[M(·OH) → MO + H++ e-],在对有机污染物的电解过程中,M/MO作为反应媒介,有选择性地将有机污染物转化成易生物降解的物质(MO + R → M + RO)。在非活性电极表面能产生更多物理吸附型羟基自由基M(·OH),它能均匀分散在整个水体内,导致多种有机污染物发生电化学反应,将其彻底矿化[11]。非活性电极析氧过电位高,产生的·OH多,电催化氧化活性更大,而且材料成本较低,是应用最多的一类电极材料[10]。
RuO2是应用最多的活性阳极材料成分,它的催化活性高,但长期在酸性溶液中电解会因腐蚀而导致稳定性变差[12]。近年来,学者们研究了许多方法,包括添加第2种金属组分如Sb2O4、IrO2或TiO2等来增加RuO2基电极材料的稳定性。研发出的新活性电极有Ti/RuO2-Sb2O4[13]、Ti/RuO2-TiO2[12,14]、Ti/RuO2-IrO2[15]、Ti/RuO2-IrO2[16]、Ti/RuO2Sb2O4-TiO2[17]、mZVI-RuO2-IrO2[18]。
SnO2和PbO2则是研究较多的非活性阳极材料,因为有高催化活性而且成本低廉,但寿命较短,催化剂成分主要是有毒的Pb2+,会溶解到溶液中。近年来,许多研究者通过改变合成方法,掺杂或插层,甚至用新的基体来提高其稳定性和活性[10]。例如,合成的Sb-SnO2(SiC/Sb-SnO2)[13]、SnO2-SbCe、SnO2-Sb-Ta、SnO2-Sb-Bi和SnO2-Sb-Gd[19]、Ti/SnO2-Sb[20]、TiO2-NTs/SnO2-Sb/CA(NT为纳米管、CA碳气凝胶)[21]、Sb-SnO2/IrTaOx/TiO2[22]、C-PbO2[21]、2.5D PbO2/Sb-SnO2[23]、Ti4O7[24]。
BDD电极具有超强的硬度、抗腐蚀性、高热传导性、导电性,尤其在强酸性和强碱性电解质中性质稳定。此外,还具有更高的电势窗口(2.5 V),有机污染物可在电极表面发生直接氧化作用[25],产生更多的·OH、过氧化物、O3等强氧化剂,且产生的·OH为物理吸附型,降解污染物更有效[26]。
不同的电极材料对有机物的降解效果表现出较大差别。例如,Martínez-Huitle等[27]利用BDD电极处理氯醌酸废水时,溶液COD去除率在6.4 h内可达100%,而利用PbO2电极时,处理11 h时COD去除率为80%。而在相同的反应参数条件下,利用活性电极DSA/IrO2,COD去除率在15 h内仅为50%。Zhu等[28]利用BDD电极处理硝基苯废水的实验中,发现TOC去除率在9.3 h内可达90%,而利用PbO2电极作为阳极时,TOC去除率在电解25 h后为80%。Panizza等[29]考察了在2-萘酚的降解中不同电极材料的降解效率影响。研究发现,使用DSA/Ti-Ru-Sn作为阳极时,2-萘酚在24 h内的去除率为10%左右,而利用PbO2和BDD电极作为阳极时,2-萘酚几乎完全去除。
2.1.3 主要影响因素 电化学法处理废水的先决条件是废水必须有足够的电导率,因此,对某些废水常要投加电解质。电解质种类和浓度在很大程度上影响到电解过程中所产生氧化剂的种类[30]和数量。常见的电解质为氯化物或者硫酸盐溶液[31]。Rabaaoui等[32]发现,在对邻硝基苯酚的降解实验中,利用Na2SO4作为溶液电解质时,污染物的去除率最高。González等[33]的处理抗生素废水实验中,以甲氧苄氨嘧啶为目标污染物,当电解质Na2SO4浓度调整为70 g/L时获得最优的污染物去除效率。
电流密度的大小会影响氧化剂的产量,从而影响直接电化学反应速率[31]。通常而言,在污染物向阳极扩散不受传质作用所限的低电流密度条件下发生电解反应时,污染物的降解速率和电流效率与电流密度呈正相关。例如,在4-氯苯酚的电氧化中,以BDD作为工作阳极,当施加的电流密度从20 mA/cm2提升为60 mA/cm2时,COD的去除率明显上升[34]。当电解反应在高电流密度下运行时,反应过程由传质控制,随着电流密度的继续增加,析氧副反应不断增加,导致电流效率和污染物去除率变低。
Ammar等[35]发现,在以0.05 mol/L Na2SO4作为电解质、电流强度为100 mA时,采用BDD电极降解靛蓝胭脂红废水的实验中,靛蓝胭脂红染料溶液在pH=10.0,电解120 min时的脱色率比在pH=3.0、电解270 min时更高,降解速率更快。这是由于碱性介质中的电活性物质更容易被氧化。但是,也有研究发现,在利用BDD为阳极对乙酰氨基酚电化学氧化中,pH值2~12的范围内,乙酰氨基酚均可以被高效地降解去除,污染物的去除效率不受溶液pH值的影响[36]。pH值的影响可能与污染物种类和实验条件有关。
2.2 阳极产生活性氯的电催化氧化
2.2.1 基本过程与原理 间接电化学氧化的一个典型例子是处理含氯有机废水时电极表面除产生·OH外,还会产生活性氯物种或含氯氧化剂(·Cl、ClO-、Cl2)[37]。
Cl-→·Cl+e-
(1)
2Cl-→Cl2+2e-
(2)
同时还可能发生反应
Cl2+·OH→HClO+Cl-
(3)
Cl2+2H2O→HClO+H3O++Cl-(酸性介质)
(4)
Cl2+2OH-→ClO-+H2O+Cl-(碱性介质)
(5)
HClO+H2O→H3O++ClO-
(6)

与上述含氯氧化剂不同,ClO2具有很强的氧化性而且产生有害的有机氯副产物少,因此,被广泛应用于饮用水、表面水体以及构筑物表面的消毒[38]。ClO2通常采用化学方法合成,即用氯化物与次氯酸盐/Cl2或与HCl反应生成,或者在强酸性介质中用氯酸盐和H2O2反应生成。
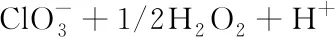
(7)
而电化学方法可有效制备氯酸盐和H2O2,因此,这为完全用电化学法制备ClO2提供了可能性。在工业上,主要采用电化学法在高温(600 ℃)和酸性条件下氧化高浓度NaCl卤水(300 g/L),当在卤水中添加重铬酸盐时,产率可达到90%以上。操作条件为电解池电压3 V,电流密度1 500~4 000 A/m2,单位能耗大约为5 kWh/kg氯酸盐。工业生产流程较为复杂,涉及几个电解和化学反应[38]。H2O2虽然可在阳极表面通过水的氧化产生(2H2O→H2O2+2H++2e-),但并不是最有效途径。最有效的途径是O2在阴极表面还原产生H2O2(O2(aq)+2H++2e-→H2O2),为获得高产率(接近100%),可以采用以下方法:1)增加具有催化阴极表面[39];2)增压提高氧的溶解度,提高传质效率[40];3)使用射流曝气提高气液接触,降低能耗[41];4)通过使用穿透式阴极改进反应器设计,并通过采用微流策略使欧姆内阻最小化[42-43]。
2.2.2 电极材料对活性氯产生的影响 Kraft等[44]对不同电极材料的活性氯产率性能进行了研究和归纳,相比于金属铂、掺硼金刚石、石墨电极,金属氧化性电极能获得更高的产活性氯瞬间电流效率。而在金属电极中,包括Ru、Ir基电极、铂电极、石墨电极在内的活性电极产氯性能明显优于非活性电极(PbO2、SnO2、BDD电极等)[25,7]。因此,对于含氯较高的废水,采用活性电极对有机物有更好的氧化降解效果。
2.3 媒介电化学氧化
2.3.1 基本原理与过程 媒介电化学氧化(Mediated Electrochemical Oxidation,MEO)是利用可逆氧化还原电对(媒介)氧化降解有机污染物的过程[1]。在该过程中,氧化还原物质被氧化成高价态,实现污染物氧化降解的同时,自身被还原成原来的价态。这是一个可逆的反应过程,氧化还原物质在电解过程中可化学再生和循环使用。在媒介电化学氧化过程中,氧化还原物质作为电极和有机物之间电子转移的介质,避免了有机物与阳极材料表面的直接电子交换,防止电极污染[47-48]。在处理实际废水时,可以通过投加氧化还原物质来强化间接氧化过程,提升污染物的去除效率。
2.3.2 常见的金属氧化还原对 在媒介电化学氧化过程中,常见的氧化还原物质有金属氧化物BaO2、CuO、NiO、MnO2,金属氧化还原电对Ce(Ⅳ/Ⅲ)、Co(Ⅲ/Ⅱ)、Ag(Ⅱ/Ⅰ)、Fe(Ⅲ/Ⅱ)、Mn(Ⅲ/Ⅱ)等。
从发展历程来看,Ag(Ⅱ)作为介质最早被用于处理核废料废水中的放射性物质和有毒有机物,之后被大量用于处理煤油、尿素、乙二醇、苯等有机物[48-49]。对于破坏非卤代有机物,Ag(Ⅱ)是一种很强的氧化剂,然而处理卤代有机物时,在氧化过程中生成的卤素离子易与Ag(Ⅱ)反应生成沉淀,阻碍反应的进行,Fe(Ⅲ)和Co(Ⅲ)作为强氧化剂则可以避免这一问题。
Sequeira等[50]研究了利用Co(Ⅲ)和Ag(Ⅱ)作为媒介对异丙醇的氧化降解效果,发现Co(Ⅲ)和Ag(Ⅱ)主导的媒介电化学氧化可以在室温下将酸性(6 mol/L硝酸)的异丙醇氧化为二氧化碳和乙酸,Co(Ⅲ)作为媒介的电化学氧化效果最优。Ag(Ⅱ)与支撑电解质的副反应会抑制氧化作用,而Co(Ⅲ)的存在提升了异丙醇氧化反应的动力学。研究发现,提高电流密度、降低电解液初始pH值、交替施加电流和适当的阴阳极隔膜(陶瓷隔膜)的条件下,异丙醇氧化成乙酸的效率更高。此外,提升温度和延长反应时间可以促进乙酸的进一步氧化。
Matheswaran等[6]利用Ce(Ⅳ)作为媒介研究了苯酚的降解矿化,发现投加的金属离子浓度、酸性电解质浓度、温度、反应器中流速和电流密度等多种条件会直接影响金属离子Ce的氧化速率。实验优化了苯酚处理的条件,在1 mol/L Ce(Ⅲ)、3 mol/L硝酸、90 ℃的最优条件下可以高效降解10 000 mg/L的苯酚,矿化率可达93%(以CO2计)。Ce(Ⅳ)氧化剂被证实具有很高的稳定性,在电化学氧化过程中不会有沉淀发生[51-52]。
2.4 电Fenton与光电Fenton
电催化氧化的一个典型技术是电Fenton反应[2]。经典的Fenton反应是在酸性条件下(pH=2.8~3.0)H2O2被Fe2+活化后生成具有强氧化能力的羟基自由基·OH,并引发生成更多的其他活性氧物质,从而实现有机物的降解,这个过程是一个复杂的均相水溶液反应。经典Fenton反应在实际应用中具有如下局限:需要pH值为3左右的强酸性环境、会产生大量的铁泥、H2O2利用率低、Fe3+还原困难、需要投加大量亚铁。而电Fenton的反应中,H2O2通过O2在电解池阴极表面通过两电子还原反应产生,然后被溶液中存在的Fe2+所激活,产生高氧化活性的·OH,Fe2+被氧化为Fe3+,·OH可有效氧化有机污染物。电Fenton有多种形式,包括铁阳极产生Fe2+,阴极产生H2O2,进行Fenton反应;阴极产生H2O2,Fe2+由外源投加;阳极产生Fe2+,外源投加H2O2;Fe2+和H2O2都由外部投加,Fe2+在加入后氧化成Fe3+,在阴极上连续再生,无需再投入等[2]。
电芬顿技术的优点在于:H2O2可由电解法原位生成,无需外源添加,避免了该危化品贮存与运输风险;Fe2+可由阴极再生,铁盐加入量少,铁泥产生量也有所减少。存在的缺点:1)电流效率低,H2O2产率不高;2)不能充分矿化有机物,产生的中间产物可能毒性更强;3)由电极原位产生Fe2+的量有限,常需外源添加Fe2+,因此,仍有铁泥需要处理;4)更适合处理酸性废水,对于中碱性废水仍需调酸,增加了处理成本[25]。
针对上述存在的问题,研究者除研发氧气接触面积大且对H2O2生成有催化作用的新型阴极材料外[10],还研发了光助电化学氧化技术:H2O2/Fe2+/UV系统的光电芬顿(Photoelectro-Fenton,PEF)和TiO2/UV系统的异相TiO2光电催化(photoelectrocatalysis)[53]。PEF是指在电芬顿的基础上辅以UV辐射而强化氧化降解作用[25]。其原理为UV和Fe2+都可催化H2O2分解产生·OH,且二者对H2O2催化分解生成·OH存在协同效应。因为铁的某些羟基络合物(pH值为3~5时,Fe3+以Fe(OH)2+形式存在)有较好的吸光性能,可发生光敏化反应生成更多·OH所致。与此同时,其能加强Fe3+的还原,使Fe2+再生。这样有助于维持Fe2+浓度而保证Fenton反应不断进行,从而降低Fe2+用量,保持较高的H2O2利用率[54]。
Fe(OH)2++hv→Fe2++·OH
近年来,很多研究着眼于功能性电极材料的开发,以提升用于电芬顿反应的H2O2产率,从而提升电Fenton反应效率。Zhou等[55]通过对石墨毡的缺陷位点和含氧官能团调控,将H2O2产率提高了5倍,利用原位电芬顿实现了水中污染物的高效去除。Liang等[56]通过构建双金属MOFs促进电子转移,降低了H2O2生成能垒,进而将水中环丙沙星的去除速率提升了7.5倍以上。已有许多文献对EF和PEF的研究进展进行了综述,笔者不重点介绍光电Fenton反应,重点就光电催化氧化的研究进展进行综述。
2.5 光电催化氧化
光(助)电催化氧化即在光照条件下激化半导体材料产生具有氧化性空穴,在电场作用下强化这种光生电子和空穴的过程。通常而言,电极材料为需要具有光响应的光催化材料。
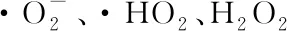
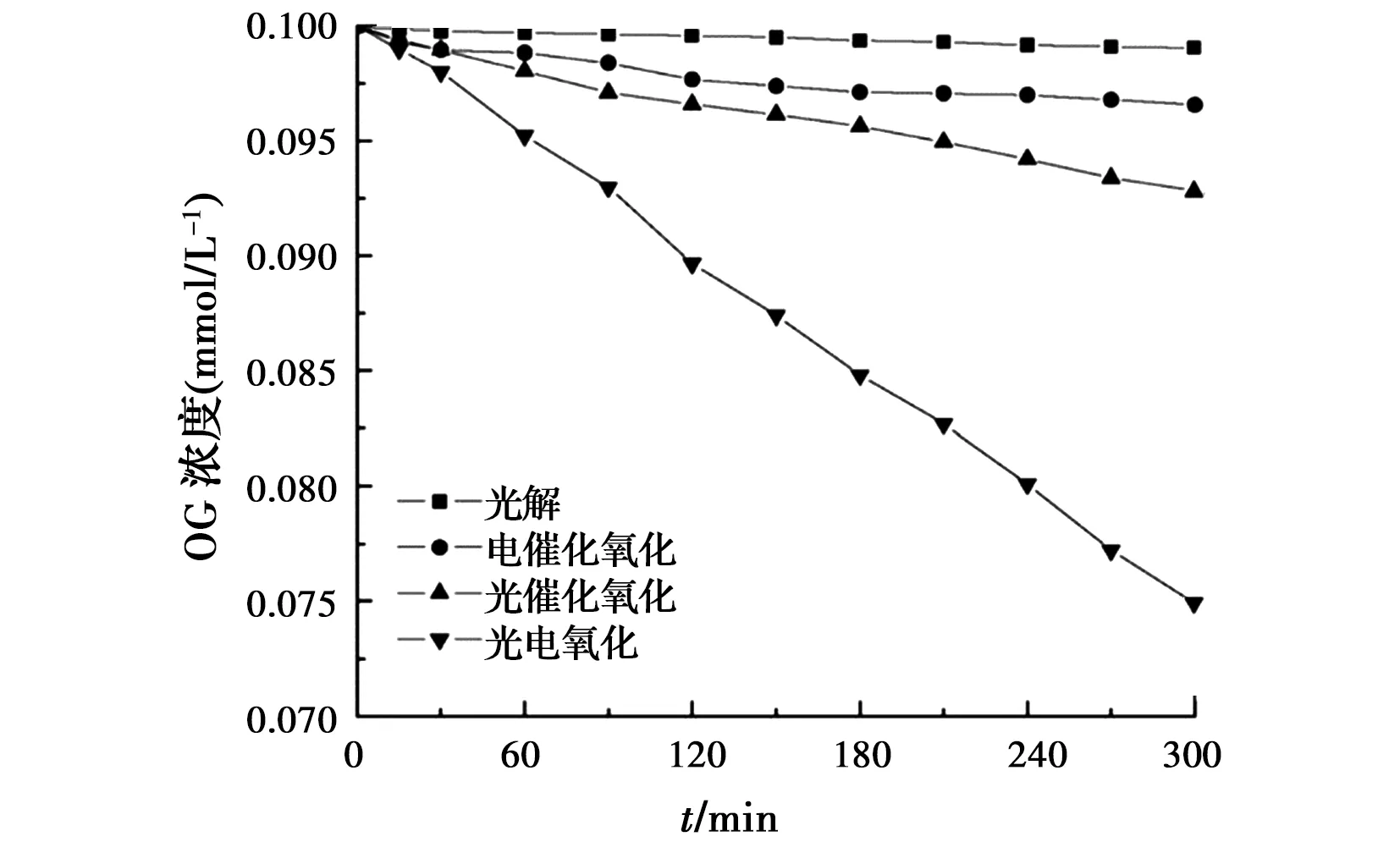
图2 光解、电催化氧化、光催化氧化和光电氧化对染料浓度降解的影响[54]
2.5.2 电极材料的影响 Ti系和Bi系电极材料是光电氧化中应用最多的电极材料。最典型的光阳极为包覆TiO2的Ti电极[58],或者含RuTi氧化物的Ti阳极[59]。前者在低电流密度下是稳定的,因此,在恒电位条件下常用于三电极反应器中,而后者是DSA型电极材料,在高电流密度下,超高的稳定性使其可用在两电极反应器中。Carneiro等[60]证实,用50 mL含0.01 mol/L Na2SO4、pH值为12.0和0.05 mmol/L活性蓝4的溶液填充三电极的阳极室,阳极采用10 cm2的Ti/TiO2,施加1 V偏电压(vs Ag/AgCl)时会产生很强的氧化剂。电化学氧化处理1 h后,可得到20%的脱色率,但当用450 W的UV光对阳极照射时(入射强度为50 mW/cm2),可获得高达100%的脱色率,但TOC去除率只有37%,这说明光电催化氧化产生了较难用空穴或·OH完全氧化的中间产物。
采用Ti/Ru0.3Ti0.7O2阳极可处理高浓度的染料废水,因为对该阳极施加高电流密度仍能保持很好的稳定性。例如,Pelegrini等[61]在光化学反应器中配置电化学装置(Ti/Ru0.3Ti0.7O2阳极作工作电极、Ti网作阴极、Ag/AgCl作参比电极),电压恒定1.8 V,平均电流23 mA,若直接将pH值为11的30 mg/L活性蓝19染料废水置于500W UV辐射下(仅光解)反应2 h,脱色率仅为15%,TOC去除率为7.2%。若同时在5 cm2的Ti/Ru0.3Ti0.7O2阳极上施加1.8 V电压(vs. Ag/AgCl)(光电协同),则反应2 h脱色率可达95%,TOC去除率为52%。而不采用光照仅为电化学氧化,脱色率也只有35%,TOC去除率为9.6%。光电存在的这种协同效应与在RuO2表面H2O放电产生·OH (M+H2O →M(·OH)+H++e-)和TiO2表面因光生空穴通过反应式hVB++H2O→·OH+H+同时也产生了·OH有关。
2.5.3 影响光电催化氧化的因素 除了用于反应的电极材料种类和电解池构型,pH值和电解质对光电催化氧化有很大的影响。Zanoni等[57]和Carneiro等[58]发现,支持电解质溶液对偶氮染料活性橙16有明显影响并与溶液的pH值也相关。该实验是采用UV光照Ti/TiO2三电极系统,偶氮染料活性橙16浓度为0.04~0.05 mmol/L,支持电解质为0.025~0.5 mol/L NaCl或Na2SO4,pH值变化幅度为2~12,在阳极上施加偏电压1.0 V(vs SCE)。研究发现,在所有的处理中,反应大约20 min可完全脱色,但对氯化物电解质溶液,在pH<6时降解更快,而对硫酸盐电解质溶液,pH>10时降解最快。NaCl在酸性介质中展现出的优势归因于在光阳极所产生的空穴能氧化Cl-产生活性氯物种(Cl2、·ClO-、·HClO),可能还有其他自由基,如·Cl和·Cl2,因此,比Na2SO4作为电解质的体系产生的异相·OH对有机物氧化速率更快。而碱性介质可抑制含氯氧化剂的产生,降低了对有机污染物的降解能力。对0.04 mmol/L甲基橙光催化3 h后,在pH值为4.0的0.5 mol/L NaCl溶液和pH值为12.0的0.5 mol/L Na2SO4溶液中可分别获得62%和56%的矿化率。
3 电化学反应器
3.1 反应器构型
电化学氧化水处理过程涉及污染物的传质(水体体相→电极)、吸附(吸附到电极活性位点)和电子转移(吸附的污染物电极)三大步骤[65]。过去的研究主要集中在电极材料以及反应机理与污染物降解过程等方面,较少涉及电极形状及反应器构型,然而这两者会直接影响传质和电子转移[66],因此,电极形状和反应器构型十分重要。
3.1.1 浸没式电化学反应器 依据待处理水相对于固定式电极的运动方式或流态,可分为全混式(mixed model)和推流式(plug flow model)两种主要流态[11]。相对应的反应器称之为全混式连续搅拌反应池(mixed tank cell或CSTR),在许多文献中也称为平板电极浸没式反应器或流过式反应器(flow-by),以及推流反应池或穿透式反应器(flow-through cell或flow-pass cell)。浸没式电化学反应器固定电极浸没在盛有待处理水的容器中,两个极板之间的空间为过水通道。为防止电极表面的浓差极化,池内常采用机械搅拌方式(如实验室采用磁力搅拌、机械搅拌、泵混合搅拌),加速目标污染物向电极表面扩散,电化学反应发生在极板表面(图3)。

图3 典型的平板电极浸没式反应器及过水通道示意图[67]
在常规浸没式反应器中,由于水中污染物向电极表面移动主要靠自由扩散(diffusion),因此传质高度受限。该反应器传质效率和电流效率低,当要求出水中污染物浓度超低排放时,采用这种反应器难以实现[68]。
3.1.2 穿透式电化学(flow-through)反应器 穿透式电化学反应器则是采用多孔材料作为电极,两电极之间用介电材料隔开,形成“三明治”结构[69-70](图4),含污染物废水穿过电极内部孔隙,使污染物得以分离或降解。与传统浸没式反应器相比,它有明显优点:1)极板间距极小。由于不作为过水通道,两电极之间只用很薄的绝缘介电隔膜隔开,使得反应过程中两极板间的电阻变小,因此,废水中有机污染物可在低电压或者低电导率(不需外加电解质)情况下发生电化学反应。而在使用常规电化学反应器过程中,当溶液的导电性较差时,为了获得一个合理有效的槽电压,通常会向反应体系内加入较多电解质,无疑会增加运行成本,且可能产生二次污染。另一方面,极板间距极小还可在单位体积内高密度布置电极单元,增加处理效率[71-72]。2)传质效率和电子转移效率高。多孔电极有高的空隙率和大孔隙,电极材料的高孔隙率有利于介质流动,大孔结构可有效提高电极面积,水被强制穿过电极,因而与吸附位点接触机会大幅提高,传质率高,电子转移效率也高,因此,有很高的电流效率和污染物降解率。3)可快速完成电化学反应过程,降低能耗损失,可实现连续运行反应。此外,极小的极板间距可布置高度密集的电极板,在单位空间内串联更多单元反应池,使处理效能得到进一步提升。
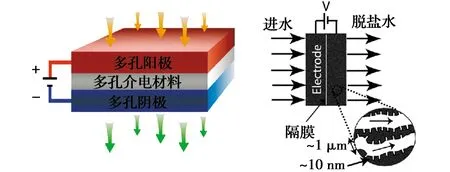
图4 穿透式电极反应器示意图[69]
Dos Santos等[68]比较了传统浸没式电极反应器和穿透式电极反应器电氧化降解有机污染物的效果,明显看出后者传质效率提高3倍以上,污染物去除率提高2~3倍。Liu等[73]用石墨烯基碳纳米管作阳极,利用穿透式反应器电化学氧化亚铁氰化物(Fe(CN)64-),相比于传统浸没式反应器,传质效率提高15倍,用该反应器处理四环素、酚及草酸,去除率高达93%。Liu等[65]用碳纳米管穿透式电极反应器氧化去除水中染料时,发现其传质效率是传统浸没式电极的6倍,这种强制对流促进的高传质效率是获得高电流效率和有机污染物高去除率的最主要原因。
目前,应用于电氧化水处理技术的穿透式电极反应器多数为过滤式。Vecitis等[74]设计了一种穿透式电极反应装置用于有机染料电化学氧化(图5)。采用多孔的不锈钢平板作阴极,中间开有圆孔的硅橡胶垫圈作为介电隔膜,金属Ti环作为阳极环与负载多壁碳纳米管膜(MWNT)的聚四氟乙烯(PTFE)紧贴构成阳极。研究发现,当采用的MWNT约为41 μm,水力持留时间≤1.2 s时,施加2 V电压可使单次进水中有机染料的98%得到氧化。

图5 一种电化学氧化处理有机染料废水的穿透式电极反应器[74]
Gao等[75]在此基础上基于碳纳米管膜堆叠的“三明治”式进一步研发了一种过滤式反应器(图6),通过电Fenton反应实现污染物的降解,同时可实现Fe2+再生。实验以草酸和POPs(三氟乙酸TFA和三氯乙酸TCA)为目标污染物,发现这种反应器构型下污染物通过电Fenton降解的效果是单独加电或仅靠Fenton反应效率之和的4倍,说明利用这种穿透式构型实现的电Fenton反应具有显著的协同效应。
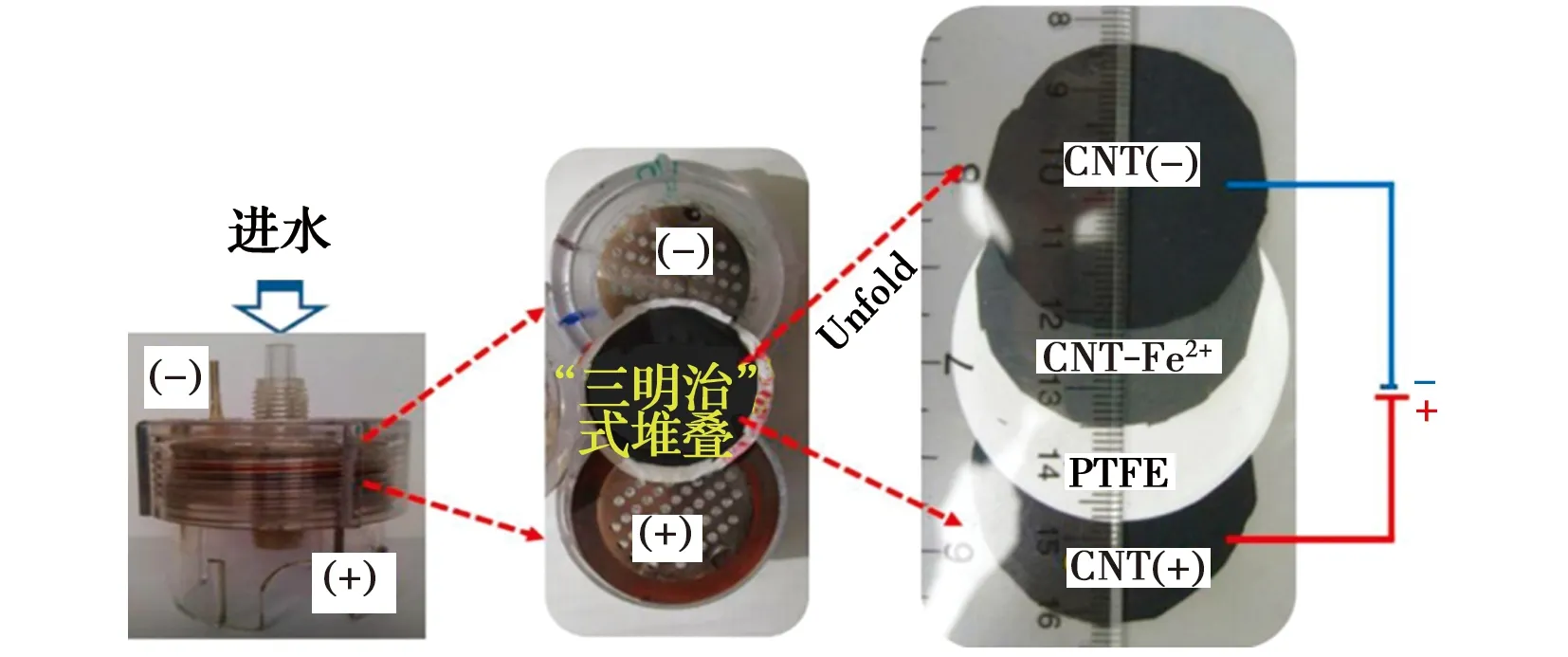
图6 “三明治”式电芬顿系统中发生的电化学反应[75]
Nath等[37]采用不锈钢网和石墨片作为阴阳极,尼龙网作为介电隔膜构建了一个3层结构的穿透电极反应器,利用该装置处理卤水产生的活性氯(Cl2、·HClO等)作为消毒剂获得较好效果。电极间距不足100 μm,有利于提高电流效率,采用该装置处理0.5 mol/L卤水可获得ClO-,电流效率高于60%。当施加1 V直流电时,单次穿透操作就可从低至0.004 mol/L氯离子的水中产生足以满足消毒的Cl2量。其电化学反应器装置结构及工艺如图7所示。
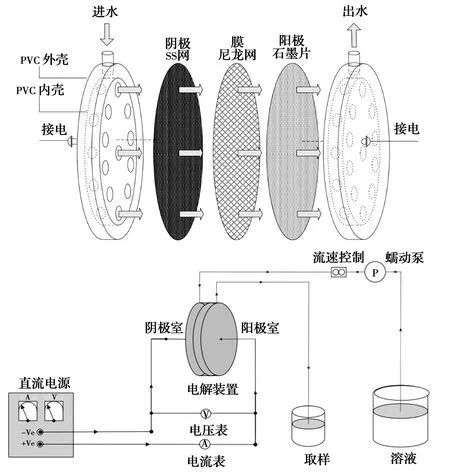
图7 一种用于电催化氧化产活性氯的穿透式电极反应器结构及工艺路线图[37]
3.2 供电方式
电催化氧化反应的供电方式主要有直流供电和脉冲供电[76]。在电催化氧化过程中,电流大小(密度)是直接影响电化学氧化效率和能耗的关键参数。目前以直流供电方式为主,大量的研究侧重于在电催化氧化降解污染物过程中对电流密度的调控和参数优化。而随着三维电极的开发和应用,脉冲供电方式也逐渐得到了更多的关注和研究。
袁玉南等[78]对比了脉冲和直流通电两种供电方式对于氨氮的电化学氧化解效果。实验发现,相较于传统的直流供电方式,脉冲电流下的氨氮氧化速率更快,在最优的操作参数下,240 min后脉冲电流和直流电下氨氮去除率分别为85.01%、73.22%,脉冲供电处理的氨氮去除率提升了11.79%,电能能耗可节约26.20%,每处理1 t氨氮,脉冲供电的氯离子外加添加量相比直流电处理减少了13.92%。此外,在低浓度氨氮的处理中,脉冲电流下的氧化速率更快,优势更为突出,而在高浓度氨氮废水(C>180 mg/L)的处理中,脉冲电流优势则不明显。
脉冲供电模式下,脉冲参数会影响电化学参数,对脉冲电流密度、脉冲频率、脉冲电压、占空比等参数的优化和调控可以有效提升污染物的降解效率和降低能耗。Mu’Azu等[79]在利用脉冲供电方式对苯酚降解的实验中,探讨并优化了电流密度、占空比、初始苯酚浓度等因素对苯酚降解和矿化效率的影响,研究发现,最优条件下(电流密度15 mA/cm2、占空比90%、初始苯酚浓度500 mg/L),苯酚和TOC的去除率分别为59.41%、33.08%,能耗分别为111、205 kWh/kg。
4 电化学氧化技术在水处理中的应用
电化学氧化技术自1970年被开发以来[48],得到了大量的研究和关注,电化学氧化工艺水质适用范围广,通常在废水处理过程中的尾端深度净化,以达到污染物超低排放的净水要求。除了强化水中污染物的去除,利用电催化氧化技术从废水中回收资源,扩大水处理规模,实现资源化、能源化和工程化也逐渐得到了很多关注。例如,Sergienko等[80]利用含MnxOy涂层的石墨毡电极,实现了废水中硫化物的氧化去除以及高效、选择性的硫回收。此外,电催化氧化技术可以将金属螯合物氧化成自由的金属离子,再通过浓缩或还原等过程实现废水中金属的回收[81]。面向实际废水的净水要求,电催化氧化技术也逐渐扩大化和规模化,得到了很好的工程应用。Huang等[82]以Ti/PbO2作为阳极、Ti板为阴极,开发了有效容积2.8 m3的反应装置,实现了废水中COD的氧化去除、脱色以及水质消毒。该装置千克COD的工业能耗为43.5 kWh,电流效率为32.8%,操作费用为每吨0.44美元,平均电价仅为0.11 kWh。同时,商品化的模块式电氧化技术设备也不断推广应用,例如,徐州工业园污水处理厂的末端配备了6套EP-凯森电催化氧化设备进行废水的深度处理(2 000 m3/d),单个电氧化模块处理能力可达15~20 m3/h,自2017年7月电氧化模块投入调试使用至今,电耗<5 kWh/m3,出水水质可满足废水一级A的排放标准。未来电催化氧化技术进一步工程化的关键在于提升处理效率以及降低操作费用。
5 总结与展望
近年来,随着对环境水污染的重视以及材料科学与电化学的不断发展,电氧化水处理技术的研究日趋深入。从传统的金属电极到新型功能性电极材料的开发、电极材料的微界面调控、从单一的电氧化过程到光助电化学以及多种反应过程的耦合联用、从废水中污染物的去除到实现废水资源化与同步能源化,电氧化水处理技术的研究取得了长足的进步。此外,电氧化技术逐渐融合膜分离和生物处理等其他方法,形成绿色、高效的净水工艺,提高能源利用效率,有助于实现“碳中和”的社会建设目标。
电氧化水处理技术的发展也存在一些瓶颈与挑战。提升传质效果是电氧化水处理技术效率的核心,而基于强化传质效率提出的穿透式电极反应器在电化学氧化水处理上的应用仅10 a左右,历史较短,利用穿透式构型可进一步促进阳极电化学氧化处理有机污染物获得更高的效率,尤其是搭建较大规模的穿透式反应器采用(光)电化学氧化连续处理更大体量的废水仍有很大的研究空间;为满足实际工程应用而制备廉价高效的电极材料仍有待研究。
综合相关研究与应用的态势,笔者认为电氧化水处理技术在未来一段时间内的研究方向将主要聚焦于3个方面:
1)功能电极材料的设计开发。高效稳定的电极材料是电氧化水处理技术的核心,基于优化电子转移和微界面调控的电极材料的开发将直接影响电氧化水处理效率,是当前和未来的研究重点。同时,研制高效、廉价、可大规模制备的电极材料以期实现电氧化技术的大规模实际工程应用。
2)反应器结构优化。电极反应器的结构优化将影响反应过程中的流道和流场分布,强化水处理效果,降低能耗损失。同时,多种工艺的组合联用实现协同效应,达到高效、绿色清洁生产。
3)资源能源的回收。废水的污染物含有大量的化学能,如何将其化学能回收,实现污染物的降解和同步产能是未来水污染处理的方向,通过控制电极反应和精细化的微界面调控,将污染物高效分离与定向转化,进而实现资源化与能源化是未来水污染控制技术研究的重要方向。
