不同含量水解鱼蛋白添加对大菱鲆幼鱼生长、血浆和肌肉游离氨基酸含量及后肠组织形态的影响❋
2022-02-24刘成栋周慧慧麦康森
蒋 昊, 王 旋, 刘成栋, 周慧慧, 麦康森, 何 艮
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
具有高营养价值的鱼粉(Fish meal,FM)是水产饲料工业的主要蛋白质来源,随着全球FM产量下降,水产饲料中的FM短缺成为我们所面临的一个重大挑战[1],探究如何使用新型蛋白源替代FM成为近年来的热门研究课题[2]。用于水产养殖配合饲料的替代蛋白源主要有动物蛋白源、植物蛋白源和以单细胞藻类和酵母为主的一部分单细胞蛋白源[3-5]。然而,在氨基酸组成方面,和FM最相近的动物蛋白源,其替代水平一直不高。原料消化率低、不同来源地的质量参差不齐、必需氨基酸组成不平衡和灰分含量过高等原因制约了动物蛋白源在水产饲料中的应用[6]。因此,在水产饲料中添加氨基酸组成平衡、有利于消化吸收的动物蛋白源是减少FM用量的重要解决途径。
水解鱼蛋白(Fish protein hydrolysate,FPH)通过水解作用将蛋白质水解成蛋白质寡肽,不仅提高了鱼加工下脚料蛋白质的回收率,还充分提高了蛋白质的营养价值[7]。与未进行水解的鱼蛋白相比,FPH中含有许多小肽和游离氨基酸,可以促进鱼体的摄食,更好的被鱼体吸收[8]。FPH中含有促生长的小分子,如羟脯氨酸、牛磺酸等,可以增加消化酶活性,增强免疫应答,加快生长速度[9-12]。此外,FPH中常量元素钾、钠、钙、镁、磷含量普遍较高,微量元素碘、硒、B族维生素及叶酸的含量普遍高于植物蛋白源[12]。作为新型蛋白源,FPH在虾、鲈鱼、大西洋鳕鱼等中的应用已有研究报道[13-15]。
大菱鲆(ScophthalmusmaximusL.)又称为多宝鱼,具有肉质鲜美、营养价值高、容易饲养等特点,现已成为中国北方养殖的代表品种之一[16]。本研究旨在评估在低FM即高植物蛋白源替代的饲料中添加不同含量的FPH对大菱鲆幼鱼的生长指标、后肠形态、游离氨基酸浓度和PepT1基因表达的影响。研究结果可为FPH在大菱鲆饲料中的FM替代提供基础数据。
1 材料和方法
1.1 水解鱼蛋白的制备
通过鱼类加工厂(山东伟琪水产有限公司)鳀鱼加工产品所剩的下脚料,经酶法提取制作FPH。具体操作方法:用中性蛋白酶(山东苏克汉生物有限公司提供),含菌量10万CFU/g,按1%添加,在55 ℃水浴的环境中水解鱼蛋白5 h,保证外界环境达到pH=7.5。将水解完的鱼蛋白放入80 ℃的干燥箱中30 min即得,水解鱼蛋白(干物质)含粗蛋白70.11%,粗脂肪22.99%。
1.2 实验饲料
共设计5组等氮(52%粗蛋白)等能(20 kJ/g能值)的饲料,以FM组作为正对照组,以植物蛋白源混合物(豆粕、玉米蛋白粉、花生粕)替代40%的FM作为负对照组(36% FM,),在负对照组的基础上分别添加3%、6%和9%的FPH作为实验组,分别记为3% FPH、6% FPH和9% FPH处理组。饲料配方所包含的营养成分见表1。

表1 饲料配方和其中所包含的营养物质(干物质)1
所有的原料均经过粉碎机超微粉碎后过180 μm筛网,按照饲料配方中的含量从少至多逐级混匀,然后将大豆卵磷脂和鱼油加入,与各部分原料充分混合,随后加入大约20%~25%溶解含有氯化胆碱的纯水后再进行一次混匀,使用双螺杆制粒机(F-26,华南理工大学,中国)制成颗粒饲料(粒径规格3 mm×4 mm),最后将所制成的饲料放入55 ℃的通风烘箱中烘干(16 h)至恒重后放入-20 ℃冰箱中进行储存。
1.3 养殖实验过程
大菱鲆鱼苗购于山东威海某育苗场,养殖实验地点隶属于青岛亿海丰水产有限公司,此次养殖周期持续74 d。养殖实验开始前暂养2周使幼鱼适应养殖环境,暂养结束后饥饿24 h,选取体格健壮、大小均一的大菱鲆幼鱼((10.17±0.02)g)进行养殖实验,每个实验组各分3个养殖桶(水量约为300 L),每桶含有30尾幼鱼,本次实验共计15个养殖桶。每天上午7:30和晚上18:30进行2次表观饱食投喂,保持循环水水温在16.0~18.6 ℃、pH稳定在7.5~8.0之间、盐度为29.1~32.2、持续充氧保证溶氧量在7 mg/L左右,氨氮和亚硝酸盐的浓度控制小于0.1 mg/L。
1.4 样品采集
在投喂完养殖鱼体4 h后,用自动粪便收集器虹吸法收集粪便样本。为了检测的准确性,仅收集新鲜完整的粪便。收集的粪便样本随即装入50 mL离心分离管中,放入-20 ℃冰箱保存直至分析。
实验结束后,饥饿鱼体48 h,对每桶大菱鲆进行称重和计数。随机抽取4条鱼,进行全鱼体常规分析。随机抽取4条鱼,测量鱼体体质量、体长、内脏团质量和肝质量,用以计算鱼体的形体指标。随机抽取3条鱼收集肠样本进行组织学分析,解剖鱼体取后肠部位,置于波恩氏固定液(饱和苦味酸∶甲醛∶冰醋酸=15∶5∶1)中24 h,然后按照标准的组织学程序,用70%的乙醇进行保存。随后切取约5 mm左右长度的后肠道,经过不同浓度的乙醇和二甲苯逐级脱水,进行石蜡包埋,待石蜡凉至室温后,使用组织切片机进行手动切片,肠道切片的厚度在5~7 μm之间,将切好的石蜡片放在载玻片上进行展片和烘片步骤,最后用HE染色法进行染色和封片。保证桶内剩下的大菱鲆幼鱼充分摄食并达到表观饱食状态,在投喂8 h后随机从桶内抽取6条鱼,务必确保所抽取的鱼肠道内包含饲料,否则弃之,使用1 mL一次性注射器从鱼体尾静脉处提取血液样本,置于抗凝管中,然后在4 ℃下以3 500g离心10 min,抽取上清液获得血清样本,样品在-80 ℃储存。从每条鱼的背部相同位置取下一块背肌,放入1.5 mL的试管中(RNase-Free; Axygen),冷冻在液氮里,然后储存在-80 ℃冰箱中,直至分析。
1.5 分析方法
1.5.1 饲料、鱼体及粪便的成分分析 所有的饲料原料、饲料和鱼体的样本都使用分析化学标准协会[17]的方法来检测粗蛋白、粗脂肪和粗灰分。将待测样品(饲料和粪便)研磨成粉末状,放置于105 ℃烘箱中烘干水分保持恒重,采用电感耦合等离子体原子发射分光光度计(ICP-AES, VISTA-MPX, VARIAN, USA)测定高氯酸消化后日粮和粪便中的氧化钇(Y2O3)含量。每个单独样品指标的检测都需要重复测定2次,若2次的相对偏差过高则需要重新检测,直到相对偏差在1%之内方可使用检测指标。
1.5.2 组织学观察 在光学显微镜下(Olympus, DP72,日本)使用相机(Nikon E600,日本)和cellSens标准软件(Olympus,日本)进行图像采集,所有采集完成的图像均使用Imagine Pro Plus 6.0软件进行测量分析,在不同放大倍率的物镜下进行分析,每个处理组至少分析6张以上的切片。
1.5.3 组织游离氨基酸检测 检测大菱鲆鱼体摄食饲料8 h后血浆和肌肉中的游离氨基酸。从-80 ℃冰箱中取出待测的血浆样品,放置于冰上进行解冻,待血浆充分融化后,取0.4 mL血浆上清液置于2 mL离心管中,随后加入1.2 mL的磺基水杨酸(10%),充分混匀静置5 min,在18 894.2g、4 ℃的条件下离心15 min,用1 mL注射器吸取上清液,最后将上清液经过0.2 μm滤膜过滤后再加入到上样管中,使用全自动氨基酸检测仪(L-8900,HITACHI,Japan)检测游离氨基酸含量。
从-80 ℃冰箱中取出待测的肌肉样品,放置于冰上进行解冻,待肌肉充分融化后,称取1 g肌肉置于5 mL匀浆离心管中,随后加入3 mL的磺基水杨酸(10%),充分匀浆后取匀浆液1.5 mL,在18 894.2g、4 ℃的条件下离心15 min,用1 mL注射器吸取上清液,最后将上清液经过0.2 μm滤膜过滤后再加入到上样管中,使用全自动氨基酸检测仪(L-8900,HITACHI,Japan)检测游离氨基酸含量。
1.5.4 实时荧光定量PCR分析 采用Trizol法进行肠道组织RNA提取,使用TaKaRa公司(日本)反转录试剂盒和定量热循环仪(Mastercyclerep realplex, Eppendorf,德国)进行RNA反转录,结束后检测浓度并使用DEPC水将其稀释至80 ng/μL,放置于-80 ℃的冰箱中保存。采用实时荧光定量PCR(qRT-PCR)检测小肽转运体1 基因(Peptidetransporter1,PepT1, XM_035629795.1)和β-肌动蛋白基因(β-actin)的mRNA表达,β-actin(EU686692.1)作为内参基因。本实验目的基因引物序列[18]列于表2。所有靶基因的表达数据均采用2-ΔΔCT方法测定目的基因的表达量[19]。

表2 实时荧光定量PCR所用的引物
1.6 计算公式和统计方法
计算公式如下:
增重率(Weight gain rate, WGR)=(FBW-IBW)/IBW×100%。
特定生长率(Special growth rate, SGR,%·d-1)=ln(FBW-IBW)/养殖天数。
摄食率(Feed intake, FI)={摄入饲料干质量/[(FBW+IBW)/2]}/养殖天数×100%。
饲料转化率(Feed conversion ratio, FCR)=摄入饲料干质量/鱼体增重湿质量×100%。
蛋白质效率(Protein efficiency ratio, PER)=(FBW-IBW)/(W×P)×100%。
蛋白质沉积率(Protein productive value, PPV)=(FBW×P1-IBW×P0)/(W×P)×100%。
存活率(Survival rate, SR)=终末鱼数/初始鱼数×100%。
肥满度(Condition factor, CF)=FBW/L3×100%。
肝体比(Hepatosomatic index,HSI)=肝脏质量/FBW×100%。
脏体比(Viscerosomatic index,VSI)=内脏团质量/FBW×100%。
表观消化率(Apparent digestibility coefficient, ADC)=(1-饲料中氧化钇/粪便中氧化钇)×100%。
绒毛直径比(Villus diameter ratio, VDR)=绒毛高度(Villi height, VH)/管腔直径(Lumen diameter, LD)。
式中:IBW为初始体质量(Initial body weight, IBW);FBW为终末体质量(Final body weight, FBW);W表示每尾鱼摄食的饲料干物质量(g);P表示饲料粗蛋白含量(干质量,%);P0表示实验开始时鱼体粗蛋白含量(湿质量,%);P1表示实验结束时鱼体粗蛋白含量(湿质量,%);L表示鱼体体长(cm)。
所有测得的数据均采用SPSS17.0软件进行单因素方差分析(One-way ANOVA),当差异达到显著水平(P<0.05)时,再利用Tukey进行多重比较,最后的数据用平均值±标准误的形式来体现,差异性则使用上标字母不同来表示。
2 结果
2.1 大菱鲆幼鱼生长指标和饲料利用
如表3所示,养殖实验期间,各处理组都没有收集到死亡的大菱鲆鱼苗,存活率都是100%。74 d饲养试验结束后,各组间的FI、FCR、PER、PPV相比较均无显著性差异(P>0.05)。负对照组的FBW、WGR、SGR均显著低于正对照组、6% FPH组和9% FPH组(P<0.05)。添加6%和9%比例的FPH组与正对照组相比,在FBW和SGR指标上均没有显著差异(P>0.05)。与此同时,与其他处理组相比,9% FPH组的WGR水平显著升高,并出现了最高的数值(P<0.05)。

表3 投喂不同添加水平的水解鱼蛋白对大菱鲆幼鱼的生长性能和饲料利用的影响1
2.2 饲料干物质表观消化率
ADC的结果见图1,负对照组的ADC明显低于其他各组(P<0.05)。伴随着FPH的添加量的升高,ADC出现了相同趋势的变化,当FPH添加量为3%和6%时,两组的ADC显著低于FM和9% FPH组(P<0.05)。正对照组与9% FPH组相比较,在统计学上无显著性差异(P>0.05)。

(数据以平均值±标准误来表示(n=6),同一列中不同字母表示实验组之间差异显著(P<0.05)。Dates were expressed as means ± stan-dard error(n=6), values in the same column with different sup superscripted denote significant difference between experimental groups(P<0.05).)
2.3 鱼体组成和形体指标
如表4所示,全鱼体常规成分分析表明,随着FPH添加水平的升高,各处理组大菱鲆幼鱼的鱼体水分、粗脂肪、粗灰分与两个对照组相比没有显著差异(P>0.05)。使用FM和9% FPH组饲料喂养后的大菱鲆幼鱼粗蛋白均显著高于其他三个处理组(P<0.05)。与此同时,粗蛋白数值最高的是9% FPH处理组。如表5所示,所有实验组与对照组相比,大菱鲆幼鱼的形体指标(CF、HSI、VSI)均无显著性差异(P>0.05)。

表4 投喂不同添加水平的水解鱼蛋白对大菱鲆幼鱼的鱼体组成的影响(鱼体湿质量)1
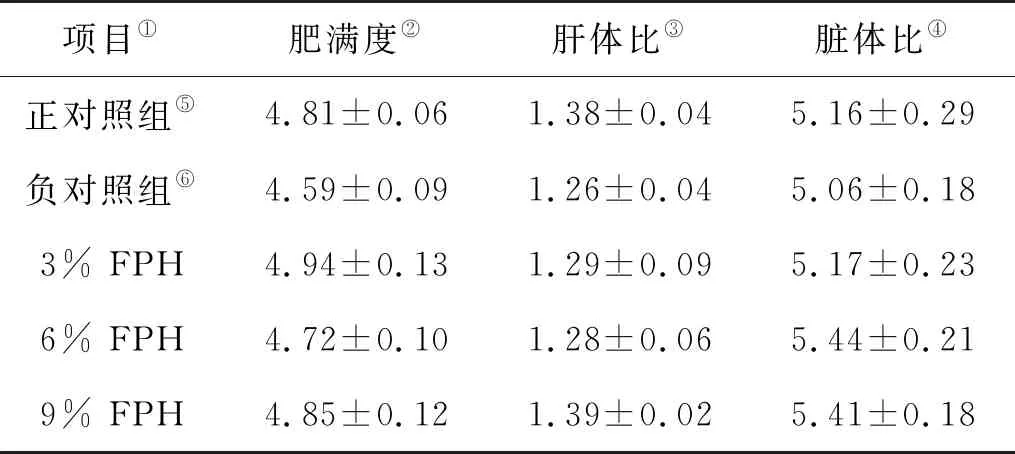
表5 投喂不同添加水平的水解鱼蛋白对大菱鲆幼鱼的肥满度、肝体比和脏体比的影响1
2.4 后肠形态分析
各组大菱鲆后肠横切面形态变化见图2、最终测量数据见表6。随着FPH的添加量的上升,大菱鲆幼鱼后肠绒毛更加紧凑,向中心点靠拢的趋势越发明显。添加FPH处理组与负对照组相比对VDR、肠上皮细胞高度(Enterocyte height,EH)和微绒毛高度(Microvillus height,MVH)均有显著影响,呈上升趋势(P<0.05)。6% FPH和9% FPH处理组的VDR与正对照组比较无显著性差异(P>0.05)。随着FPH的添加量加大,EH和MVH数值也呈现显著性的升高(P<0.05),同时,与正对照组相比,在9% FPH处理组中,EH和MVH的长度显著高于正对照组,并出现了实验数据的最高值(P<0.05)。
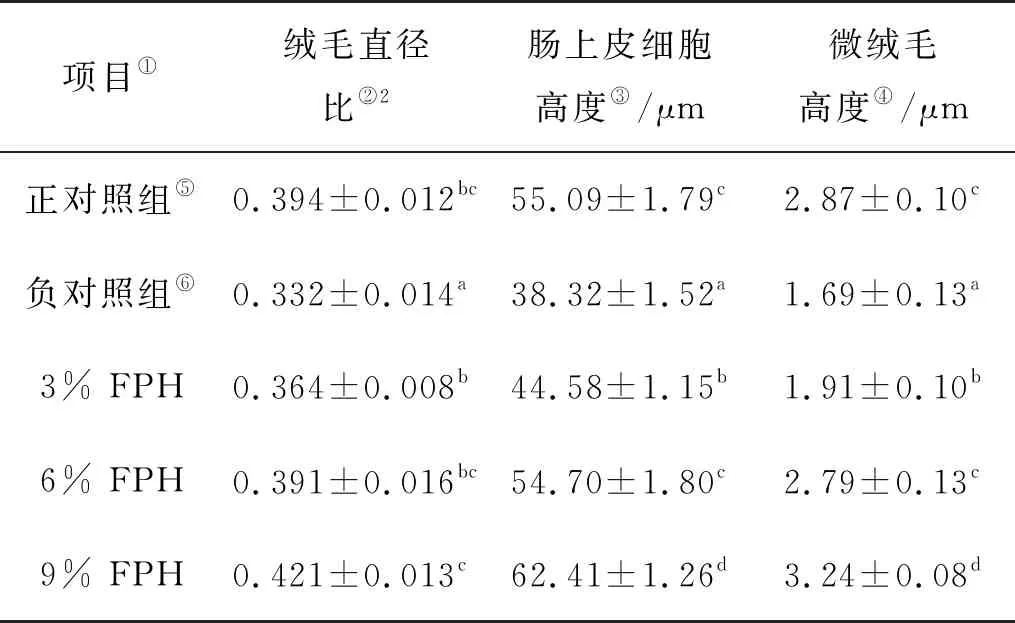
表6 投喂不同添加水平的水解鱼蛋白对大菱鲆幼鱼后肠的组织学指标的影响1
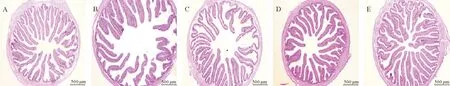
(A~E分别是正对照组, 负对照组, 3% FPH, 6% FPH和9% FPH处理组,比例尺是500 μm。A~E were sections from fish diet positive control group, negative control group, 3% FPH, 6% FPH and 9% FPH. The scale bars are presented as 500 μm.)
2.5 血浆和肌肉中的游离氨基酸含量变化
血浆游离氨基酸含量数据见表7,与负对照组相比,9% FPH组的亮氨酸、蛋氨酸、赖氨酸、酪氨酸水平显著升高。与此同时,9% FPH组的必需氨基酸、非必需氨基酸和总氨基酸含量也显著高于负对照组(P<0.05)。正对照组和9% FPH组相比,各游离氨基酸含量变化无统计学上差异(P>0.05)。
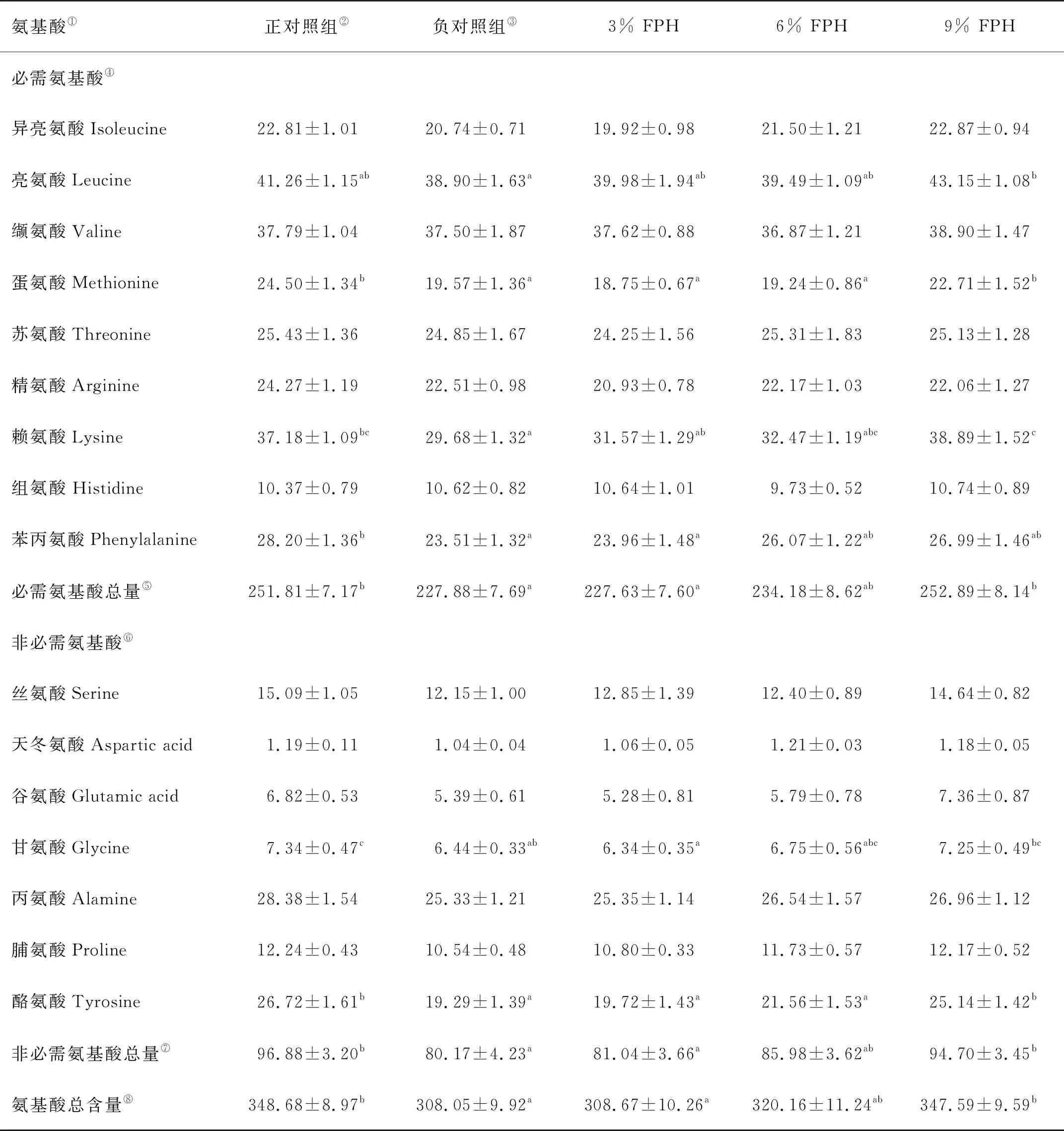
表7 投喂不同添加水平的水解鱼蛋白8 h后大菱鲆幼鱼血浆中游离氨基酸含量的变化1
如表8所示,与负对照组相比,9% FPH组显著升高了背部肌肉中的亮氨酸、精氨酸、组氨酸、丝氨酸、酪氨酸、非必需氨基酸和总游离氨基酸含量(P<0.05)。正对照组和9% FPH组的所有个体氨基酸浓度和游离氨基酸总量相比较没有显著性差异(P>0.05)。

表8 投喂不同添加水平的水解鱼蛋白8 h后大菱鲆幼鱼肌肉中游离氨基酸含量的变化(湿质量)1
2.6 后肠的基因表达量
检测结果如图3所示,9% FPH组PepT1基因表达量最高,显著高于其他各组(P<0.05)。同时,与负对照组相比,6% FPH组PepT1基因表达也得到了显著性升高(P<0.05)。然而,负对照组与3% FPH组相比较无统计学差异(P>0.05)。

(数据以平均值±标准误来表示(n=6),不同字母表示实验组之间差异显著(P<0.05)。Dates were expressed as means ± standard error(n=6), values with different sup superscripted denote significant difference between experimental groups(P<0.05).)
3 讨论
最近几年对大菱鲆幼鱼的研究表明,FM仍然是饲料中最重要的蛋白质来源,大菱鲆幼鱼至少需要50%的FM才能正常生长[20]。本实验设计中,正对照组含60%的FM,用植物蛋白源混合物替代40%的FM作为负对照组,即饲料含36%的FM,FM水平较低,我们预期这不会是大菱鲆幼鱼生长的最佳添加量。我们设计各组的粗蛋白、粗脂肪和总能量的组成相同,保证各实验组的植物蛋白源替代水平一致,在负对照组的基础上分别添加3%、6%和9%的FPH,主要目的是比较不同含量的FPH添加效果,评估不同含量的FPH功能之间的差异。
3.1 水解鱼蛋白对生长指标的影响
目前,FPH在水产养殖中的应用广泛,不同品种之间FPH的最适添加量存在着显著的差异。饲料中添加适量的FPH可显著促进鱼体的生长,适宜添加量为3%~20%,当FPH的添加量超过适宜的水平时,实验结果显示FPH会抑制摄食对象的生长,生长出现下降的原因可能是由于体内蛋白质和小肽氨基酸的吸收利用过程不同步,进而导致部分氨基酸利用率下降所致[21]。有研究表明,在高植物蛋白饲料中适当添加低分子量的FPH[22],大菱鲆幼鱼的生长和饲料利用有升高的趋势;而高水平含量添加低分子量的FPH会抑制其生长和饲料利用[23]。在本研究中,6% FPH组和9% FPH组与负对照组相比能有效提高生长性能,包括FBW、WGR、SGR,在最高的9% FPH处理组出现了以上指标的最高值。然而,FI、FCR、PER、PPV在各处理组间无统计学差异,相似的结果在鲈鱼、牙鲆的研究中也得到了验证[21,24]。因此,本实验结果论证了FPH并没有通过改变大菱鲆幼鱼的饲料利用率来促进鱼体生长。与此同时,添加FPH可显著改善大菱鲆幼鱼的ADC,在9% FPH处理组中出现了ADC的最高值。有研究表明,草鱼的ADC在0.25%和1.00%虾蛋白水解物添加后显著升高[25]。与正对照组相比,牙鲆喂食FPH(37 g/kg)处理组的ADC最高[24]。实验结果表明,鱼体对饲料干物质的吸收得到提升可能是导致鱼体的增长的原因之一。
3.2 水解鱼蛋白对后肠形态的影响
肠道是水生动物体内最大的消化器官和内分泌器官,不仅负责鱼体从外界环境中获取营养物质,还参与机体的新陈代谢、免疫应答和应激反应,而水产动物肠道组织形态上的完整以及黏膜屏障功能的正常表达是保障机体健康的基础[26]。在大黄鱼和牙鲆[27-28]的实验中表明,植物蛋白源中所含的抗营养因子(ANFs)可能会导致鱼的肠道结构损伤,导致VH降低,腔内绒毛排列杂乱等现象。本研究中,FPH组的VDR、EH和MVH与负对照组相比均显著性升高。这结果与在舌鳎上有关于FPH添加的研究结果相似[10]。VH、EH和MVH是评价肠组织结构变化的重要指标,这些组织高度的增加可以扩大小肠的吸收面积,有利于小肠对外界环境营养物质的吸收[29]。我们的研究结果表明,在高植物蛋白源替代FM的饲料中添加FPH可以改善后肠的形态结构,促进肠道的发育从而保证了机体对营养物质的吸收,进而促进鱼体的生长。
3.3 水解鱼蛋白对游离氨基酸含量的影响
饲料中的氨基酸含量的差异与摄食后鱼体内不同组织的游离氨基酸的含量具有关联性[30]。鱼体对外界环境中蛋白质的摄食吸收从根本上说就是对食物来源中的必需氨基酸和非必需氨基酸的吸收。氨基酸对机体的生理变化、代谢、蛋白质合成和生长发育有重要影响,同时组织中游离氨基酸浓度的变化反映了机体的营养状况[18]。膳食蛋白质来源的质量影响着鱼机体组织中游离氨基酸的组成。由于水解酶的加入,FPH中含有大量可溶性小肽和游离氨基酸,以小肽为主要氨基酸源时,饲料的蛋白沉积速率要高于以氨基酸或未分解蛋白为主的原料,换言之,氨基酸在寡肽中的吸收效率高于以蛋白质为主体的吸收效率,摄食添加FPH的饲料可以提高蛋白质在动物体内的利用率[31]。在本实验中,9% FPH处理组的大菱鲆幼鱼出现了最高的粗蛋白,同时血浆和肌肉中也含有最高的游离氨基酸浓度。因此,我们推测FPH中的小肽更容易被鱼体吸收、游离氨基酸可以提高鱼体摄食,进而促进大菱鲆幼鱼蛋白质的合成,最终促进生长。
3.4 水解鱼蛋白对PepT1 基因表达的影响
PepT1作为一种重要的转运蛋白基因,在寡肽转运的调控中起着重要作用,PepT1可以转运400~8 000余种不同结构形态的小肽,为鱼类的生长、消化代谢和繁衍后代提供了坚实的保障。PepT1基因表达主要集中在消化道中,因为机体主要吸收蛋白质降解小肽和多肽的功能器官主要分布于肠道中。饲料中所包含的蛋白质、多肽和晶体氨基酸组成水平的差异会影响摄食对象PepT1基因的表达[32]。在草鱼的研究中发现,饲料中添加FM作为蛋白源的PepT1基因表达量明显高于饲料中添加大豆作为蛋白源的饲料组[33]。在大菱鲆的研究中发现,30%FM被豆粕替代后,PepT1基因表达量明显下降[34]。相同的结果也出现在鲷鱼以及大黄鱼的研究中[27,35]。研究表明FPH中的小肽,在体内具有生物活性,在机体内的吸收速度往往快于游离氨基酸,机体吸收小肽所需要的能量供给也较少,小肽能更加高效的参与消化系统的吸收过程[36]。在本研究中,6% FPH组、9% FPH组和正对照组的PepT1基因表达量较高,PepT1基因表达的增加趋势与生长性能结果一致。结果表明,通过适量的FPH添加到饲料中可以增加鱼体的PepT1基因表达,促进鱼体对氨基酸的吸收,从而提高大菱鲆幼鱼的生长。
4 结语
饲料中添加9% 水解鱼蛋白可以显著提高大菱鲆幼鱼的生长指标,增加体内游离氨基酸浓度,增强肠道对营养物质的吸收能力和肠道内PepT1基因的表达。添加水解鱼蛋白还可以减少植物蛋白源对肠道的负面影响。本研究认为水解鱼蛋白可以成为大菱鲆幼鱼的优质蛋白质来源。
