慢病毒介导SHCBP1低表达对黑色素瘤B16细胞增殖的影响
2022-02-21孙志阳雷静静唐铖铖孙晨皓路宏朝
孙志阳,冯 光,雷静静,唐铖铖,孙晨皓,王 令,路宏朝
(陕西理工大学 生物科学与工程学院,汉中723000)
恶性黑色素瘤(malignant melanoma)简称恶黑,是一种来源于黑色素细胞的恶性肿瘤[1],主要发生于皮肤、眼睛、黏膜表面、神经系统等区域。其在恶性肿瘤中发病率增长最快,年增长率约5%[2-4]。其侵袭性高,易转移、耐药性强的特点导致死亡率较高[5]。因此,深入研究黑色素瘤发生发展的具体分子机制不仅能了解肿瘤的发生机制,还为其临床诊治提供有效靶点。尽管越来越多的文献从基因组学、蛋白质组学、表观遗传学等层面去探究肿瘤的形成机制,但黑色素瘤发生发展的分子机制仍未完全揭示[6]。
SHC(Src homology 2 domain containing)家族包含SHC A、SHC B、SHC C和SHC D等4个亚家族[7]。SHC是细胞表面受体衔接蛋白,激活多种生长因子受体(如表皮生长因子受体和成纤维细胞生长因子受体)信号传导途径,调节细胞的生长和分化[8]。SHCBP1(SHC SH2-domain binding protein 1)是SHC A的结合蛋白[9-10],最早发现在T细胞活化过程中高表达。随着研究深入,发现SHCBP1在多种实体肿瘤中表达显著增高[11-13]。目前研究表明,SHCBP1参与调控肺癌、胃癌、前列腺癌等癌细胞的增殖、侵袭、迁移等多种生物学过程[14-15]。SHCBP1通过Smad、Wnt、AKT等信号通路发挥生物学功能,如在肺癌中表皮生长因子(EGF)诱导SHCBP1蛋白进入细胞核,与β-连环蛋白结合激活Wnt信号进而促进细胞增殖。Liu等[16]、Zhou等[17]和Peng等[18]在滑膜肉瘤细胞中发现SHCBP1通过Smad信号通路促进细胞迁移。但是,SHCBP1在黑色素瘤中的功能仍未见报道。
目前,在哺乳动物的研究中常采用RNA干扰、慢病毒敲除/敲入和Cas9基因编辑等技术解析基因功能。其中,慢病毒敲除技术具有将目的基因整合到宿主基因组的功能,从而实现长时间表达的特点,因而被广泛应用[19]。实验前期发现Shcbp1基因在小鼠黑色素瘤B16细胞中高表达,初步推测Shcbp1基因可能作为一种促癌基因发挥作用。为了进一步阐明SHCBP1对黑色素瘤细胞的增殖效应,研究以小鼠黑色素瘤B16细胞为材料,采用慢病毒干扰技术构建Shcbp1基因的干扰载体,以获得稳定干扰Shcbp1基因表达的小鼠B16细胞株,揭示SHCBP1对B16细胞增殖的影响,为解析黑色素瘤发生发展的分子机制提供基础数据。
1 材料与方法
1.1 材料
小鼠黑色素瘤B16细胞、HEK293T细胞(上海赛百慷公司);MMPCs(青旗生物技术发展有限公司);包装质粒psPAX2、pMD2.G、pLKO.1-TRC(淼灵生物科技有限公司),核酸内切酶EcoR I和AgeI(NEB公司);嘌呤霉素(Sigma公司);质粒提取试剂盒(博日公司);0.45 μm过滤器(上海生工);1640培养基(康宁公司);胎牛血清(美国Gibco公司),T4DNA连接酶(NEB公司);Lipofectamine 2000(Invitrogen公司);逆转录试剂盒和实时荧光定量检测试剂盒(AG公司);抗鼠HRP-GAPDH、SHCBP1、p-AKT、t-AKT、p21、p53、ERK1/2、p-ERK1/2一抗(proteintech公司);HRP标记山羊抗兔二抗(西安壮志生物科技有限公司)。
1.2 方法
1.2.1 设计干扰序列
在Sigma公司(http:∥www.sigmaaldrich.com/life-science/functional-genomics-and-rnai/sirna/mission-predesigned-sirna.html)网站公布的shRNA库中筛选鼠源SHCBP1两条干扰序列、NC序列共3对短发卡RNA(shorthaiepin RNA shRNA)干扰序列,引物见表 1,由安徽通用生物公司合成。
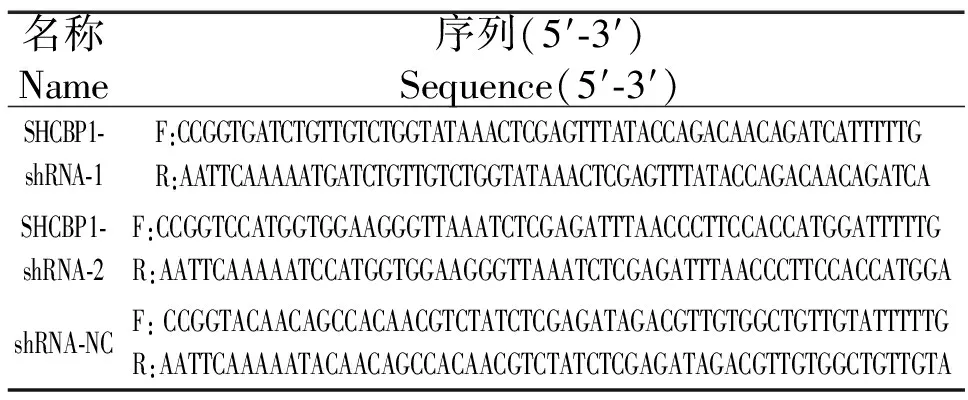
表1 DNA寡聚核苷酸序列
1.2.2 构建pLKO.1-SHCBP1-shRNA重组载体
pLKO.1-TRC经AgeI和EcoR I双酶切,酶切产物经1%琼脂糖电泳后,用DNA凝胶回收试剂盒回收目的片段。单链oligo DNA经退火后形成双链DNA,程序为95 ℃梯度降温,每个循环降10 ℃ 5 min,降到4 ℃保存。在T4DNA连接酶作用下pLKO.1-TRC酶切产物与shRNA引物退火产物连接,过夜后将连接产物转化至感受态细胞中并涂布至固体培养基上,37 ℃恒温培养箱中培养过夜。随机挑选平板上的单克隆进行PCR鉴定,选取阳性克隆测序。
1.2.3 慢病毒包装
将表达载体和慢病毒转染辅助质粒与Lipofectamine 2000转染试剂混匀,制备DNA/Lipofectamine混合物,室温孵育20 min。将DNA/Lipofectamine复合物转染293T细胞。转染48、72 h分别收取细胞上清液,经离心后收集病毒,-80 ℃保存。
1.2.4 慢病毒感染及稳定表达SHCBP1-shRNA的细胞株筛选
用病毒原液感染状态较好的B16细胞,加入感染增强液Polybrene,工作质量浓度2 μg/mL。试验设置SHCBP1干扰组(shRNA-1、shRNA-2),无关序列组(shRNA-NC),未感染病毒的细胞作为空白对照。感染24 h后更换新鲜培养基。感染2 d后,用含2 μg/mL嘌呤霉素(Puro)连续筛选7 d。扩大培养阳性细胞用于后续试验。
1.2.5 实时荧光定量PCR检测
利用RNAiso Plus 法(按照说明书)分别提取细胞株的总RNA。再按照Prime Script RT reagent Kit with gDNA Eraser 试剂盒说明书,将 RNA 逆转录成 cDNA。用实时定量 PCR 仪运行如下程序进行RT-PCR:94 ℃ 预变性10 min;95 ℃ 变性15 s,60 ℃ 退火30 s,40个循环(定量引物见表 2)。基因的相对表达水平以 β-肌动蛋白作为内参对照,计算按照 2-ΔΔCt法。
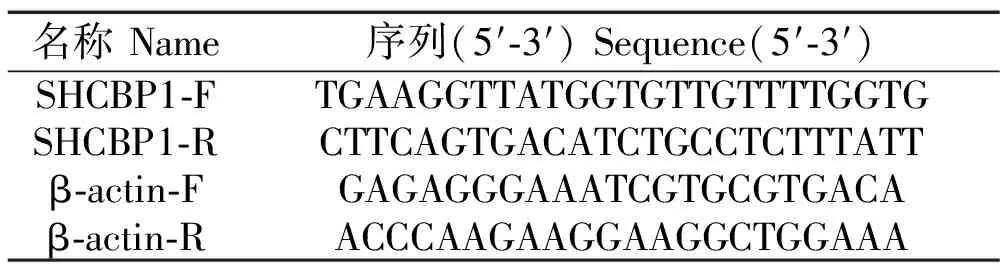
表2 PCR引物信息
1.2.6 CCK-8检测细胞增殖
将筛选的细胞接种于96孔培养板,每孔2 000个细胞。设置5个重复孔和无细胞培养基对照。分别培养12、24、36、48 h后,每孔加入100 μL CCK-8工作液,37 ℃培养箱孵育1 h后测定A450 nm吸光度值,重复3次取平均值。
1.2.7 EDU掺入试验
待细胞汇合度为70%~80%时,加入终浓度为10 μmol/L的EDU工作液继续培养2 h。弃去培养液。4%多聚甲醛室温固定15 min,弃去多聚甲醛,洗涤3次,通透15 min。加入Click液避光孵育30 min,吸去Click反应液,于荧光显微镜下观察。随机选择10个非重叠视野, 计算EDU阳性细胞数, 计算平均值。
1.2.8 流式细胞术检测细胞周期
收集试验组shRNA-1,胰酶消化后离心收集细胞,70%乙醇4 ℃固定,12 h后离心收集细胞,用预冷的PBS清洗,PI染液避光孵育30 min,流式细胞仪检测。
1.2.9 蛋白质免疫印迹(Western Blot)
RIPA裂解液裂解细胞,制备蛋白质样品。用BCA蛋白质浓度测定试剂盒检测蛋白质浓度。制备的蛋白质样品进行SDS-PAGE,将凝胶中的蛋白质转移到 PVDF 膜上,5%脱脂奶粉封闭, 加入一抗孵育过夜,HRP标记的羊抗兔二抗与一抗结合,TBST洗涤,与ECL试剂反应、曝光。利用 Image J 软件进行灰度分析。
1.3 统计学处理
采用SPSS 11.5软件包对数据进行统计分析,用平均值±标准差表示统计分析结果,采用t检验比较各组数据统计学差异,差异显著(P<0.05),差异极显著(P<0.01)。
2 结果与分析
2.1 SHCBP1蛋白在B16细胞中的本底表达
为探究SHCBP1在黑色素瘤B16细胞中的表达水平,以黑色素前体MMPCs细胞为对照组,采用Western Blot检测SHCBP1在两种细胞中的蛋白表达量。结果显示,与黑色素前体MMPCs细胞相比,SHCBP1在B16细胞中的蛋白表达量约为黑色素前体细胞的2.5倍(P<0.01),见图1,说明SHCBP1在B16细胞中处于高水平表达。
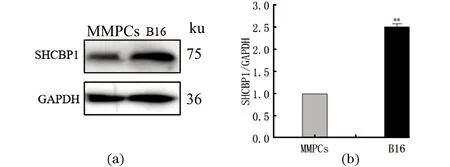
(a)Western Blot检测SHCBP1的蛋白表达水平;(b)Western Blot结果的灰度分析(**为P<0.01)。
2.2 重组pLK O.1-SHCBP1-shRNA载体构建
在Sigma公司公布的shRNA库中筛选两条干扰序列,通过SECentral软件与SHCBP1mRNA比对,干扰靶点在第6个和第7个外显子上(图 2)。
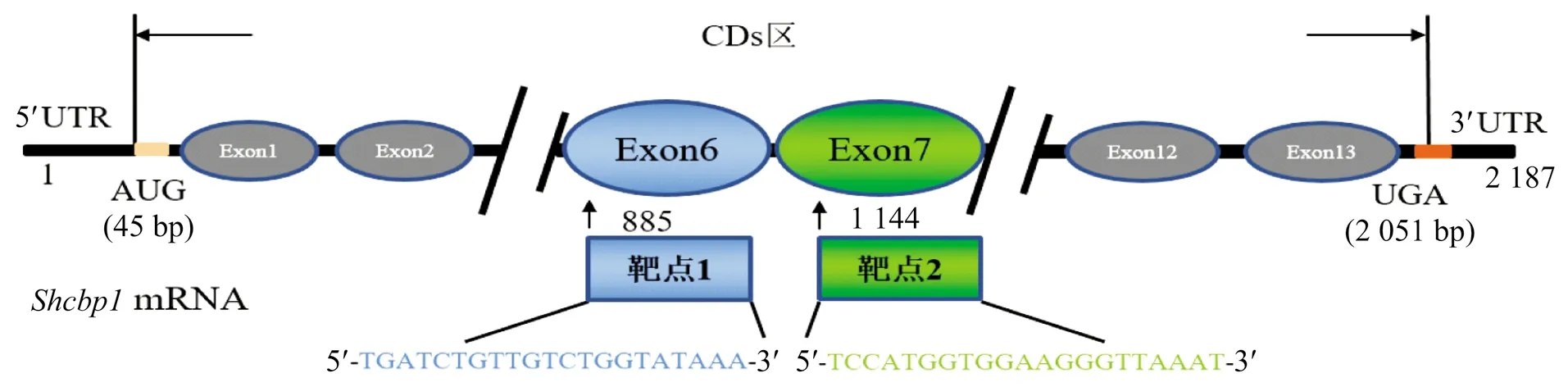
图2 shRNA设计位点示意图
针对pLKO.1-TRC骨架载体用EcoR I和AgeI双酶切,经电泳检测发现大小在7 000 bp和1 900 bp左右出现两个片段,见图3(a),酶切产物条带大小在7 kb左右与理论值一致。
将连接产物转化后,挑取单克隆进行菌落PCR,经琼脂糖凝胶电泳检测,在264 bp出现条带与预期的大小相一致,见图3(b),说明已将ShRNA片段插入pLKO.1骨架载体中。挑取阳性菌落,摇菌提取质粒测序,测序结果与目的片段一致,见图3(c),证明成功构建NC和SHCBP1慢病毒干扰载体,见图3(d)。
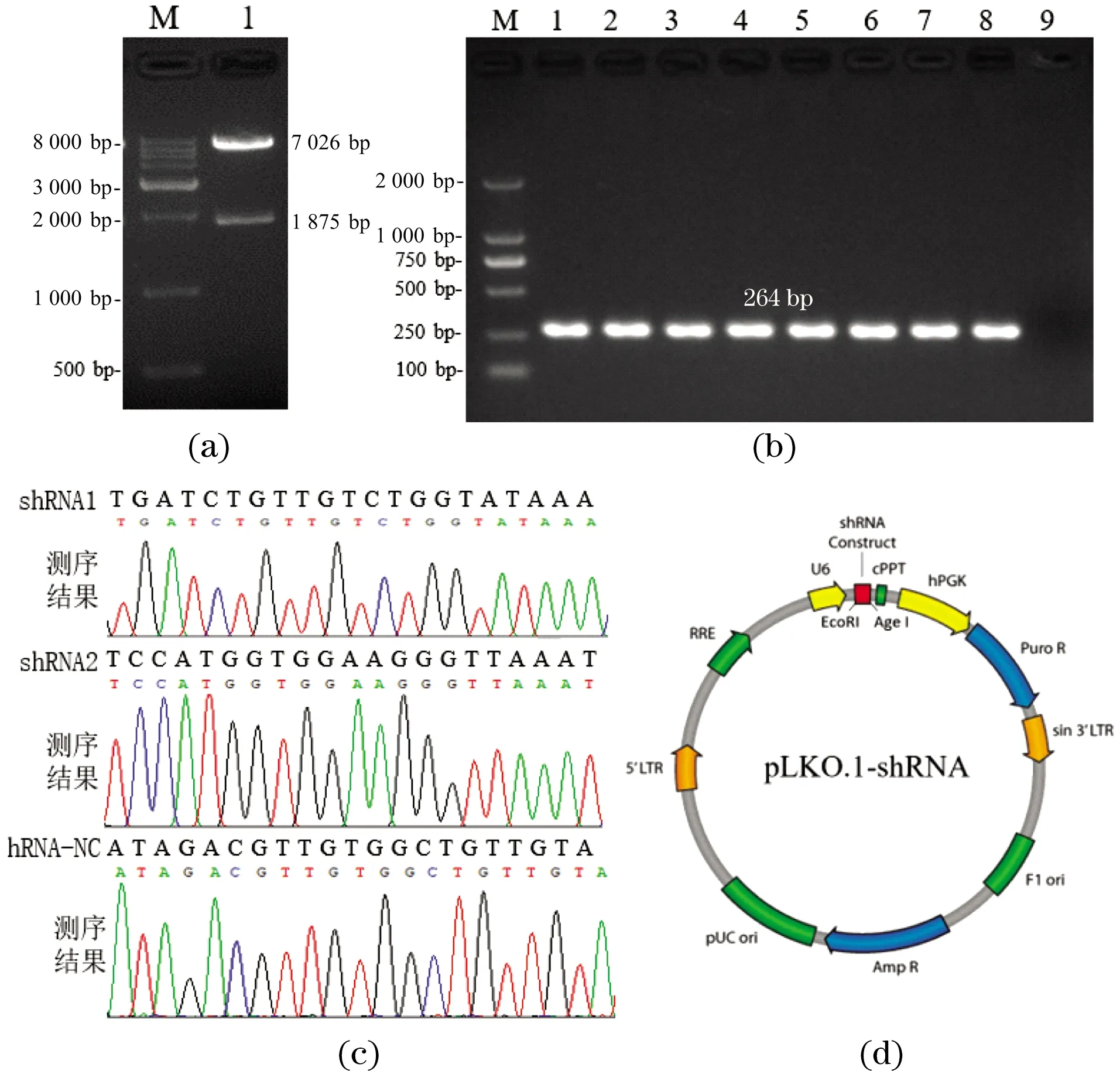
(a)Age I and EcoR I 双酶切鉴定(M:Marker DL8000,1:pLKO.1 载体);(b)菌落PCR鉴定(1~8:菌落PCR阳性结果,9:菌落PCR阴性对照,M:Marker DL2000);(c)测序结果;(d)重组质粒图谱。
2.3 稳定干扰Shcbp1细胞株的建立及干扰效率分析
待细胞生长密度到70%时,用携带shRNA-NC、shRNA-1和shRNA-2序列的慢病毒侵染B16细胞,细胞生长状态良好,加入puro进行筛选。收集稳定干扰shRNA-NC、shRNA-1和shRNA-2的B16细胞,采用实时荧光定量PCR技术检测Shcbp1干扰效率,与NC组相比,两个干扰序列均能显著下调Shcbp1的mRNA表达水平(P<0.01,n=3),shRNA-1和shRNA-2的干扰效率分别达到90.2%、87.5%,见图4(a)。Western Blot检测SHCBP1蛋白表达显示出相似的结果,见图4(b),通过对蛋白结果进行灰度分析,计算干扰效率分别是97%和84%,差异具有统计学意义(P<0.01,n=3),见图4(c)所示,由于shRNA-1干扰效率高于shRNA-2,后续实验以shRNA-1为实验材料。综上结果,采用慢病毒包装技术,能够获得稳定干扰SHCBP1基因的B16细胞株。
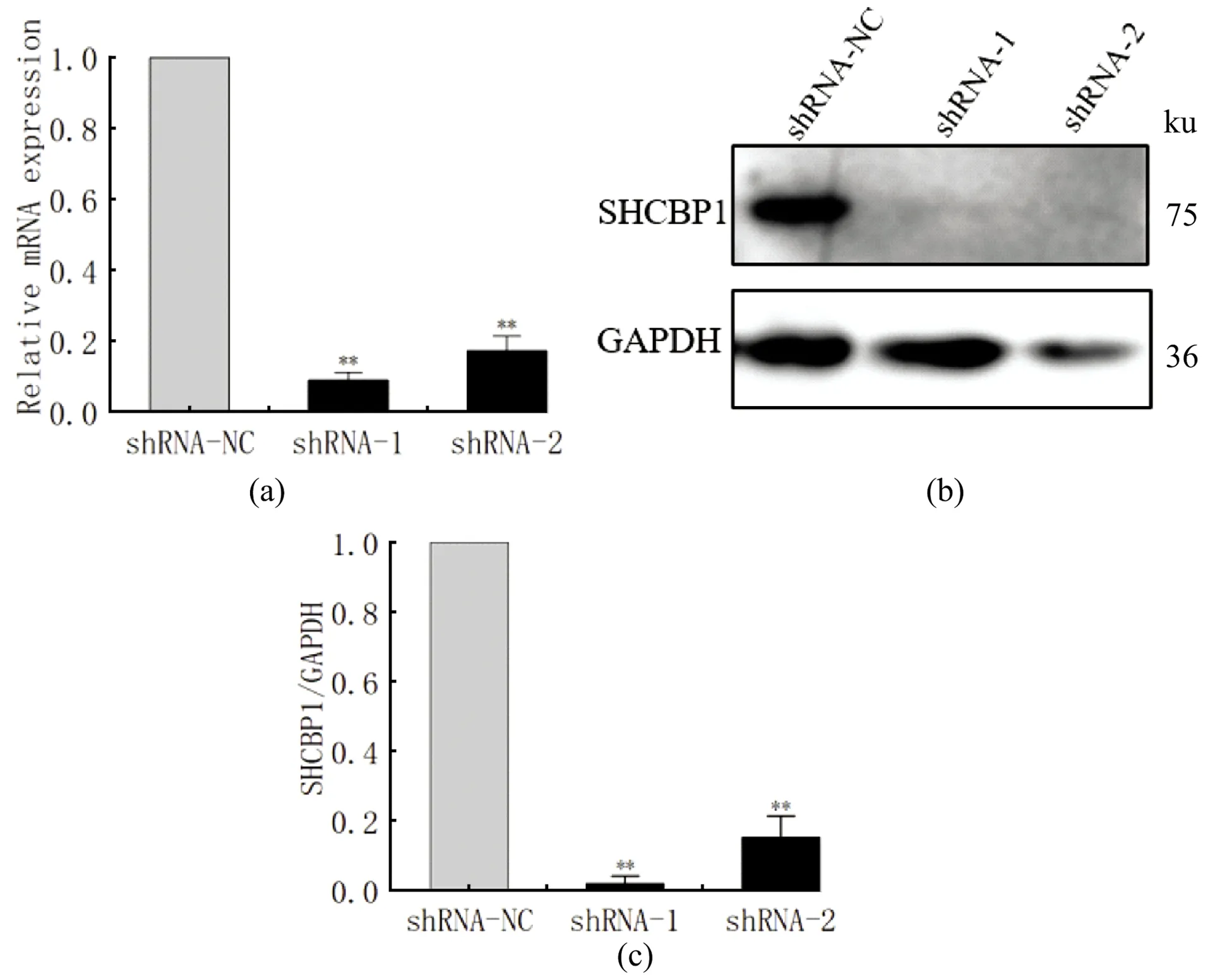
(a)B16细胞中Shcbp1的mRNA水平表达;(b)B16细胞中SHCBP1的蛋白水平表达;(c)Western Blot结果的灰度分析。** 为P<0.01。
2.4 SHCBP1低表达对B16细胞增殖的影响
为探究SHCBP1对黑色素瘤B16细胞增殖的影响,选取shRNA-1为实验对象,通过形态学观察,发现干扰Shcbp1后细胞增殖明显受到抑制,见图5(a)。为进一步了解细胞增殖期分布比例,用CCK-8法检测干扰组细胞的增殖能力,发现SHCBP1的表达降低可以显著抑制B16细胞增殖,检测OD值在培养12 h(0.43±0.06)、24 h(0.48±0.045)、36 h(0.53±0.06)和48 h(0.99±0.1)都显著抑制细胞增殖(P<0.05,n=3),见图5(b)。EDU检测细胞增殖期细胞比率,与shRNA-NC相比,干扰SHCBP1的表达后B16增殖期的细胞明显减少,见图5(c)。细胞流式术也获得相似的结果,B16细胞周期进程明显受到阻碍,见图5(d),与对照组相比,阻滞在G1期(45.3%±3.2%)细胞比例显著增多(P<0.05,n=3),而S期(13.8%±2%)细胞显著减少(P<0.05,n=3)。结果说明,SHCBP1在黑色素瘤细胞中具有促进细胞增殖的功能,提示其在B16细胞中具有癌基因的潜力。

(a)显微镜10×观察图;(b)B16细胞的CCK-8细胞增殖测定;(c)EDU检测细胞增殖;(d)EDU阳性细胞量化图;(e)B16细胞的流式细胞术细胞周期测定。*为P<0.05,**为P<0.01。
2.5 SHCBP1 通过ERK1/2信号通路调节细胞周期G1/S转变
为探究SHCBP1促进B16细胞增殖的具体分子机制,收集稳定干扰SHCBP1基因的B16细胞,用Western Blot检测细胞增殖相关蛋白变化,见图6(a)。与对照相比,在干扰SHCBP1后细胞周期抑制因子P21蛋白明显上调2倍多(P<0.01,n=3),而转录因子P53并无明显变化,见图6(b),推测SHCBP1通过抑制P21蛋白表达从而促进细胞G1期到S期的转变。
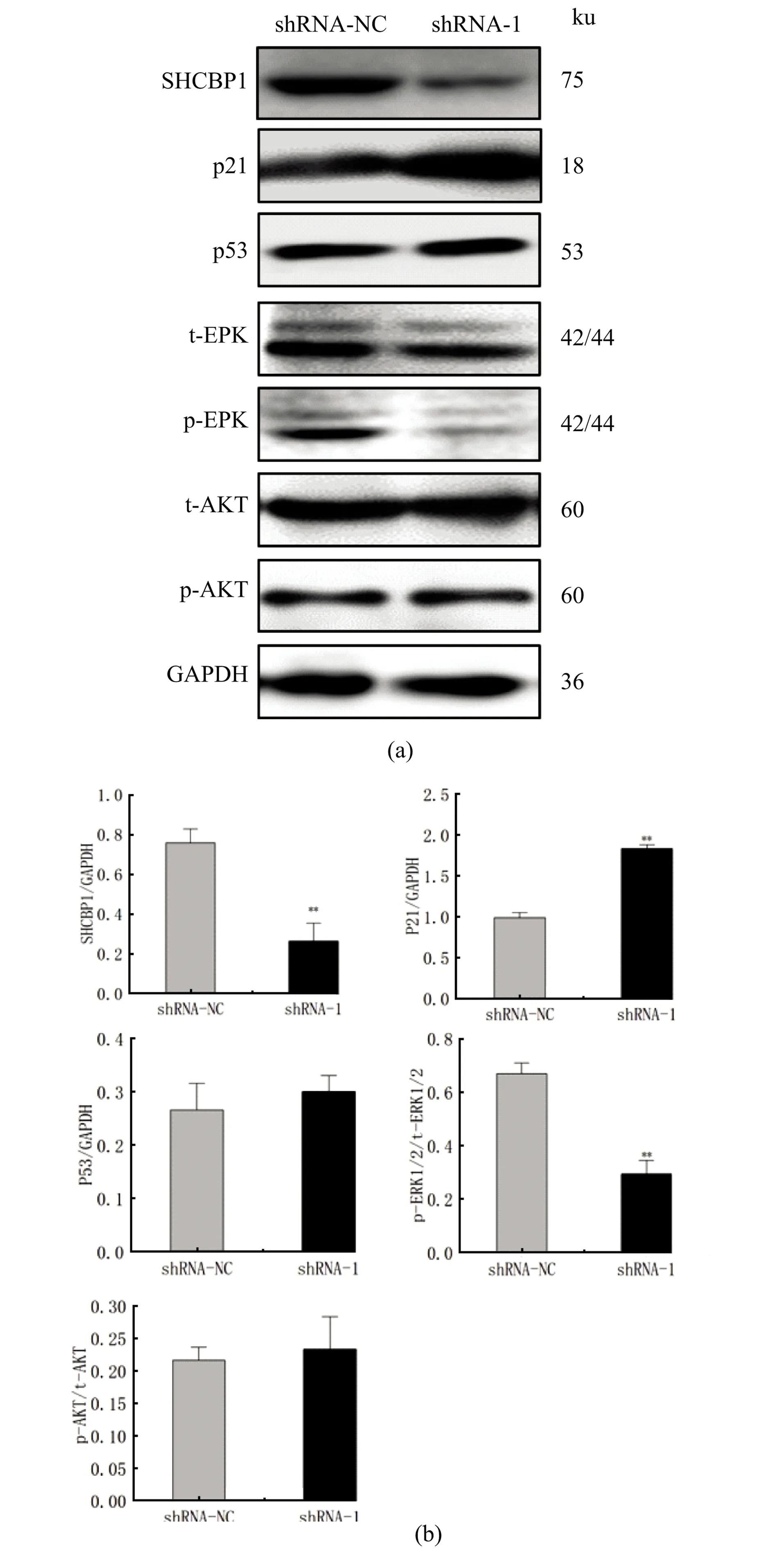
(a)Western Blot检测SHCBP1、phosopho-ERK, phosopho-AKT、P21、P53的蛋白水平表达;(b)Western Blot结果的灰度分析(** 为P<0.01)。
利用Western Blot技术检测SHCBP1的低水平表达对MAPK和AKT信号通路的影响。结果显示:与shRNA-NC组相比,试验组中AKT的磷酸化水平无明显变化,而ERK1/2的磷酸化水平显著降低,差异显著(P<0.01,n=3),见图6(a)和(b)。这表明SHCBP1可能通过ERK信号通路影响B16细胞增殖效应。
3 讨论
黑色素瘤的增殖涉及多种信号通路,如余扬[20]在人恶性黑素瘤A375细胞中发现JAK2信号通路介导自噬和凋亡。此外Tang等[21]发现EGFL7沉默使Notch信号通路失活增强人皮肤黑色素瘤的细胞凋亡并抑制细胞增殖。lncRNA MIAT表达调控PI3K/AKT信号通路抑制黑色素瘤的迁移和侵袭[22]。因此,充分认识黑色素瘤的发病机制,鉴定更多可用的生物标志物和新的治疗靶标是十分必要的。
慢病毒干扰技术能够高效、特异地沉默基因的表达,该技术已经得到广泛应用,Sang等[23]在骨肉瘤细胞中利用慢病毒技术将CTHRC基因干扰,干扰效率达到86%。Ye等[24]在乳腺癌细胞中利用慢病毒技术将CEP55基因干扰,解析其与增殖相关的功能。本研究采用慢病毒干扰技术,获得稳定敲低Shcbp1基因的B16细胞系,在蛋白水平SHCBP1的干扰效率达到90%。
SHCBP1是SHC蛋白结合蛋白,在黑色素瘤B16细胞中高表达,并且与转移潜能和预后不良有关。SHCBP1通过激活NF-κB信号通路促进胶质瘤的迁移和侵袭[25]。最新研究发现SHCBP1通过激活Wnt途径促进顺铂药物诱导的细胞凋亡[26-27]。本研究构建Shcbp1两个干扰载体shRNA-1、shRNA-2,且shRNA-1比shRNA-2干扰效率高,后续试验以shRNA-1作为试验材料。结果显示SHCBP1通过促进细胞周期G1到S期转变,而促进B16细胞增殖。细胞增殖主要受细胞周期检验点控制,细胞周期检验点是对基因组稳定性作出响应的控制点。P53是一种十分重要的肿瘤抑制因子,在许多类型的肿瘤中有突变,P53能激活依赖性激酶抑制因子P21的转录,而P21又是CDK4、CDK1等的抑制因子[28]。通过这种抑制作用,P53-P21参与了G1/S和G2/M检验点的调控[29]。研究发现,SHCBP1通过抑制P21蛋白的表达,促进B16细胞G1到S期的转变,但与P53的表达无关。
丝氨酸/苏氨酸激酶 AKT(又称作蛋白激酶B或PKB)作为一种原癌基因,已经成为医学界主要的关注热点,这是因为它参与调控细胞的多种功能(包括代谢、生长、增殖、存活、转录以及蛋白质合成)[30]。MAPK是一种胞外信号调节激酶,其参与的信号转导包括:胞外信号调节激酶ERK,p38促分裂原活化的蛋白激酶,c-Jun氨基末端激酶。其中ERK亚族主要包括ERK1和ERK2,在真核细胞中,ERK参与多达十几条的信号通路,参与细胞生长、分化、增殖、凋亡的过程[31]。研究表明,ERK1和ERK2主要参与多种肿瘤细胞的增殖过程。Wang等[32]在结肠癌研究中发现AKT信号通路抑制P21加速细胞周期进程。同时,ERK1/ERK2信号也通过影响P21的转录活性使细胞周期进程停滞。研究发现Shcbp1干扰后t-AKT和p-AKT蛋白均无变化,说明Shcbp1没有通过AKT信号通路发挥促增殖作用。但是,SHCBP1干扰后ERK1/2的磷酸化水平显著降低,说明在B16细胞中SHCBP1通过ERK信号通路抑制P21的转录,从而加速细胞从G1到S期进程。
