中国南方稻谷主产区黑曲霉菌群的流行特征及产毒能力研究
2022-02-20徐圆程王光宇汪海峰印晓玉邱伟芬
张 婷, 徐圆程, 王光宇, 汪海峰, 印晓玉, 邱伟芬
(南京财经大学食品科学与工程学院,南京 210023)
稻谷是我国重要的粮食作物之一,在我国国民经济中占有极其重要的地位[1]。随着我国将粮食安全战略纳入“十四五”规划,粮食产后的收储保质减损重要性日益凸显。黑曲霉群(A.nigeraggregate)是储藏稻谷中的优势菌群,不仅会导致粮食霉变造成经济损失,部分菌株还能产生赭曲霉毒素A(Ochratoxin A, OTA)危害人类健康[2]。因此,有必要对我国稻谷主产区储存粮堆中黑曲霉群的流行特征进行调查并分析它们的产毒能力,为我国稻谷的安全储藏和霉菌针对性防控提供数据参考。
黑曲霉群主要的形态特征是产生黑色的分生孢子头,通常能形成典型的黑色或深棕色菌落。食品中常见的黑色曲霉主要包括黑曲霉(A.niger)、塔宾曲霉(A.tubingensis)和巴西曲霉(A.brasiliensis)等10种。这类形态种之间具有高度的生物多样性但种间差异非常微小[3]。此外,菌落的颜色还受到培养基、培养时间、产孢量和菌核等因素影响。因此,仅依靠表型特征无法区分黑曲霉群中的物种。针对黑曲霉群的系统发育和分类学的研究表明,要准确鉴定黑色曲霉除了需要对分离株的微观形态进行表征外,还需要对ITS和一些蛋白基因(如BenA和CaM)进行测序[4,5]。Susca等[6]通过形态学结合BenA和CaM基因对美国和意大利两国玉米中黑曲霉群进行鉴定,发现黑曲霉、塔宾曲霉和百岁兰曲霉是两国玉米中最常见的黑色曲霉,但组成比例上有差异。而Noonim等[7]发现泰国两个不同地区的咖啡豆中的黑曲霉群为A.aculeatinus、炭黑曲霉(A.carbonarius)、黑曲霉、塔宾曲霉和A.sclerotiicarbonarius共5种。由此可知,黑曲霉群的分布特征与地理环境、气候差异等因素相关。传统上认为,谷物中的OTA通常由赭曲霉(A.ochraceus)和纯绿青霉(Penicilliumverrucosum)产生[8],但越来越多的研究发现,黑曲霉群也可以在谷物及其副产物中生长繁殖并产生OTA[9]。此外,研究还发现不同地理、气候环境中存在的分离株,产OTA的能力也各不相同。OTA产毒基因簇由五个基因组成,分别是编码卤素酶(HAL)、bZIP转录因子(bZIP)、细胞色素单加氧酶P450、非核糖体肽合成酶(NRPS)和聚酮合成酶(PKS)[10,11]。OTA的产生与否及产生能力的强弱除基因水平上的因素外[12],还会受到温度、水分等因素的影响[13]。因此,不同地理位置分布的黑曲霉群均可能导致OTA污染风险。到目前为止全球发现的黑色曲霉中炭黑曲霉[14]、A.lacticoffeatu[15]、黑曲霉[16]和百岁兰曲霉[17]均有过产生OTA的报道。地理位置及气候环境会影响黑曲霉群的分布,但这些黑色曲霉仅依靠外观特征和ITS测序难以准确鉴定到种。目前国内对于稻谷等储藏粮堆的样品采集范围较小,对优势菌种的分类鉴定多数依靠外观及ITS测序,导致我们对仓储稻谷中黑曲霉群的分布信息并不明确,且它们的分布规律和产OTA能力鲜有系统研究。
本研究采集我国南方十省的仓储稻谷样品,通过形态特征筛选出黑曲霉群菌株,进一步依据ITS及CaM序列特征对其进行鉴定,明确其进化关系及分布规律;采用ELISA、HPLC-FLD方法并结合OTA生物合成基因鉴定方法确证黑曲霉群分离株的产OTA能力,该研究结果为我国稻谷的安全储藏及霉菌针对性防控提供数据支撑。
1 材料与方法
1.1 材料与试剂
稻谷样品采集自我国南方稻谷主产区10个省的代表性粮库。
高盐察氏培养基(HCA)、察氏培养基(CA);基因组DNA提取试剂盒;2×Rapid Taq Master Mix;TAE缓冲液;氯化钠、氯化钾、七水合硫酸亚铁、磷酸二氢钾、无水乙醇、三水合磷酸氢二钾、七水合硫酸镁、蔗糖(分析纯);酵母提取物;甲醇(色谱纯);OTA标准品。
1.2 仪器与设备
MJ-150F-I霉菌培养箱,VOSHIN-600R无菌均质机,SX-500高压蒸汽灭菌锅,VeritiPro梯度PCR仪,BIO-RAD Mini-sub Cell电泳槽,BIO-RAD Gel Doc XR凝胶成像仪,ELX800酶标仪,1260高效液相色谱仪。
1.3 实验方法
1.3.1 样品采集
于2017年3月—2019年11月在我国南方10个省江苏、浙江、福建、四川、安徽、湖南、湖北、江西、广东和广西的14个代表性粮库,采集样品共计525份。粮库为高大平房仓。采用三层五点法分层分点进行扦样,每份样品300 g。三层为距粮堆地面0.5 m的下层,距粮堆表面2.5 m的中层,距粮堆表面0.5 m的上层。五点为每个粮层距离两边墙壁均为1 m的4个角落和中心点,共5个采样点。取得的样品用无菌采样袋封装后于4 ℃保藏运送至实验室。
1.3.2 霉菌的分离与纯化
在无菌环境中称取25 g稻谷样品装于无菌均质袋中,用225 mL无菌水搅匀作为原液,稀释度为10-1。然后吸取1 mL至9 mL无菌水中制成10-2的稀释液,连续梯度稀释3次后得到浓度为10-5的样品稀释液。取此稀释度菌液稀释液制成平板,于霉菌培养箱中28 ℃培养7 d。根据霉菌菌落的形态学特征,选取培养皿上的黑色或深棕色菌落,将其划线分离纯化培养,最终纯化得到单一的黑曲霉群菌株。一部分用于1.3.3中的菌株鉴定实验,另一部分以孢子悬浮液的形式储存,于2 mL冻存管中加入40%灭菌的甘油,比例为1∶1,混合均匀后保藏于-80 ℃超低温冰箱中,供1.3.5的产毒培养实验使用。
1.3.3 菌株鉴定
将20 mg菌丝体从培养皿中取出,转移至1.5 mL离心管中,按照说明书使用试剂盒提取黑曲霉菌株基因组DNA,在超净台进行操作,收集至离心管中。对所提取的DNA进行PCR扩增,引物为ITS1/ITS4和cmd5/cmd6(表1)。PCR反应体系及程序参照文献[18]。对所得扩增产物进行1%琼脂糖凝胶电泳分析并在化学发光成像仪上观察结果,鉴定扩增产物的完整性。所有扩增产物均由上海生工生物工程股份有限公司进行测序,将测序结果在NCBI数据库中进行BLAST比对分析。

表1 扩增引物序列表
1.3.4 系统发育分析
使用MEGA 11软件对序列进行系统发育分析。首先通过Clustal W程序进行多重序列比对,然后选择最大似然法(Maximum Likelihood, ML)构建系统发育树。使用Tamura-Nei模型经过1 000次bootstrap评估其稳定性后获得系统发育树。
1.3.5 霉菌的产毒培养
取出预先制备好的黑曲霉群菌株孢子悬浮液,置于4 ℃冰箱储存备用。CYA产毒培养基参照Hübsch[21]的方法进行配置,用无菌生理盐水将黑曲霉群菌株孢子悬浮液浓度调整至106CFU/mL。取5 μL悬浮液滴于平板中央,28 ℃恒温培养7 d,一式3份。
1.3.6 ELISA法测定OTA产生能力
使用ELISA试剂盒对107株黑曲霉菌株产OTA能力进行定性检测。从产毒培养基菌落的中心、中圈、外圈各取1块带菌琼脂块,将其置于2 mL离心管中,通过加入1 mL 60%甲醇提取OTA,每10 min震荡一次直至提取完毕,提取时间为1 h,然后离心得上清液,用ELISA试剂盒检测菌株产毒情况。按照ELISA试剂盒制造商给出的说明书进行操作,制作标准曲线并进行数据分析。
1.3.7 HPLC-FLD法测定OTA产生能力
采用高效液相色谱法对107株菌株的OTA进行定量分析。取样方法同1.3.6,用1 mL甲醇提取。采用反相C18色谱柱(5 μm,250 mm,4.6 mm,柱温45 ℃)、高效液相色谱(HPLC)、FLD荧光检测器(激发波长333 nm,发射波长460 nm)测定提取物中OTA含量。流动相为KH2PO4(4 mmol/L pH 2.5)和甲醇,比例为33∶67,流速为1 mL/min。通过与OTA标准品生成的校准曲线比较,对OTA进行洗脱和定量。加标回收实验通过将已知浓度的OTA加到底物中,并按照与样品相同的程序提取毒素来进行。
1.3.8 OTA生物合成关键基因的鉴定
参考Gil-Serna等[18]报道的鉴定方法,在所有分离株中检测OTA合成关键基因的存在,步骤同1.3.3,通过引物扩增产生的条带评估黑曲霉、塔宾曲霉、百岁兰曲霉和新黑曲霉菌株OTA生物合成基因的缺失。两组引物分别针对位于OTA生物合成基因簇两侧的异丙醇脱氢酶(IDH)和氧化氮合酶(ONS)编码基因,其中引物ISODH-PKSTUBF/R对塔宾曲霉具有特异性,而ISODH-PKSF/R则对黑曲霉和百岁兰曲霉具有特异性(表1)。
1.3.9 统计学分析
所有实验均为3个重复,数据以平均值±标准差表示。采用单因素方差分析(ANOVA)。对结果进行分析,P<0.05表示差异显著。采用SPSS 19.0对结果进行统计处理。
2 结果与分析
2.1 黑曲霉群菌株分布与流行特征
黑曲霉群疑似菌株提取基因组扩增出的ITS序列和CaM序列呈现的条带完整明亮,大小分别为600 bp左右和580 bp左右,符合测序要求。霉菌形态学对比和目标基因测序结果表明,在我国南方稻谷主产区代表性粮库中采集到的107株黑曲霉群分离株全部属于曲霉属。CaM测序分析结果将其分为4个种,分别为黑曲霉、塔宾曲霉、百岁兰曲霉、新黑曲霉,其中黑曲霉有37株,塔宾曲霉有13株,百岁兰曲霉有55株,新黑曲霉有2株。

注:a为新黑曲霉,b为黑曲霉,c为塔宾曲霉,d为百岁兰曲霉。
我国稻谷主产区大部分分布在长江以南、年平均气温较高的省份,丰富的降雨量使得这些地区气候湿润,这样的环境条件特别适宜霉菌的生长繁殖[22]。而黑曲霉群的菌株尤其适应在温暖的气候条件下生存,其黑色的孢子在阳光和紫外线下能够受到很好的保护,为它们在温暖气候条件下提供了竞争优势[23, 24]。黑曲霉群菌株普遍存在于仓储粮堆当中,这些黑色曲霉种的污染水平及分布特征通常会受到地理环境、气候特征等因素影响。
在本研究中,结合各采样地点地理环境信息分析可以发现,黑曲霉群分离株的分布呈现出明显的地区差异。从各地区黑曲霉群菌株的种类数量来看,有4个地区检测出了3种黑色曲霉,有2个地区只检测出了1种黑色曲霉。从地域分布来看,百岁兰曲霉分布最广,尤其在两广地区检出最多。其次是黑曲霉,近半数分布在广西南宁、广东雷州这2个地区。可见黑曲霉和百岁兰曲霉在广西和广东地区流行率都比较高。这两个省份属于我国第七储粮生态区高温高湿储粮区,一年当中15 ℃以上的时间在289~352 d,是我国“湿热”的地区。这说明黑曲霉群中的黑曲霉和百岁兰曲霉2个物种尤其喜爱高温高湿的环境,这种条件下的储粮尤其需要防范这两种霉菌。
从黑曲霉群菌株的检出数量来看,百岁兰曲霉最多,占51.40%,其次是黑曲霉和塔宾曲霉。相关研究证实,百岁兰曲霉、黑曲霉和塔宾曲霉是谷物中分布最普遍的黑色曲霉种[18, 25],这与本研究结果相似。除谷物以外,百岁兰曲霉还是葡萄[26]、洋葱[27]等其他农产品中流行率最高的黑色曲霉。值得注意的是,百岁兰曲霉在2011年才从黑曲霉中划分出来[28],最近几年才在全球范围内大量报道,主要原因可能是由于大多数研究在百岁兰曲霉的分类信息出现或者受到关注之前就已经发表。因此,目前仍然迫切需要对黑色曲霉的流行情况重新进行评价[29]。Massi等[30]将之前研究中被鉴定为黑曲霉的175株分离株,利用CaM测序对其进行重新鉴定后,发现其中有一半实际上是百岁兰曲霉。
本研究所分离到的塔宾曲霉也是稻谷中的主要黑色曲霉。Amani Lahouar等[31]研究表明,塔宾曲霉在谷物中普遍存在且检测频率较高,这与意大利[32]等国家的研究结果一致,在这些国家储粮样品中分离到的黑色曲霉中数量最多的是塔宾曲霉。结合地理特征分析后发现鉴定到的塔宾曲霉大多分布在高纬度的地区,且纬度越高塔宾曲霉的流行率越高,表明黑曲霉群种类的分布确实与地理位置、气候条件等因素相关。除近期被广泛报道的黑曲霉群种类外,本研究中还分离到了两株新黑曲霉,分布在湖南长沙和广东雷州2地。新黑曲霉在形态上与黑曲霉和塔宾曲霉相似[33],但能够形成白色菌核,在工业中常用它来发酵普洱茶。
2.2 系统发育分析
将所有序列在NCBI中比对后进行系统发育分析。系统发育结果大致将所分离到的黑曲霉群分为两大类,塔宾曲霉和新黑曲霉属于一个分支,而黑曲霉和百岁兰曲霉属于另一个分支,表明它们两两之间的亲缘关系接近。值得注意的是,在系统发育树中,各分离自江西赣州的黑曲霉(37)JXGZ18 3和广东雷州的黑曲霉(87)GDLZ17 8分离株亲缘关系与其他黑曲霉菌株较远。除此之外,其他分离自不同地区的黑色曲霉分离株均按种聚类到一起。
系统发育分析表明黑曲霉和百岁兰曲霉属于一大分支,且它们的种内变异性明显低于塔宾曲霉。这与以往报道的遗传关系一致[34],表明它们之间的亲缘关系更加接近。结合样品采集信息,黑曲霉和百岁兰曲霉的分布规律也是同步的,这可能由于2种黑色曲霉基因组成接近,有关基因功能均能够让它们适合在高温高湿环境中生长。综合来看,温湿度对我国南方地区仓储稻谷中黑曲霉群流行特征的影响较大。Battilani[35]和Chiotta[36]分别研究了欧洲和阿根廷不同地理区域对黑曲霉群流行情况的影响,发现各地温度和湿度的差异是引起这种地域性差异的主要原因。我国南方十省稻谷主产区由北向南所涉区域从温带地区跨到了热带地区的两广,纬度变化形成了较大温度差异,也就造成了各地粮库中黑曲霉群分布情况的不同。
2.3 黑曲霉群分离株产OTA能力评估
对107株黑曲霉群分离株进行ELISA法测定,所得标准曲线线性良好。线性方程为y=-44.433x+35.591,相关系数R2=0.996 1,说明可用于定量检测。加标回收实验测得回收率为88.67%~98.78%,RSD为2.16%~4.83%。ELISA测定产OTA能力结果如表3所示,来自5个不同地区的7株菌显示阳性,它们的产毒量在1.33 μg/kg到5.05 μg/kg之间。
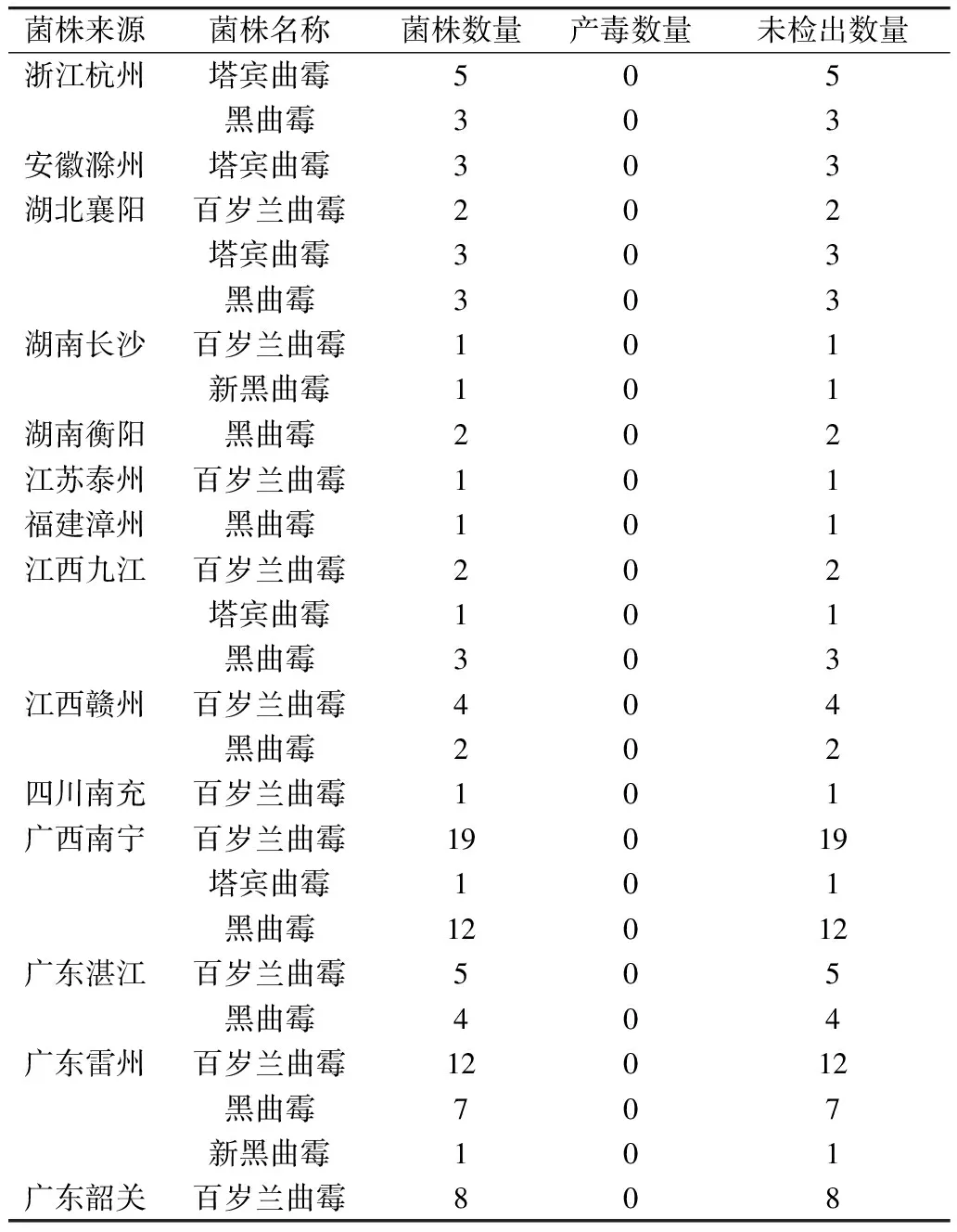
表3 全部菌株产毒情况
ELISA是食品中OTA检测的常用方法,其原理是基于抗原抗体特异性反应以及酶的催化作用[37]。该法具有检测速度快、成本低的优点,但在进行大批量样品检测时容易出现假阳性的结果,且重复性差。原因涉及多方面因素,如与样品结构类似的化合物间的交叉反应会影响测定结果的准确性[38],酶不稳定且易失活等。因此仍需采用其他方法进行确证。液相色谱-荧光检测法(HPLC-FLD)作为真菌毒素分析的金标准方法[39],灵敏度和准确度高,特异性强,自动化程度高,是许多实验室OTA检测的首选方法[40]。
使用HPLC-FLD对107株菌株的OTA提取液进行检测,得到标准曲线线性方程为y=0.126 4x+0.000 1,R2= 0.999 8,在0~100 μg/L范围内呈良好线性关系。加标回收实验结果显示加标回收率为89.54%~98.42%,相对标准差(RSD)为3.56%~5.62%,说明本法满足实验测定。HPLC-FLD结果如表2所示,107株菌株均未检测到OTA,针对此结果,继续通过提取这些菌株基因组DNA进行OTA生物合成基因鉴定来验证。

表2 黑曲霉群分离株分布特征
OTA生物合成基因主要由编码卤素酶(HAL)、bZIP转录因子(bZIP)、细胞色素单加氧酶P450、非核糖体肽合成酶(NRPS)和聚酮合成酶(PKS)这5个基因组成,所用引物扩增的是OTA生物合成基因和其上下游片段。当OTA生物合成基因缺失时,PCR引物扩增会产生1 000 bp左右长的条带,说明所测菌株无法合成OTA。OTA生物合成关键基因鉴定结果表明,所有菌株PCR扩增后在1 000 bp左右均有明亮条带产生,表明所有菌株均缺失OTA生物合成关键基因,不能产生OTA,与HPLC-FLD结果一致。
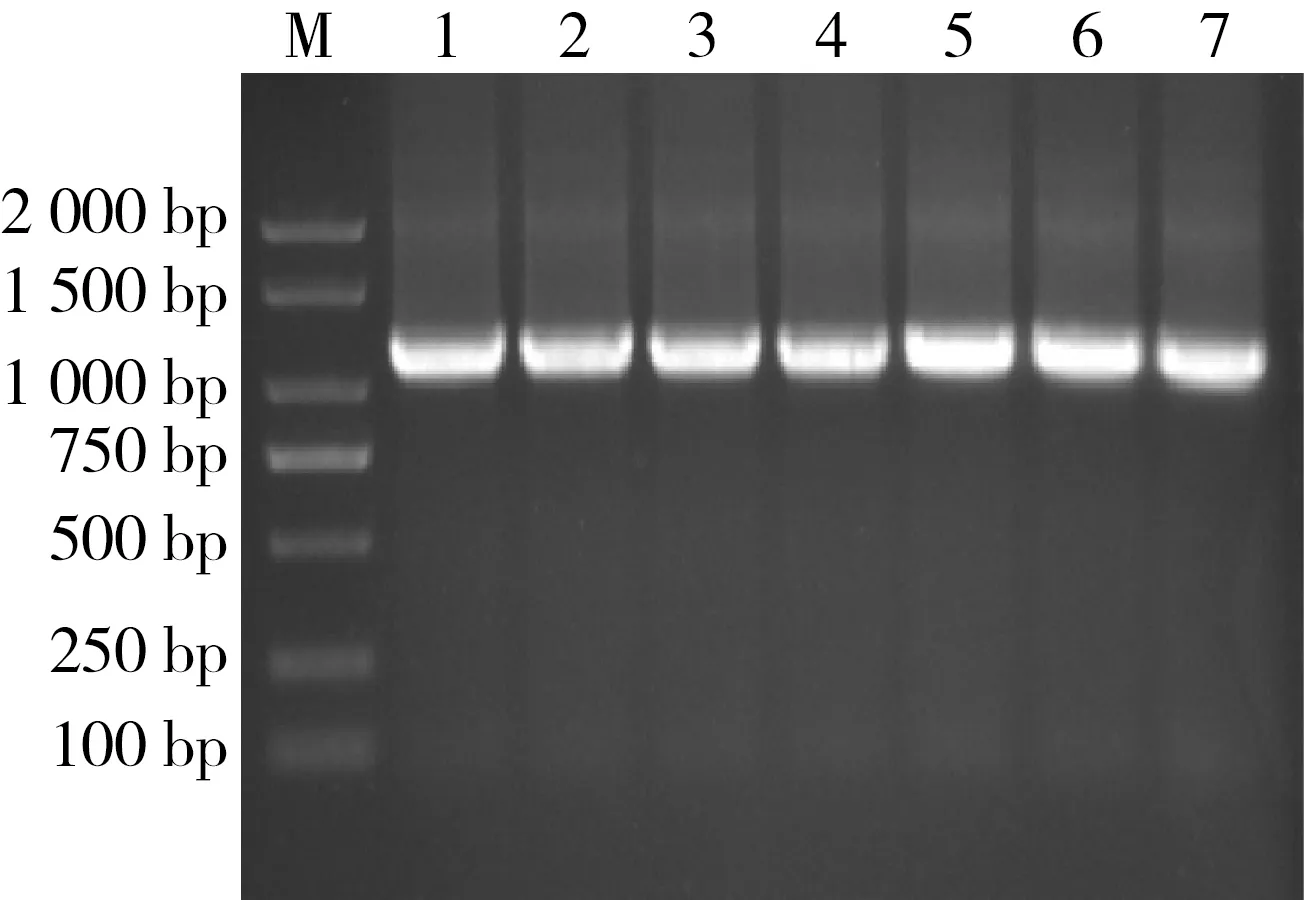
图2 OTA生物合成基因鉴定图
OTA是一种具有肾毒性和潜在致癌性的真菌毒素,多存在于谷物、咖啡豆、可可豆、葡萄、干果和香料等多种食品中[41],不同地理位置分布的黑曲霉群菌株均可能导致OTA污染的潜在风险。本研究中HPLC-FLD和OTA合成基因鉴定结果都表明所有菌株均不产生OTA,说明ELISA检测结果呈假阳性。因此,我国南方区域黑曲霉群造成的OTA污染风险较低,且宿主来源与产生OTA的能力也无明显关系。此外,这一结果还证实了基于PCR的分析有助于更简易方便地预测黑曲霉群OTA的产生能力。
虽然越来越多的研究发现黑色曲霉有产生OTA的能力,但综合现有的研究,这些产毒菌株只占了分离到黑色曲霉中的一小部分。许多黑曲霉群分离株缺少OTA生物合成基因,基因组中只保留了编码PKS中很小一部分无有效功能的序列,而黑曲霉群菌株不能产生OTA正是与其基因组中功能基因的缺失相关[42]。根据本研究中系统发育分析结果也可以做出一些推测,这些不产OTA的黑色曲霉的祖先出现了OTA合成基因簇缺失的情况,在进化过程中使得这些物种的毒素合成能力以不同程度或速率丧失。因此导致黑色曲霉中产OTA菌株可能并不普遍,只有百岁兰曲霉和黑曲霉等少数菌株被报道拥有完整的OTA合成基因簇[43, 44]。而塔宾曲霉产OTA的能力也一直备受争议,虽然有其产OTA的文献报告[45],但也有学者一直在讨论它能否真正的产OTA[46]。在Qi等[47]的研究中,所分离的塔宾曲霉均不产OTA。Nielsen等[48]的研究报告中也提到塔宾曲霉不能产生OTA。
虽然本研究中分离到的所有黑色曲霉均不能产生OTA,但需要注意的是,黑曲霉是工业发酵中最重要的微生物之一[49]。传统上认为它在工业条件下是无毒安全的,目前已经有相当多的黑曲霉发酵产品被美国食品和药品管理局授予了一般认为是安全的(generally regarded as safe, GRAS)证明。然而,在黑色曲霉中存在的产OTA和伏马菌素[50]的潜力,需要调整和加强工业发酵菌种的多种真菌毒素的筛选程序。
3 结论
粮食安全是全球普遍关注的研究课题。稻谷是我国重要的储备粮食作物,预防储粮霉变和防范真菌毒素污染对于我国的经济发展和人民健康具有重要意义。虽然农业收获技术的改进以及储粮霉变实时监测技术的应用大大降低了粮食霉变的几率,但霉变造成的储粮品质下降和经济损失仍不容忽视。本研究对中国南方稻谷主产区仓储稻谷中的黑曲霉群进行分离鉴定,分析其分布规律及流行特征,并评估其产OTA毒素的能力。综合结果来看,虽然未发现产OTA的黑色曲霉,但霉变带来的储粮数量损失和质量下降仍不容忽视,我们应对黑曲霉群继续保持监测和科学评估,才能有效防范OTA等真菌毒素污染的潜在风险。
