雌激素受体基因调控团头鲂生长和性腺发育的初步研究
2022-02-17刘莉芳罗丽飞陈宇龙高泽霞
刘莉芳,罗丽飞,陈宇龙,高泽霞,3
1.华中农业大学水产学院/农业农村部淡水生物繁育重点实验室/农业动物遗传育种与繁殖教育部重点实验室/湖北省名优鱼育种与健康养殖工程技术研究中心,武汉 430070;2.湖北洪山实验室,武汉 430070; 3.长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉 430070
雌激素(estrogen)是促进性腺发育和维持生殖功能必不可少的类固醇激素,也在调节能量代谢和生长发育方面起着关键的作用[1-2]。在鱼类中,已有研究表明雌二醇 (estrogen 2,E2)可通过GH/IGF轴调控IGF的表达,也可通过雌激素受体(estrogen receptor,ER)调控IGF的表达从而影响生长发育[3]。ER是介导雌激素在多个组织器官中发挥调节作用的关键受体[4-5]。哺乳动物只有ERα和ERβ两个雌激素受体基因[6]。由于基因组复制,多数硬骨鱼具有ERα、ERβ1和ERβ2三个雌激素受体基因[7-9]。
团头鲂(Megalobramaamblycephala),是中国特有的淡水养殖鱼类,具有很高的经济价值。自1960年推广养殖至今,已成为中国第六位大宗养殖淡水鱼类[10]。目前,关于雌激素受体与团头鲂生长发育的关系尚未报道。因此,本研究克隆获得了雌激素受体基因(ERα、ERβ1和ERβ2)的核心序列,并对其在3个年龄段的团头鲂生长快慢个体肌肉和性腺组织中的表达情况进行定量分析,以期为研究雌激素受体基因在调节生长与生殖发育过程中的潜在影响提供研究基础。
1 材料与方法
1.1 试验材料
本试验所用的团头鲂人工繁殖样品来自湖北省黄冈市百荣水产良种公司。其中,挑选出同一家系中3个年龄段的团头鲂:1龄(性腺未成熟)团头鲂、2龄(性腺初次成熟)团头鲂、3龄(性腺第2次成熟)团头鲂。在不同年龄段中,各选取6尾生长快(fast growth, FG)的和生长慢(slow growth, SG)的团头鲂(雌雄各3尾),其生长数据见图1。鱼体经100 mg/L MS-222(Tricaine methanesulfonate)麻醉后,冰上采集肌肉、性腺组织,液氮速冻后转至-80 ℃保存。
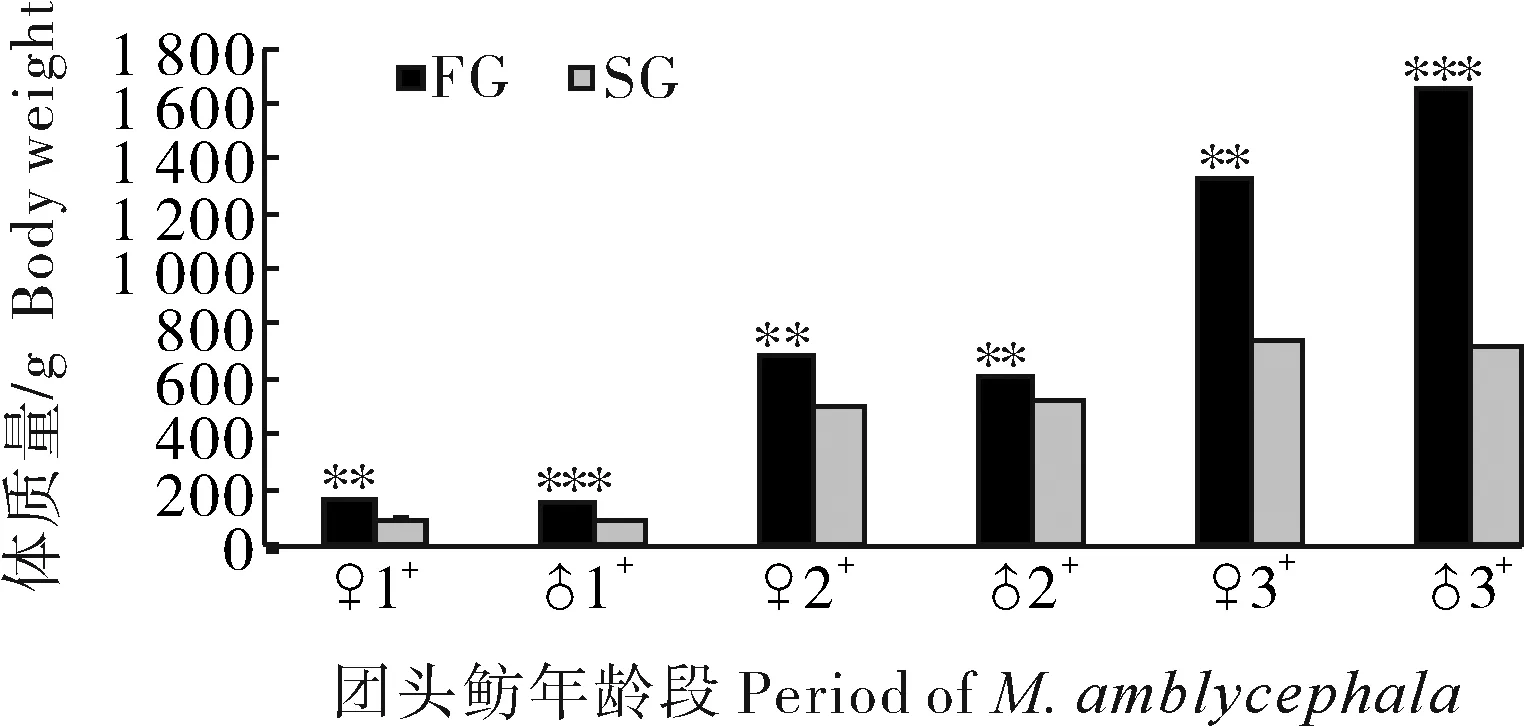
FG代表快速生长组,SG代表慢速生长组;FG和SG之间的显著性差异由*(P<0.05)、 **(P<0.01)、***(P<0.001)表示。FG stands for fast-grow group,SG stands for slow-grow group; the The significant difference between FG and SG is represented by * (P <0.05), ** (P<0.01), *** (P<0.001) respectively.
1.2 总RNA提取及cDNA合成
采用Trizol法(TaKaRa,大连)提取总RNA,并用琼脂糖凝胶电泳和Nano Drop 2000核酸蛋白仪(Thermo,美国)分别检测总RNA完整性和浓度。按照HiScript©Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒(Vazyme,南京)说明书合成cDNA的第一条链,稀释5倍后保存于-20 ℃待用。
1.3 团头鲂ER基因克隆
通过NCBI下载斑马鱼ER基因的cDNA序列,与笔者所在课题组已获得的团头鲂转录组序列进行Blast,获得多个ER基因亚型片段。利用NCBI的primer design tool (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计用于拼接的引物(表1),引物由武汉擎科生物科技有限公司合成。以合成的cDNA为模板进行PCR扩增,电泳检测扩增产物,将条带单一的扩增产物送武汉擎科生物科技有限公司测序。测序获得的目的基因片段用Mega 6.0软件进行拼接,并与斑马鱼基因序列进行比对,确定团头鲂各ER基因亚型的核心序列。

表1 基因克隆引物 Table 1 Primers for gene clone
1.4 团头鲂ER基因分析及进化树构建
通过NCBI的ORF finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)分析团头鲂ERβ1基因的开放阅读框信息。使用ProtPara程序(https://web.expasy.org/protparam/)分析ERβ1的分子质量及等电点等理化性质,同时使用DNAman软件对团头鲂ERβ1基因与其他脊椎动物进行氨基酸序列比对。使用Mega 6.0软件构建ER基因系统进化树。
1.5 qRT-PCR
基于获得的团头鲂ER基因序列信息,利用NCBI的primer design tool设计定量引物(表2),并由武汉擎科生物科技有限公司合成。选择团头鲂β-actin作为内参基因,以团头鲂3个年龄阶段2个组织的cDNA为模板,按照Hieff© qPCR SYBR Green Master Mix(Low Rox)试剂盒(翊圣,上海)说明书进行qRT-PCR反应。

表2 qRT-PCR引物 Table 2 Primers of qRT-PCR
1.6 数据分析
各基因的相对表达水平以2-△△Ct法进行计算,使用SPSS Statistics 22和GraphPad Prism 8软件进行数据分析及作图。采用独立样本t检验进行显著性分析。将P>0.05描述为统计学差异不显著(用“ns”表示),P<0.05描述为统计学差异显著(用“*”表示),P<0.01描述为统计学差异极显著(用“**”表示),P<0.001描述为统计学差异极显著(用“***”表示)。
2 结果与分析
2.1 团头鲂ER理化性质分析
利用同源克隆拼接核心序列,获得了部分团头鲂ERα和ERβ2的CDS(coding sequencing)序列,以及团头鲂ERβ1基因的完整的CDS序列。ProtParam软件预测结果显示,团头鲂ERβ1基因的开放阅读框为1 704 bp,其编码的蛋白质由567个氨基酸残基构成,分子质量为63.75 ku,理论等电点(pI)为7.54,为碱性蛋白。氨基酸残基中Leu(11.6%)、Ser(10.8%)、Pro(6.2%)、Glu(5.8%)、Gly(5.8%)的频率较高,极性氨基酸占59.6%,非极性氨基酸占40.4%(图2)。消光系数(M-1cm-1γ=280 nm)为62.225,其不稳定系数为61.78,属不稳定蛋白。疏水指数为77.72,平均亲水性为-0.30,属可溶性蛋白。
2.2 团头鲂ER同源性分析
使用DNAman软件对人(Homosapiens)、小鼠(Musmusculus)、鸡(Gallusgallus)、团头鲂及其他鱼类ER氨基酸序列进行同源性分析,并使用Mega软件构建系统进化树。结果显示,团头鲂ERβ1蛋白的氨基酸序列与鲤(88.43%)、金鱼(87.37%)和斑马鱼(86.39%)具有较高的同源性,与大西洋鲑(66.72%)、日本青鳉(65.14%)和大黄鱼(62.06%)具有中度同源性,与小鼠(50.96%)、非洲爪蟾(50.87%)、欧亚野猪(50.00%)、鸡(47.99%)和人(46.95%)具有低度同源性(图3)。系统进化树中ERα和ERβ亚型各聚成一类,形成两大分支。团头鲂ER基因各亚型分别与鲤、金鱼和斑马鱼中相应亚型的同源性较高,在进化树中距离最近(图4)。
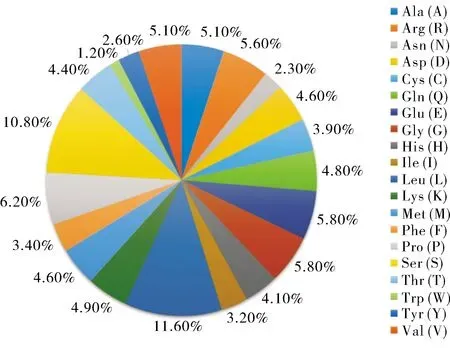
图2 ERβ1氨基酸频率分布图Fig.2 Amino acid frequency distribution of ERβ1

a:鲤Cyprinus carpio; b:金鱼 Carassius auratus; c:斑马鱼 Danio rerio;d:大西洋鲑 Salmo salar;e:日本青鳉 Oryzias latipes;f:大黄鱼 Larimichthys crocea;g:小鼠 Mus musculus;h:非洲爪蟾 Xenopus tropicalis;i:欧亚野猪 Sus scrofa;j:鸡 Gallus gallus;k:人 Homo sapiens.
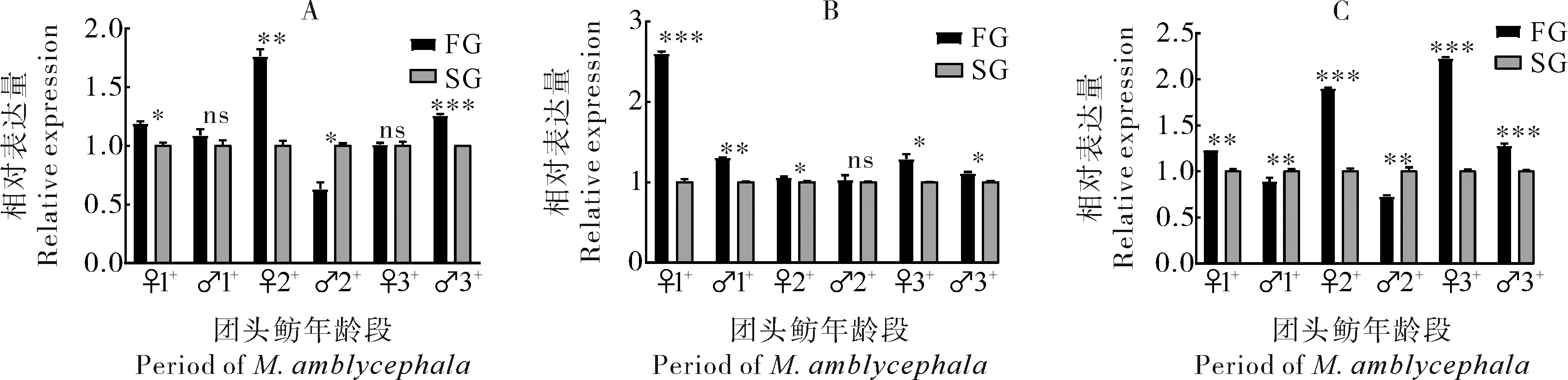
2.3 ER基因在生长快慢个体各组织中的表达
1)雌激素受体基因在肌肉中的表达。在1龄到3龄团头鲂肌肉中,ERα和ERβ1在生长快组(FG)中的表达量整体高于生长慢组(SG)(P<0.05),并且ERα在1龄FG组和SG组团头鲂中的表达量差异比2龄和3龄团头鲂更为明显(P<0.05)。然而,ERβ2在FG组和SG组团头鲂中的表达量差异与ERα和ERβ1相反(P<0.05)。在3龄雄性团头鲂中,ERβ2在FG组中的表达量显著高于SG组(P<0.001)(图5)。
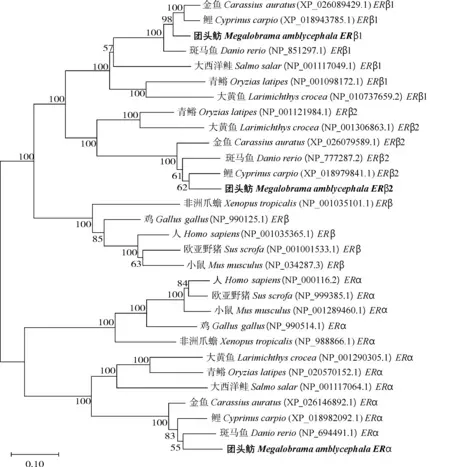
团头鲂ERβ2为部分CDS序列 Megalobrama amblycephala ERβ2 is part of the CDS sequence.图4 基于氨基酸序列的ER基因的系统进化分析Fig.4 Phylogenetic analysis of ER genes based on their amino acid sequences
2)雌激素受体基因在性腺中的表达。在1龄和2龄雌性团头鲂中,雌激素受体基因ERα、ERβ1和ERβ2在FG组的表达量显著高于SG组。在雄性团头鲂中,ERα在1龄FG组的性腺中的表达量高于SG组;在2龄阶段,FG组的性腺中的表达量低于SG;在3龄阶段,FG组的性腺中的表达量高于SG组。1龄和2龄雄性团头鲂性腺中,ERβ2在FG组的表达量显著低于SG组,但在3龄雄性性腺中,ERβ2在FG组的表达量显著高于SG组。
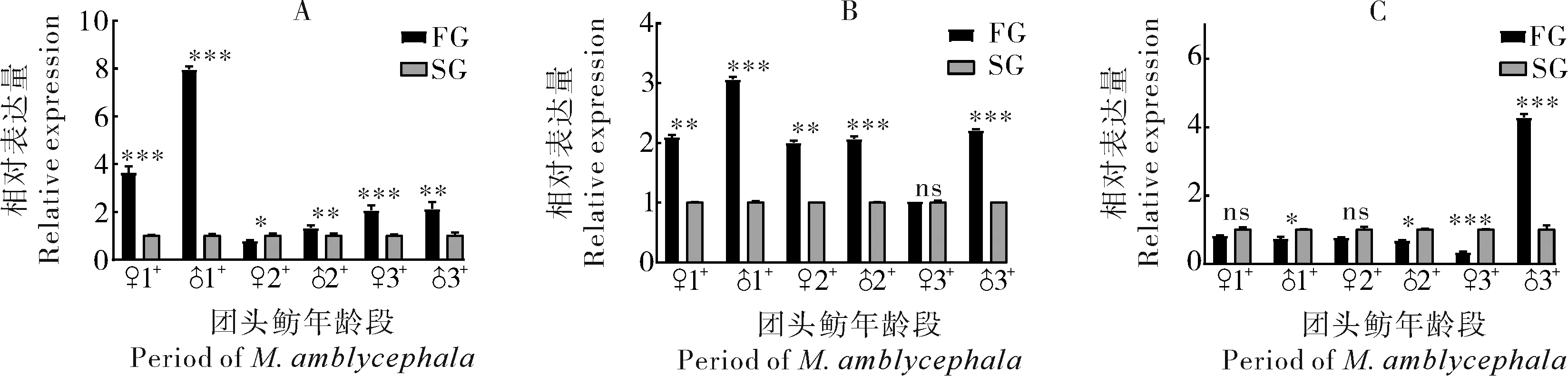
A:ERα,B:ERβ1,C:ERβ2;FG:快速生长组,SG:慢速生长组;FG与SG之间的统计学差异由“ns”(P>0.05),“*”(P<0.05),“**”(P<0.01),“***”(P<0.001)表示。下同。 FG stands for fast-grow group,SG stands for slow-grow group; the significant difference between FG and SG was represented by “ns”(P>0.05),“*”(P<0.05),“**”(P<0.01),“***”(P<0.001),respectively.The same as below.
A:ERα; B:ERβ1; C:ERβ2.图6 雌激素受体基因在性腺中的表达Fig.6 Expression of estrogen receptor genes in the gonad tissue
3 讨 论
同源性在一定程度上反映了物种之间的亲缘关系,本研究中团头鲂ER基因与鲤科鱼类同源性较高,与其他科鱼类次之,与其他脊椎动物同源性较低。说明ER基因同源性高低与物种亲缘关系有关,在亲缘关系接近的物种中具有较高的同源性,奥利亚罗非鱼的同源性比对结果证实了这一推测[11]。本研究中系统进化分析结果表明ERα和ERβ亚型分成2类。ERβ亚型中ERβ1和ERβ2各聚成一类,与张民等[12]对海水青鳉的研究结果一致。
已有研究表明,莫桑比克罗非鱼(Oreochromismossambicus)在性腺切除术后出现生长迟缓的现象,在异位性腺移植后生长恢复[13],表明内源雌激素一定程度上促进了鱼体生长,这种促进作用主要通过ER介导,推测ERs表达上调对于性腺已发育成熟的团头鲂具有一定的促进生长的作用。因此,我们挑选不同年龄阶段中生长快(FG)和生长慢(SG)的团头鲂,检测了雌激素受体基因ERα、ERβ1和ERβ2在肌肉和性腺组织中的表达情况。结果显示,在性腺发育早期(1龄团头鲂),ERα在FG组的性腺和肌肉中的表达量显著高于SG组(P<0.05),但是在FG组和SG组的肌肉中,ERα的表达量差异显著高于在性腺中的表达量差异(P<0.001)。表明在性腺早期发育过程中,ERα更倾向于在生长方面而不是性腺方面发挥作用。在性腺发育成熟时期(2龄团头鲂),ERα在FG组和SG组中的表达量差异在性腺中更明显。该结果表明,在性腺中期发育过程中,ERα更倾向于在性腺发育方面发挥作用;并且ERβ1替代了ERα在生长方面的作用。在性腺发育成熟后(3龄团头鲂),ERα和ERβ1同时在生长方面发挥作用,但是ERβ1只在雄性个体中发挥作用,而ERα在雄性和雌性个体中均发挥作用。此外,ERβ2与ERα、ERβ1的表达结果相反,在性腺发育早期和中期,ERβ2在雄性FG组的肌肉和性腺中表达量显著低于SG组,但是在性腺发育早期的雌性个体中,ERβ2在FG组的性腺中的表达量显著高于SG组,与肌肉中的结果相反(P<0.05)。其结果表明ERβ2的作用与ERα和ERβ1相反,在性腺发育早期和中期,对生长起到抑制作用。因此我们推测,ERα和ERβ1在肌肉组织中的上调可一定程度上促进肌肉生长,而ERβ2的功能可能与ERα、ERβ1存在一定拮抗作用。有研究结果显示,对小鼠使用ERα的激动剂丙吡唑三醇(propylpyrazole triol),可促进糖脂代谢通路中重要基因的表达[14],这表明ERα在生长代谢方面发挥作用。
综上,本研究克隆了团头鲂ER基因的CDS序列,该序列与鲤科鱼类具有较高的同源性。对ERs在团头鲂3个年龄阶段生长快慢个体的肌肉和性腺组织中的表达情况进行分析,结果表明ERs在一定程度上可促进性腺已发育成熟的鱼类生长,对尚未性成熟的鱼类则偏向于促进其性腺发育。同时ERα、ERβ1和ERβ2可能组成一个复杂的调控体系,彼此相互影响,在生长发育过程中共同调节机体生长和性腺发育。
