惰性电子对效应的教学思考
2022-02-15吴孔林叶明富万梅秀王改霞毛清华
张 奎,吴孔林,叶明富,5,万梅秀,王改霞,毛清华,罗 峰
(1.安徽工业大学化学与化工学院,安徽马鞍山 243002;2.暨南大学信息科学技术学院新能源技术研究院,广东广州 510632;3.安徽工业大学数理科学与工程学院,安徽马鞍山 243032;4.东华理工大学化学生物与材料科学学院,江西南昌 330013;5.内蒙古工业大学风能太阳能利用技术教育部重点实验室,内蒙古呼和浩特 010051)
元素的性质是原子序数的周期性函数,这个规律叫做元素周期律。根据元素周期律,我们得到由一百多种元素组织在一起的系统,称之为元素周期系[1-6]。在元素周期系里,随着原子序数的增加,电子在原子的外电子层中依次排布而周期地形成了类似的结构体系。因此,凡是和这种类似结构有关的一切性质都呈现周期性的变化。元素周期系把众多的化学元素及其化合物的知识系统化了,使化学成为一门具有完整体系的科学。元素周期律不仅对化学而且对其他学科如物理学、生物学、地球化学、矿物学和农业科学等的发展均起着指导作用。
但是,随着对元素和化合物研究的深广度增加,特别是近几十年来对重元素和它们的化合物性质的研究表明,元素周期律并不是简单地按一个模式重复,而是表现为复杂的变化规律[4]。对于不同的周期,不仅周期性变化的快慢不同,而且周期性的展现常常显示出一些“例外”。对于某些“反常”现象至今尚未得到满意的解释,这说明我们对于物质世界的认识仍有待于进一步深化。作为一种特殊现象,惰性电子对效应就是一个代表[6-11]。
1 惰性电子对效应
具有价电子层构型为s2p0-6的元素,其s电子对不易参与成键而常形成+(n-2)氧化态的化合物,而其+n氧化态的化合物要么不易形成,要么不稳定(n:族数)。1927年英国科学家西奇维克(Nevil Vincent Sidgwick,1873-1952)最早认识到这种化学现象,并名之为惰性电子对效应[10]。
在同一族中,诸元素s电子对的惰性随原子序数的增加而增强,这在第六周期里表现得特别明显,易以+(n-2)氧化态存在。Tl(I)、Pb(II)和Bi(III)都较Tl(III)、Pb(IV)和Bi(V)稳定,这种特征甚至延伸到汞[金属Hg(0)是稳定的,在自然界能以单质形式存在]。对第ⅢA族元素来说,虽然硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)的三价化合物是重要的,但从上到下,一价化合物越来越稳定。在IIB和IVA、VA族元素中也有类似情况。有人把此种现象归因于所谓惰性电子对效应,它是指一对s价电子不易失去,也不易参与形成共价键。然而惰性电子对这一概念并没有告诉我们某些元素低价态之所以稳定的原因。从有关元素的电离能数据(表1)可以看出,虽然铊(Tl)和铅(Pb)的6s电子分别比铟(In)和锡(Sn)的5s电子稳定(有关的电离能相差约300 kJ·mol-1),但这并不是惰性电子对效应的原因,因为Ga和Ge的4s电子的电离能比上述的6s电子和5s电子的电离能更大,而Ga(Ⅰ)和Ge(Ⅱ)却并不容易得到。
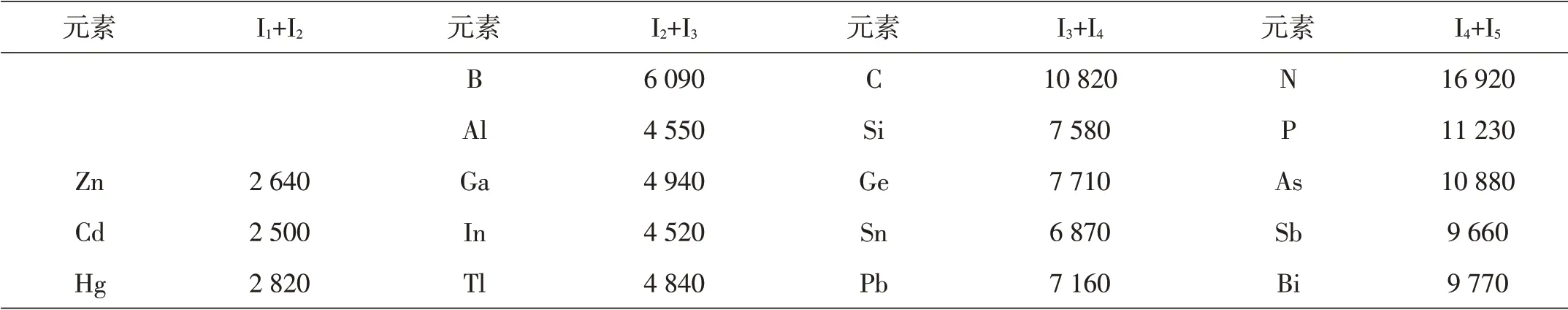
表1 s电子的电离能(kJ·mol-1)
2 惰性电子对效应原因探讨
怎样理解惰性电子对效应呢?对于共价化合物,我们可以从跃迁能和键能来考虑。以CH4为例,CH4比CH2+H2稳定是由于C-H键能大,尽管为生成C(IV)所需的跃迁能很大,但从键能得到了补偿而有余,所以还是生成了CH4。如果有一系列反应:
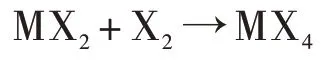
其中的M-X键能逐渐减弱,显然很可能,键能减弱到不足以补偿M[(n-2)价]→M[n价]的跃迁能,这时的MXn-2比MXn更稳定,例如:

人们注意到,PbCl4易分解(除非在低温下)。而由于Br-和I-的还原性,PbBr4和PbI4不能存在。美国化学家Russell S.Drago认为,使重元素键能减弱的原因有两个:①原子半径越大,成键轨道重叠越差;②原子序数越大,成键原子之间内层电子的互斥力越大,特别在过渡元素后的Ga以及Tl与Pb最为显著[9,12]。
对于离子化合物,我们可以从晶格能来考虑。是否存在惰性电子对效应,可用下列反应向右进行的程度来衡量。
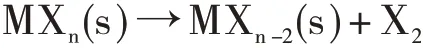
由于晶格能的数据不全或不很精确,我们现在根据有较精确数据的气相反应进行的程度来衡量,这是因为气相反应的变化趋势与固相反应相同。表2列出一些卤化合物(气相)分解反应的焓变。由表2数据可见,虽然所列化合物MXn的分解反应都是吸热的,但对于重元素特别是Tl和Pb,△H的正值较小,分解反应较容易进行。高价态对重元素不稳定的主要原因在于高价态和大原子序数都使键能减弱,这可以从表3至表5清楚地看出。
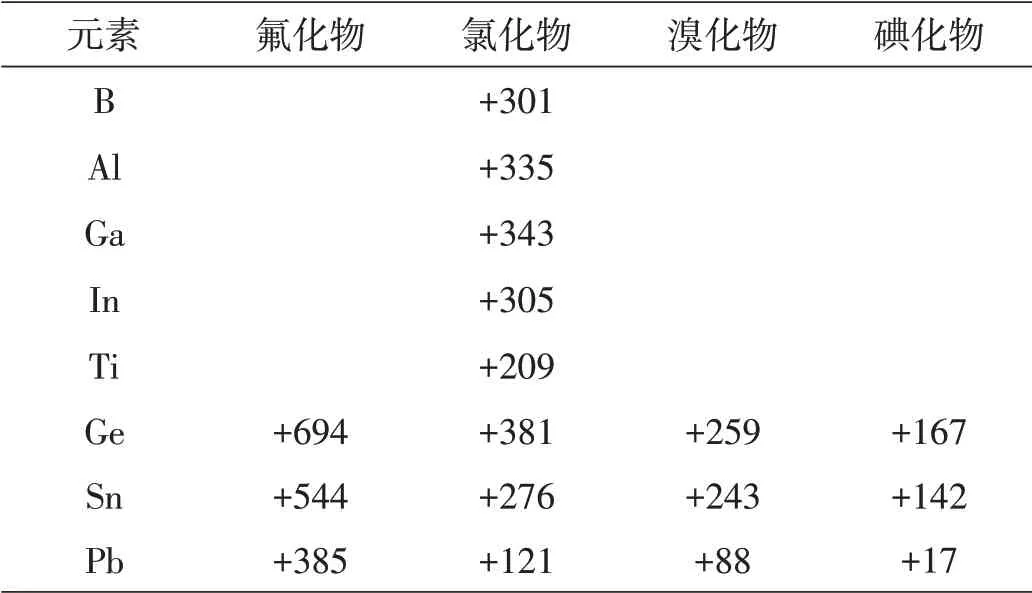
表2 MXn(g)→MXn-2(g)+X 2的焓变(kJ·mol-1)
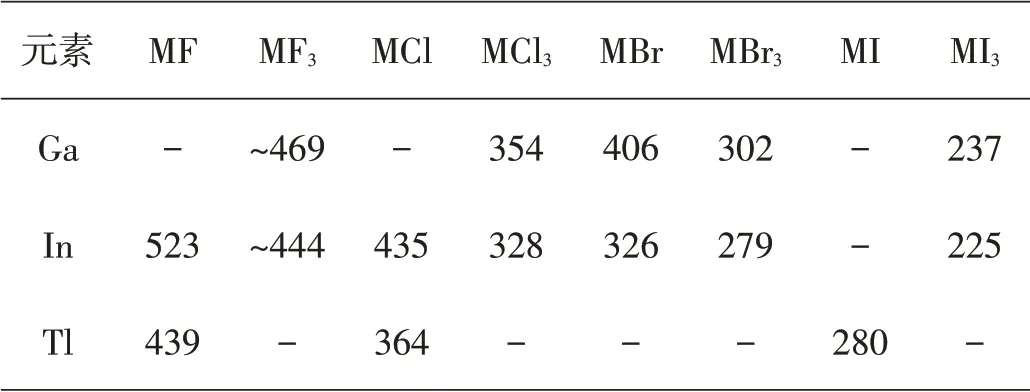
表3 一些IIIA族元素卤化物的键能(kJ·mol-1)
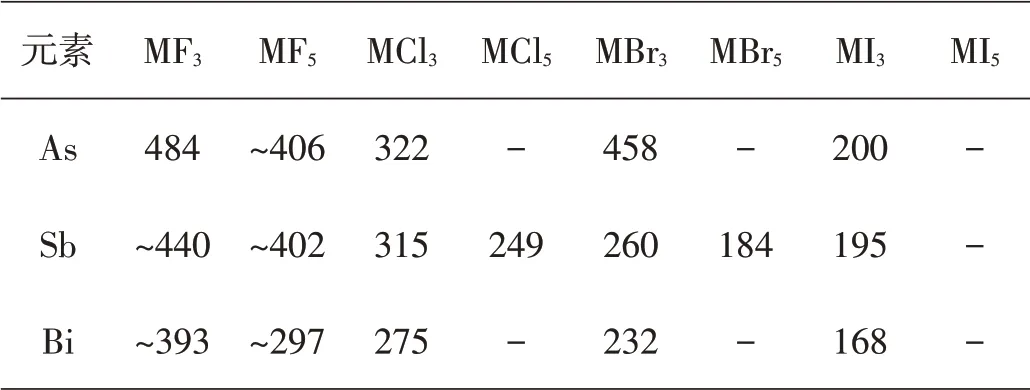
表5 一些VA族元素卤化物的键能(kJ·mol-1)
上述讨论是简化了的情况,因为MX2或MX4是纯离子化合物或纯共价化合物,这种情况是很少有的(几乎可以肯定没有MX4型离子化合物),但大致可以看出高、低价化合物稳定性不同的原因。
惰性电子对效应在每一族的最后一个元素表现得最明显。惰性电子对效应取决于两种能量的平衡情况,一种是移去或激发一个s电子所需要的能量,一种是形成晶格或形成共价键能放出的能量。在镧系元素之后的重元素,由于受到有效核电荷增大的影响,电离能和跃迁能是高的,但不能说整个一族元素从上到下高氧化态总是较不稳定,因为对于镓(Ga)和铟(In)及锗(Ge)和锡(Sn)来说,从Ga到In或Ge到Sn,晶格能较小或键能较小在In(III)和Sn(IV)化合物中的影响,可以被In和Sn的电高能或跃迁能分别比Ga和Ge为低所抵消。因此,Ga与In及Ge与Sn,高氧化态的稳定性差别不是很大,这从表1和表4中的数据也可以看出。而对于铟(In)与铊(Tl)及锡(Sn)与铅(Pb)来说,情况就不同了,从In到TI或从Sn到Pb,在晶格能或键能大幅度减小的同时,电离能或跃迁能反而明显地升高了。这就使Tl和Pb高氧化态的稳定性要比In和Sn差得多,正如同在第IIB族中锌(Zn)与镉(Cd)的差别不大,而汞(Hg)与Zn、Cd的差别就大不一样。含汞化合物容易分解出汞单质,说明汞也明显地呈现所谓的情性电子对效应。
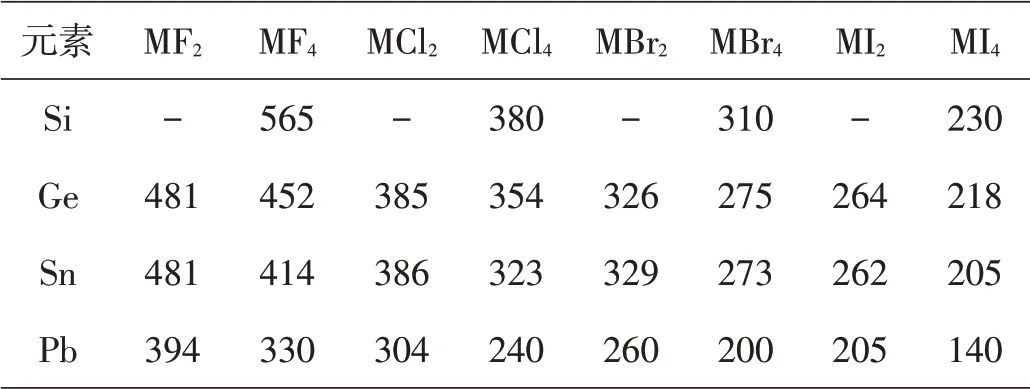
表4 一些IVA族元素卤化物的键能(kJ·mol-1)
其他科技工作者从电子云的钻穿效应、有效核电荷、镧系收缩效应、重元素的相对论性收缩等多个角度对惰性电子对效应的本质作了分析,得出了一些有益的结论,但还有待于进一步的研究[5,10-14]。
3 结束语
元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,从自然科学上有力地论证了事物变化的量变引起质变的规律性。但是周期系中并不是全部元素的所有性质都是有规则的递变,对于某些“反常”现象至今尚未得到满意的解释,这说明我们对于物质世界的认识仍有待于进一步深化。通过惰性电子对效应这一特殊反常现象的课堂教学,不仅培养了学生提出问题、分析问题、解决问题的能力,使同学们综合归纳能力得以提高,同时有利于学生形成辩证唯物主义世界观。
