漂洗对罗非鱼鱼糜凝胶特性的影响
2022-02-15姜鹏飞于文静朱凯悦赵文宇郑杰孙娜
姜鹏飞,于文静,朱凯悦,赵文宇,郑杰,孙娜*
(1.大连工业大学 食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034;2.辽宁省海洋水产科学研究院,辽宁 大连 116023)
罗非鱼(Oreochromis niloticus),通常生活于淡水中,适应性强,大多数是杂食性的。罗非鱼因具有生长快、繁殖量大、容易养殖、产量高四大特点,已经成为世界各国重要的淡水养殖鱼类[1]。据联合国粮农组织统计,2019年我国罗非鱼产量为164.17万吨[2]。我国主要出口罗非鱼的初级加工产品,产品形式单一,价格低廉。因此,我国应发展消费者青睐的罗非鱼产品,如鱼糜制品[3],以此来扩大国内市场,满足不同群体的消费需求。
近年来,鱼糜的营养价值被越来越多的消费者认可,在国际市场上的消费量不断增加。随着我国冷冻鱼类食品行业的发展,鱼糜制品取得了良好的进展。未漂洗鱼糜生产技术既能保留鱼肌肉中的营养和风味物质,又能实现节能减排。然而,我国淡水鱼糜生产加工中存在着未漂洗鱼糜凝胶强度差、凝胶易劣化等问题,所以漂洗工艺必不可少,漂洗可降低水溶性蛋白的含量,显著提高盐溶性蛋白相对含量,提高鱼制品弹性和持水性。此外,漂洗可以去除污物、血液、脂质、无机盐成分和一些含氮化物等杂质[4],从而改善鱼糜的颜色和风味,同时漂洗还可以改善鱼糜的质构特性[5]。因此,以罗非鱼为研究对象,将常规漂洗工艺鱼糜与未漂洗鱼糜进行比较,并利用物性学、流变学、低场核磁共振技术、显微成像技术等研究方法,研究漂洗对罗非鱼鱼糜凝胶特性的影响。
1 材料和方法
1.1 材料与试剂
冷冻罗非鱼:海南翔泰渔业有限公司,于-18℃冷库冷冻保存。
氯化钠、无水乙醇、醋酸(均为分析纯):大连博诺有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacryl amide gel electrophoresis,SDS-PAGE)试剂盒、十二烷基硫酸钠(分析纯):北京宝希迪有限公司。
1.2 仪器与设备
斩拌机(MJ-LZ225):美的集团股份有限公司;测色仪(UltraScan PRO):美国 HunterLab公司;物性仪(TA.XT.plus):英国 Stable Micro Systems公司;核磁共振成像分析仪(MesoQMR23-060H):苏州纽迈电子科技有限公司;流变仪(Discovery HR-1):常州德杜精密仪器有限公司;傅里叶变换红外光谱仪(FTIR-650S):铂金埃尔默仪器有限公司;热场发射扫描电镜(JSM-7800F):日本电子株式会社;电泳仪(AE-8135):日本ATTO公司。
1.3 试验方法
1.3.1 样品处理方法
1.3.1.1 未漂洗罗非鱼鱼糜的制备
冷冻罗非鱼于4℃的冷藏冰箱缓化12 h,去头、尾、皮,采肉,将鱼肉洗净并沥干水分,使用斩拌机将罗非鱼肉进行第一次斩拌5 min,加入3%的氯化钠溶液,再进行第二次斩拌5 min,使鱼肉中的盐溶性蛋白充分溶出。控制制备温度低于10℃。
1.3.1.2 漂洗鱼糜的制备
使用绞肉机将未漂洗罗非鱼鱼糜斩拌5 min,用3倍体积的冰水漂洗3次,每次5 min(最后一次冰水中放入0.3%氯化钠溶液),漂洗后倒掉废液,向脱水后的碎肉中加入3%的氯化钠溶液并斩拌5 min,使鱼肉中的盐溶性蛋白充分溶出。斩拌过程控制温度低于10℃。
1.3.1.3 罗非鱼鱼糜的制备
将斩拌好的肉泥挤入肠衣中,用棉线封口后采用两段加热法进行熟制。首先在40℃下加热30 min,使鱼糜蛋白充分凝胶化,然后90℃下加热20 min。将加热完成的鱼糜取出,置于冰水中冷却至室温(25℃),4℃冰箱中放置12 h,以备后续试验。
1.3.2 白度的测定
采用测色仪对直径2.5 mm、高2.5 mm的样品色度进行测定,计算其白度值,每组样品平行测定3次[6],计算公式如下。
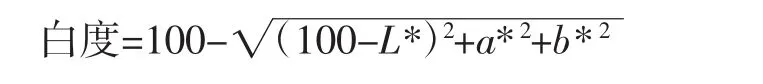
式中:L*为明暗度;a*为红绿度;b*为黄蓝度。
1.3.3 持水率(water holding capacity,WHC)测定
参照Mao等[7]方法,称取样品5 g,用滤纸将其包裹,在6 500 r/min、10℃条件下离心10 min,每组样品测定4次,取平均值。计算公式如下。

式中:W0为样品的原始质量,g;W1表示样品离心后的质量,g。
1.3.4 低场核磁共振(low field nuclear magnetic resonance,LF-NMR)测定
LF-NMR测定参考Pan等[8]的方法进行修改,大约4 g样品放入直径40 mm核磁管,而后放入仪器中。自旋-自旋弛豫时间T2用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量,所使用参数:90℃脉冲时间所对应的P1为23 μs,180℃脉冲时间所对应的P2为44 μs,采样带宽SW为100 kHz,重复采样等待时间TW为3 000,回波个数NECH为10 000,利用核磁共振弛豫时间反演拟合软件得到T2图像。
1.3.5 核磁共振成像(magnetic resonance imaging,MRI)测定
MRI测定参考臧秀等[9]方法进行修改,采用变温核磁共振成像分析仪,利用多层自旋回波(spin echo,SE)序列对罗非鱼鱼糜进行核磁共振成像,弛豫时间T1和横向弛豫时间T2加权成像。参数设置:层数为6,视野Fov为100 mm×100 mm,层厚为0.9 mm,层间隙为1.9 mm,尺寸为256,像素为192,扫描次数为 2,T1加权成像的重复时间为200 ms,回波时间为20 ms,T2加权成像的重复时间为2 000 ms,回波时间为200 ms。1.3.6 质地剖面分析(texture profile analysis,TPA)
TPA参考Jiao[10]的方法稍作修改,样品直径2.5 cm、高2.5 cm,选用P50探头,测试参数为测前速度1 mm/s,测试速度1 mm/s,测后速度1 mm/s,下压比例50%,触发力5 g,2次压缩间隔时间5 s,每个样品测6次,取平均值。
1.3.7 凝胶强度测定
将样品切成直径2.5 cm、高2.5 cm的圆柱形,选取P/5S球形探头进行测试,设置测试条件为测前速度1 mm/s,测试速度 1 mm/s,测后速度 1 mm/s,下压比例50%。每组试验重复6次,取平均值。
1.3.8 流变特性测定
流变特性测定参照黄颖等[11]的方法,夹具直径选择20 mm,平板之间间距2.0 mm。采用变温扫描:设置温度从25℃升温到40℃,在40℃保持30 min,然后从40℃升温到90℃,在90℃保持20 min,升温速率为1℃/min,测定频率扫描过程中储能模量(G′)和损耗模量(G″)的变化。
1.3.9 傅里叶红外光谱(Fourier infrared spectroscopy,FTIR)分析
FTIR分析根据Moreno等[12]的方法,使用傅里叶红外光谱仪,收集400 cm-1~4 000 cm-1之间的光谱。测试后,对光谱数据进行傅里叶去卷积,并使用多重高斯曲线拟合及二阶导数计算。根据其相应峰面积的相对百分比,计算出不同二级结构的组成,使用软件OMNIC 8.2.0.387分析记录光谱。
1.3.10 扫描电子显微镜 (scanning electron microscope,SEM)
样品切成1 cm×1 cm×5 mm,将其浸入2.5%戊二醛溶液,在4℃条件下固定24 h,固定好后将样品放入真空冷冻干燥机冻干24 h,干燥后将样品固定在样品台上,表面喷金,最后在×5 000倍数扫描电子显微镜下观察并成像。
1.3.11 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacryl amide gel electrophoresis,SDS-PAGE)分析
准确称取2.0 g样品,加入18 mL的5%十二烷基硫酸钠溶液,10 000 r/min均质1 min,置于85℃水浴锅加热 1 h,离心(10 000×g,室温 25℃,30 min)提取上清液,然后用双缩脲溶液将蛋白浓度调为5 mg/mL,备用。采用15%分离胶和4%浓缩胶进行电泳试验,全程电压310 V。染色液采用考马斯亮蓝-R250,采用500 mL乙醇和90 mL醋酸定容到1 L为脱色液[13]。
1.4 统计分析
使用软件Origin 8.6作图,通过软件SPSS 20.0对数据进行统计分析。
2 结果与分析
2.1 漂洗对罗非鱼鱼糜白度的影响
未漂洗鱼糜和漂洗鱼糜的白度值如图1所示。
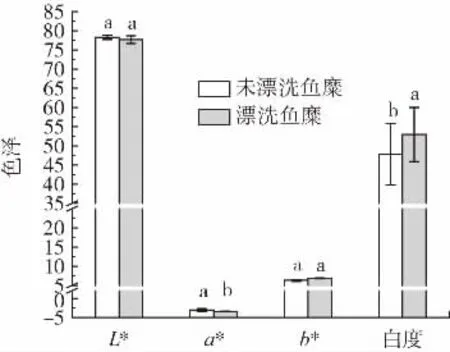
图1 漂洗对罗非鱼鱼糜白度的影响Fig.1 Effect of rinsing on the whiteness of tilapia surimi
白度是评价鱼糜的一项重要指标,由图1所示,未漂洗鱼糜和漂洗鱼糜在L*值和b*值上没有显著差异,未漂洗鱼糜的a*值略微高于漂洗鱼糜,白度值结果表明漂洗鱼糜(52.95±7.07)和未漂洗鱼糜(47.81±8.06)有显著差异(P<0.05)。原因是漂洗可以尽可能去除鱼糜中的肌红蛋白、血红素和脂质等物质,因此漂洗鱼糜的白度值优于未漂洗鱼糜。也可能因为未漂洗鱼糜中的色素发生热变性,进一步导致浑浊[14],而漂洗后可以去除有色物质,从而获得色白、富有弹性的鱼糜制品[15]。另一方面,可能因为漂洗鱼糜凝胶强度好,形成较好的网络结构,增加了光的散射,因此白度较大[5]。
2.2 漂洗对罗非鱼鱼糜持水力的影响
未漂洗鱼糜与漂洗鱼糜持水率的比较结果如图2所示。
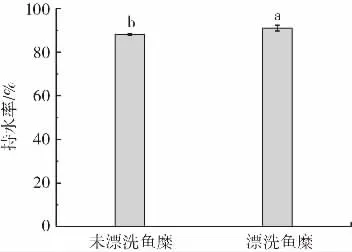
图2 漂洗对罗非鱼鱼糜持水率的影响Fig.2 Effect of rinsing on water holding capacity of tilapia surimi
持水率可以反映鱼糜凝胶保持水分的能力,是鱼糜和鱼糜制品的一个重要参数。持水率越高,表示更多的水被结合或者保留在鱼糜凝胶网络中[16]。由图2所示,漂洗之后可以使鱼糜凝胶的持水率得到明显的改善,达到了91.06%,与未漂洗组鱼糜凝胶的持水率(88.13%)相比差异显著(P<0.05)。其原因可能是漂洗鱼糜的凝胶网络结构较致密,能够捕获更多的水分,其持水性更好[17]。
2.3 漂洗对罗非鱼鱼糜水分分布和组成的影响
未漂洗鱼糜与漂洗鱼糜的T2弛豫特性和鱼糜水分分布如图3所示。

图3 漂洗对罗非鱼鱼糜水分分布和组成的影响Fig.3 Effect of rinsing on water distribution and composition of tilapia surimi gel
利用低场核磁共振技术观察鱼糜水分分布从而预测鱼糜的保水性和凝胶强度[18]。由图3所示,经过反演之后试验结果显示共有3个峰,包括T21、T22和T23,分别对应着结合水、不易流动水和自由水。结合水的弛豫时间最短,范围在0.02 ms~1.5 ms;不易流动水的弛豫时间范围在20 ms~500 ms,并且氢质子的振幅最高;自由水的弛豫时间范围在800 ms~1 500 ms。
3种水分状态分别对应弛豫峰P21、P22和P23的峰面积比例,结果如表1所示。

表1 罗非鱼鱼糜的T2弛豫峰峰面积比例变化Table 1 Ratio of T2relaxation peak area of tilapia surimi
由表1可得这两种试验组的P21弛豫峰峰面积不存在显著性差异,并且P21弛豫峰所占的比例几乎可以忽略,对鱼糜凝胶水分分布的影响极小。变化最明显的是P22弛豫峰峰面积,漂洗试验组的不易流动水含量较高,表明漂洗组的凝胶网络更致密、有序。P23弛豫峰峰面积显示未漂洗组的自由水含量较高,可能是因为部分不易流动水转化为自由水。
2.4 漂洗对罗非鱼鱼糜凝胶水质子密度(伪彩色图像)的影响
未漂洗鱼糜与漂洗鱼糜的T1和T2加权成像图如图4所示。
MRI具有快速、无损、结果准确的优点[19],利用核磁共振成像观察鱼糜的水质子密度,可以为食品原料选择和加工提供参考。红色区域越大,说明水分含量越多,相反水分含量越少蓝色区域越明显。由图4所示,在T1和T2加权成像中均显示未漂洗鱼糜比漂洗鱼糜的红色区域减少,并且可以由图4C看出未漂洗鱼糜的体积减小,图像中呈现的孔洞越大,说明未漂洗鱼糜水分散失越多,水分保持较差。

图4 漂洗对罗非鱼鱼糜水质子密度(伪彩色图像)的影响Fig.4 Effect of rinsing on seed density(false color image)of tilapia surimi
2.5 漂洗对罗非鱼鱼糜质构的影响
未漂洗鱼糜与漂洗鱼糜质构测定结果如表2所示。

表2 漂洗对罗非鱼鱼糜质构的影响Table 2 Effect of rinsing on texture of tilapia surimi
质构特性是鱼糜制品中感官评价标准之一,可以表示鱼糜品质的鲜度,也是重要的感官评价指标之一。硬度是指样品第一次挤压后的最大变形值,咀嚼性代表鱼糜凝胶咀嚼的难易程度,一般可作为硬度值的补充参数[20],弹性代表受挤压的样品去掉挤压力后恢复原样的能力,黏聚性是指样品经过第一次挤压形变后抵抗第二次挤压的能力[21]。凝胶回复性是指样品经第一次挤压后回弹的能力。如表2所示,在硬度和咀嚼度方面,未漂洗鱼糜[(3 615.5±129.81)g和2 199.9±182.07]显著高于漂洗鱼糜[(2 469.78±87.18)g和1 824.63±81.25]。在弹性方面,漂洗鱼糜和未漂洗鱼糜有显著差异。在黏聚性和回复性方面,漂洗鱼糜均高于未漂洗鱼糜。一般来说黏聚性越强,则鱼糜抵抗能力越强,鱼糜产品的内聚性越好[5],其内部凝胶结构结合更强。质构是一个较为综合的参数,通过质构仪中的探头来模拟人类口腔咀嚼食物,从而减少在进行感官评价时产生的个体差异,因此综合5个指标来看,漂洗鱼糜能够较好地提升罗非鱼鱼糜的质构特性。
2.6 漂洗对罗非鱼鱼糜凝胶强度的影响
未漂洗鱼糜与漂洗鱼糜的破断力、破断距离和凝胶强度的试验结果如图5所示。
凝胶强度是破断力和破断距离的乘积,反映了蛋白质的聚集能力,是衡量鱼糜制品凝胶特性的重要指标[22]。由图5所示,漂洗鱼糜的破断力、破断距离和凝胶强度分别为(304.57±10.28)g、(12.6±0.26)mm 和(3 839.3±184.28)g·mm,显著高于未漂洗鱼糜(237.51±2.6)g、(6.68±0.05)mm 和(1 585.54±45.85)g·mm(P<0.05),证明经过漂洗后,鱼糜凝胶的凝胶性能得到了明显改善,漂洗鱼糜肉质更嫩,富有弹性,咀嚼时更加细腻。

图5 漂洗对罗非鱼鱼糜凝胶强度的影响Fig.5 Effect of rinsing on gelation properties of tilapia surimi
2.7 漂洗对罗非鱼鱼糜流变性质的影响
罗非鱼鱼糜流变性质如图6所示。
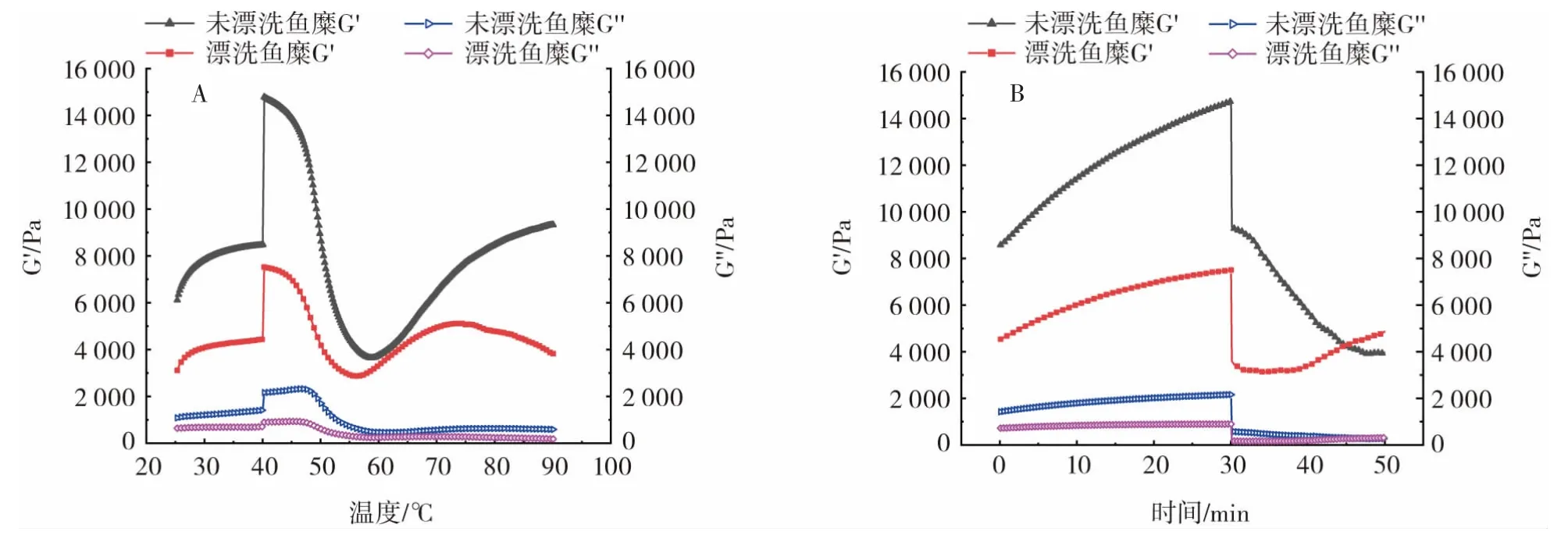
图6 漂洗对罗非鱼鱼糜流变性质的影响Fig.6 Effect of rinsing on rheological properties of surimi of tilapia
对未漂洗鱼糜与漂洗鱼糜在40℃~90℃区间内鱼糜样品进行温度扫描。鱼糜凝胶的流变学评价主要包括鱼糜储能模量(G′)、损耗模量(G″),G′代表鱼糜凝胶的弹性特性,G″代表鱼糜的黏性特性。它是食物蛋白热诱导凝胶形成能力的良好指标,可以较好地评价在升温过程中鱼糜肌原纤维蛋白的动态流变行为。如图6A所示,主要变化为:第一阶段在25℃~40℃,G′迅速增加,随后在40℃~60℃急速下降,之后在60℃~90℃未漂洗鱼糜上升,漂洗鱼糜在70℃~90℃又呈现下降趋势。刚开始损耗模量G′上升可能是由受热展开的蛋白与水的作用增强而导致的[23]。由图6B所示,在40℃恒温30 min时,漂洗鱼糜与未漂洗鱼糜G′均呈上升趋势,且未漂洗鱼糜要高于漂洗鱼糜,这可能是由于在相对较低的加热温度范围内,鱼糜蛋白处于溶胶状态,蛋白质结构保持的较为完整,很少聚合成网络结构,之后升高温度,在90℃保持20 min时,漂洗鱼糜的G′开始缓慢升高,而未漂洗鱼糜的G′开始下降,并在恒温第15 min时交叉,最终未漂洗的损耗模量G′为3 959.41 Pa,而漂洗之后变为4 867.94 Pa,提高了22.95%,说明漂洗之后可能加强了鱼糜蛋白与水的作用力,促进了蛋白分子的交联和内部网络结构的形成,从而提高了鱼糜的流变特性[24]。而未漂洗鱼糜损耗模量下降可能是因为蛋白分子展开与聚集程度增强,结构发生重排,形成凝胶结构,因而增强了其刚性与强度,减弱了流动性,最终使得损耗模量下降[25]。
2.8 漂洗对罗非鱼鱼糜二级结构的影响
未漂洗鱼糜与漂洗鱼糜的二级结构如图7所示。
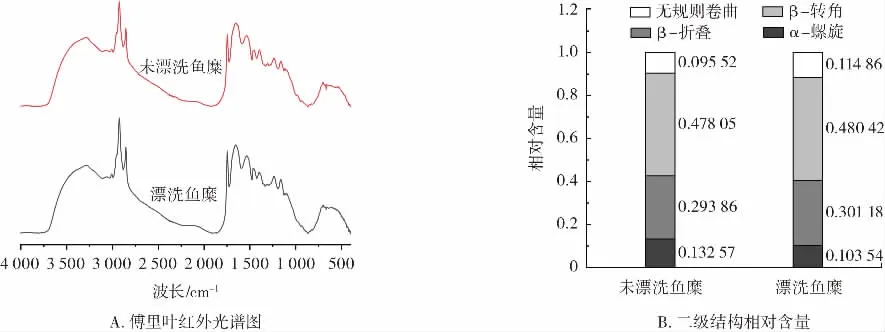
图7 漂洗对罗非鱼鱼糜二级结构的影响Fig.7 Effect of rinsing on secondary structure of tilapia surimi
利用傅里叶红外光谱仪分析漂洗对罗非鱼鱼糜凝胶蛋白构象的影响,通过计算测定二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲结构的含量。如图7B所示,漂洗鱼糜的α-螺旋含量比未漂洗鱼糜低,而其β-转角、β-折叠以及无规则卷曲结构均比未漂洗鱼糜的含量高,表明漂洗使鱼糜蛋白的二级结构发生变化,在凝胶化过程中鱼糜蛋白的紧密的螺旋结构向其他状态转变,有利于蛋白质疏水性基团的暴露,从而提高鱼糜的凝胶强度[26]。Zhou等[27]研究证明α-螺旋结构的减少和β-折叠结构的含量的增加,可以使鱼糜凝胶的凝胶强度增加。这可能是由于β-折叠结构的表面积较大,而水化强度较弱,有利于蛋白质-蛋白质交联,形成凝胶网络结构[28]。
2.9 漂洗对罗非鱼鱼糜微观结构的影响
未漂洗鱼糜与漂洗鱼糜的微观结构如图8所示。

图8 漂洗对罗非鱼鱼糜微观结构的影响Fig.8 Effect of rinsing on the microstructure of tilapia surimi
利用热场扫描电镜放大5 000倍,得到漂洗鱼糜与未漂洗鱼糜凝胶表层的扫描电镜结果。扫描电镜应用广泛,常用在食品科学、生物学、植物学等领域,用于研究各类样品的表面型貌,从而辅助内在机理的探究观察。由图8所示,未漂洗鱼糜凝胶表面网格结构疏松,粗糙不平,孔隙大小不一,分布不均匀。漂洗之后鱼糜凝胶网络结构变得完整减少了断裂,蛋白质之间相互交联起来,表面变得光滑平整,使得鱼糜凝胶的网络结构得到加强,从而使得凝胶强度得到提升。Priyadarshini等[14]研究结果表明漂洗鱼糜的致密性可以解释为盐溶性鱼糜蛋白的展开可能暴露了反应基团,导致加热变性,这些反应基团主要通过疏水相互作用形成了致密的三维网络结构,从而增强其凝胶强度。
2.10 漂洗对罗非鱼鱼糜SDS-PAGE电泳图谱的影响
未漂洗鱼糜与漂洗鱼糜SDS-PAGE电泳图谱如图9所示。
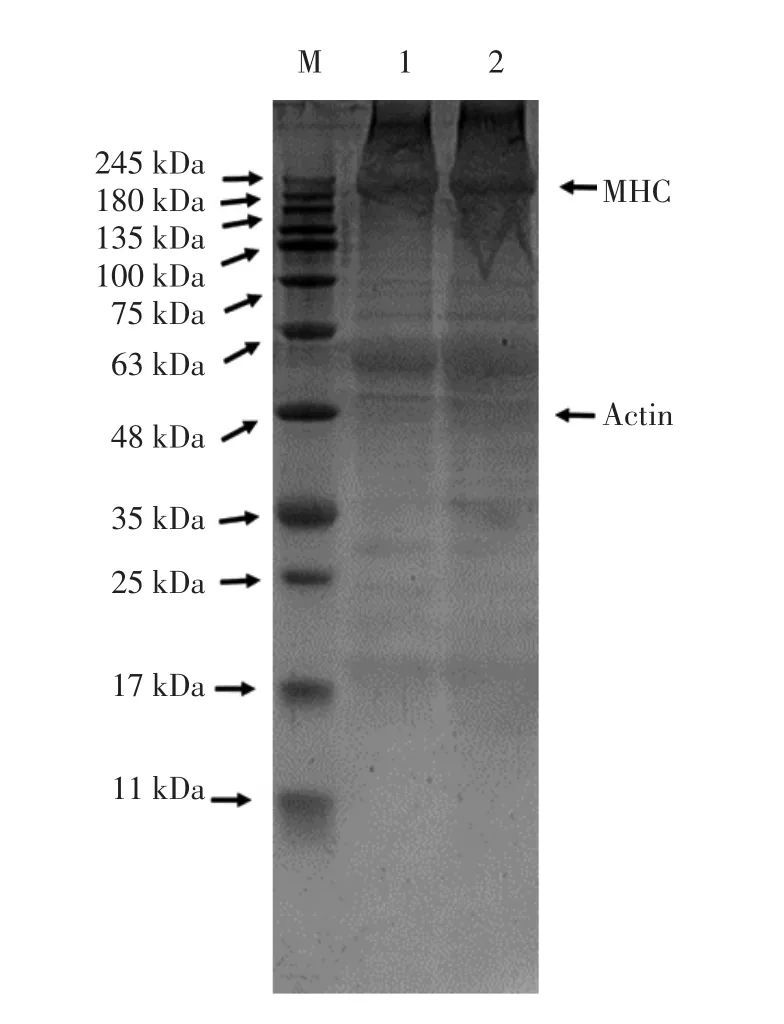
图9 漂洗对罗非鱼鱼糜SDS-PAGE图谱的影响Fig.9 Effect of rinsing on SDS-PAGE pattern of tilapia surimi
蛋白质主要为肌球蛋白重链 [myosin heavy chain,MHC(200 kDa)]和肌动蛋白(Actin,48 kDa)[29-30]。由图 9可以观察到漂洗鱼糜与未漂洗鱼糜Actin带未发生明显变化,可能是因为肌动蛋白(Actin)的构象相对稳定。与未漂洗鱼糜相比,漂洗鱼糜的肌球蛋白重链(MHC)显示出更轻的条带,这是因为洗涤后可减少可溶性肌球蛋白的数量,可以去除洗涤后的鱼糜中的可溶性肌球蛋白。此外35kDa以下蛋白质条带较少,说明漂洗鱼糜蛋白以较大分子聚集交联为主[31]。因此,漂洗处理会导致罗非鱼鱼糜肌原纤维蛋白分子之间发生一定程度的交联和聚集,形成分子质量大的聚集体。
3 结论
漂洗能够有效地改善罗非鱼鱼糜的凝胶特性。与未漂洗鱼糜相比,漂洗鱼糜的白度值由原来的47.81提高到52.95,持水率提高到91.06%,凝胶强度达到了3 839.3 g·mm。流变特性中表明漂洗鱼糜使最终储能模量达到4 867.94 Pa,提高了22.95%。蛋白质二级结构表明漂洗之后鱼糜蛋白的α-螺旋降低,β-折叠增加,有利于形成凝胶网络结构,并且漂洗之后的微观结果显示结构较致密,孔隙较少且光滑均匀,凝胶强度得到较好的提升。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图谱中表明经过漂洗之后肌球蛋白重链条带变淡,说明漂洗工艺可使鱼糜蛋白之间发生交联与聚集。综上,漂洗工艺可用于改善罗非鱼鱼糜凝胶品质。
