基于Wnt/β-catenin信号通路探讨阿魏酸对大强度力竭运动大鼠软骨细胞损伤的保护作用
2022-02-14王洲付燕王莉
王洲 付燕 王莉
(1西南民族大学,四川 成都 610041;2四川省人民医院)
骨关节炎(OA)是软骨细胞和基质退行性改变的一种骨关节疾病,主要以关节疼痛、积液渗出、活动受限为主要的临床特点〔1~3〕。研究发现长期大强度训练会增加OA风险,运动员在大强度训练时引起的骨关节炎,不仅影响竞技状态及比赛成绩,甚至会出现关节畸形或致残〔4〕。软骨细胞是关节内合成分泌的重要细胞,能够调控关节内环境的稳定性,当关节内环境紊乱时,软骨细胞识别异常作出应答,调整细胞外基质的合成,保持关节内环境的稳定〔5〕。Wnt/β-catenin是机体内重要的信号通路,广泛参与多种细胞的生命活动,如组织分化、损伤再生、细胞内环境维持、抗应激损伤等〔6〕。研究表明Wnt/β-catenin通路的激活影响软骨细胞的增殖、分化、移行,在维持骨关节的正常结构、修复损伤过程中Wnt/β-catenin通路起重要的作用〔7〕。阿魏酸(FA)是从植物细胞壁提取的低毒、多酚类化合物,具有抗氧化、抗血栓、抗炎症、抗血脂等作用,具有强大的抗炎、修复、治疗作用,广泛应用于医药领域和食品领域〔8〕。本研究从Wnt/β-catenin信号通路入手探讨FA对OA软骨细胞的保护作用。
1 材料和方法
1.1试验材料及主要试剂 FA、Ⅱ型胶原酶购自Sigma公司;胰蛋白酶、DMEM培养基、Ⅱ型胶原抗体购自武汉博士生物工程有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒化学发光试剂盒购自广东锐博生物科技技术股份有限公司;兔抗基质金属蛋白酶(MMP)13、兔抗大鼠wnt2、兔抗大鼠磷酸化GSK-3p(p-GSK-3p)、Ser9抗体、兔抗β-catenin、兔抗GAPDH及山羊抗兔免疫球蛋白(Ig)G购自美国Abcam公司。
1.2实验动物及分组 清洁级雄性SD大鼠,大鼠体重(210±20)g,购自军事医学科学院实验动物中心,动物合格证号:SCXK(京)2003-1-003。大鼠进食标准饲料,自由饮水。室温20~23℃,相对湿度45%~50%,光照时间为12 h/d。参照随机数字表分为空白组、模型组、低剂量组、高剂量组。
空白组给予1 ml生理盐水腹腔注射后安静休息;模型组腹腔注射1 ml生理盐水,1 h后将大鼠放在(32±1)℃水温的桶内,进行一次尾部负重3%体重重物的游泳力竭运动;低剂量组腹腔注射FA溶液(5 μmol/ml),1 h后进行1次力竭运动,运动方式同模型组;高剂量组腹腔注射FA溶液(20 μmol/ml),1 h后进行1次力竭运动,运动方式同模型组。参考Thomas等〔9〕力竭标准:大鼠连续沉入水中超过10 s不能浮出或大鼠无法协调运动且伴随无方向性乱窜,以存活大鼠为实验对象。本研究中动物处置方法均符合动物伦理学标准。
1.3软骨细胞分离培养及鉴定 从各组大鼠膝盖中取软骨细胞,0.25%胰蛋白酶消化,37℃消化30 min,弃去胰蛋白酶,加入DMEM培养基过夜,1 200 r/min离心10 min,弃上清,加入DMEM培养基混匀,置于37℃恒温箱中,37℃,5%CO2培养传代。鉴定:细胞制成爬片,二甲苯和梯度乙醇脱蜡后置于柠檬酸盐缓冲液中进行修复,以充分暴露抗原决定簇。3%的过氧化氢室温下浸泡10 min,封闭,分别加稀释好的一抗4℃过夜孵育,次日冲洗干净,加入适量生物素标记的二抗室温孵育30 min,清洗。加适量二氨基联苯胺四盐酸盐(DAB)作用2~5 min后用去离子水终止反应,苏木素复染1.5~2 min,清洗后于梯度乙醇中脱水,二甲苯浸泡并干燥后用中性树胶封片,镜检观察并记录实验结果。
1.4透射电镜观察大鼠膝关节软骨超微结构的形态学变化 取膝关节股骨内侧髁关节软骨组织(大小1 mm×1 mm×1 mm),使用2.5%戊二醛,于4℃下固定6 h后,用磷酸盐缓冲液(PBS)洗30 min,1%锇酸固定1 h。参考文献方法〔10〕进行乙醇梯度脱水、纯环氧树脂包埋及烘干固化。采用LKB-NOVA型切片机进行超薄切片(片厚70 nm),蒸馏水冲洗后,分别放入醋酸铀饱和水溶液和枸橼酸铅染液中染色30 min,蒸馏水反复清洗后,干燥,最后用日产JEM-1230型透射电镜观察摄片。
1.5CCK-8法检测软骨细胞的增殖率 取对数期的软骨细胞,调整细胞浓度为1×105个/ml,取100 μl加入96孔板中,加入DMEM培养基放置于37℃,5%CO2培养24 h,将FA分别稀释到80、40、20、10、5 μg/ml、每孔加入10 mg/ml的CCK-8溶液,5%CO2培养4 h,弃去CCK-8溶液,加入200 μl DMSO溶液,震荡10 min,使其完全溶解,全自动酶标仪波长490 nm处测量各孔的吸光值。
1.6酶联免疫吸附试验(ELISA)检测IGF-1和PGE2浓度 取各组软骨细胞培养上清,按照ELISA试剂盒操作说明进行检测。
1.7蛋白免疫印迹检测MMP13、Wnt2、p-GSK-3p、β-catenin、B淋巴细胞瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)的表达 加入细胞裂解液,冰上放置20~30 min,超声裂解30 s,12 000 r/min,4℃离心10 min,收集上清,置于-20℃保存。BCA定量法检测蛋白浓度,待测样品和上样缓冲液混合,100℃水域变性5 min,然后加入制备好的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭聚偏氟乙烯(PVDF)膜2 h,加入一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h。加入电化学发光试剂(ECL)显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
1.8统计学分析 采用SPSS16.0软件进行t检验,制图采用Graphpad5.01软件。
2 结 果
2.1各组软骨细胞对比及鉴定 空白组软骨细胞基质呈浅棕色、排列整齐,着色均匀,而细胞核无着色;模型组软骨细胞基质着色深,出现严重变形或排列紊乱,孔隙不均匀增大,细胞核均着色;与模型组相比,低剂量组及高剂量组软骨细胞基质着色较浅,部分细胞核着色,尤其是高剂量组改善明显。见图1。

图1 空白组软骨细胞和模型组OA软骨细胞形态学观察(DAB,×200)
2.2FA对力竭运动大鼠OA软骨细胞超微结构的影响 空白组软骨细胞呈卵圆形,细胞膜及细胞核完整,细胞质内可见完整线粒体、粗面内质网及高尔基体;模型组细胞大部分呈现肿胀状态,细胞核形态异常,胞质内脂滴增多,线粒体数目明显减少,大部分粗面内质网高度扩张,部分溶解断裂;低剂量组软骨细胞部分呈现肿胀形态,细胞质空泡化,可见脂滴,线粒体数目减少,且明显变形,粗面内质网扩张明显;高剂量组软骨细胞少部分肿胀,细胞核基本正常,线粒体空泡化,线粒体嵴较模糊,可见轻度扩张的粗面内质网。见图2。

图2 FA对力竭运动大鼠OA软骨细胞超微结构的影响(×20 000)
2.3FA对力竭运动大鼠OA软骨细胞增殖的影响 模型组软骨细胞增殖率(19.6%)显著低于空白组(98.5%),低剂量组(52.6%)、高剂量组软骨细胞增殖率(75.1%)显著高于模型组,且高剂量组软骨细胞的增殖水平更高(均P<0.05)。
2.3FA对力竭运动大鼠OA软骨细胞IGF-1和PGE2水平的影响 模型组IGF-1水平明显低于空白组,而低剂量组和高剂量组IGF-1水平明显高于模型组(P<0.05)。模型组PGE2水平明显高于空白组,而低剂量组和高剂量组PGE2水平明显低于模型组(P<0.05),见表1。
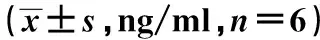
表1 FA对力竭运动诱导的OA软骨细胞IGF-1和PGE2水平的影响
2.4FA对力竭运动大鼠OA软骨细胞MMP13表达的影响 模型组MMP13蛋白表达(3.85±0.41)明显高于空白组(1.04±0.08,P<0.05),而低剂量组(2.82±0.33)和高剂量组IGF-1水平(2.05±0.18)明显低于模型组(P<0.05),见图3。
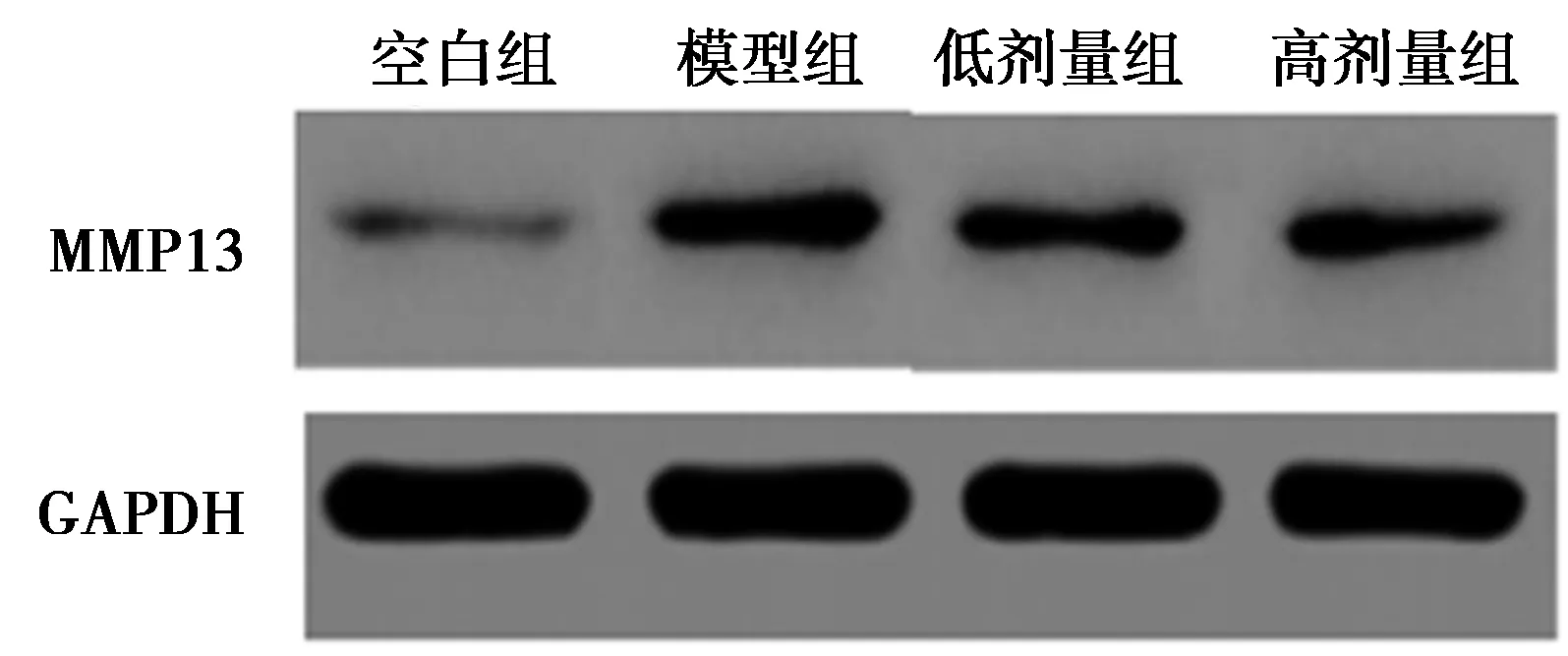
图3 Western印迹检测MMP13蛋白表达
2.5FA对力竭运动大鼠OA软骨细胞凋亡蛋白Bcl-2、Bax的影响 与空白组相比,模型组Bcl-2明显降低,Bax显著升高(P<0.05);与模型组相比,低剂量组、高剂量组Bcl-2明显升高,Bax明显降低(P<0.05),且高剂量组的变化更明显(P<0.05),见图4,表2。
图4 FA对LPS诱导的OA软骨细胞凋亡蛋白Bcl-2、Bax的影响

表2 细胞凋亡蛋白Bcl-2和Bax相对表达量
2.6FA对力竭运动大鼠OA软骨细胞Wnt/β-catenin信号通路相关蛋白表达的影响 与空白组相比,模型组Wnt2、p-GSK-3β、β-catenin水平明显升高,与模型组比较,低剂量组、高剂量组wnt2、p-GSK-3β、β-catenin水平明显降低(P<0.05),FA呈剂量依赖性,见图5,表3。

图5 FA LPS诱导的OA软骨细胞Wnt/β-catenin信号通路相关蛋白表达的影响

表3 Wnt/β-catenin信号通路相关蛋白表达量
3 讨 论
OA是一种常见的关节软骨病变,以继发性骨质增生为主要病理表现,致病原因多为过度劳损、衰老损伤、先天关节畸形等原因导致关节软骨破坏、关节间隙狭窄、滑膜增生等〔11〕。文献报道〔12〕称OA最先出现骨细胞增殖障碍,细胞活性降低,随着病情的发展会出现关节细胞坏死,最终引起骨关节代谢性增生。FA具有降血脂、抗血栓、抗氧化等生物活性,能够减少机体合成IL-1β,提高机体超氧化歧化酶的活性,减少丙二醛的含量缓解OA患者的临床症状,对OA引发并发症具有良好的改善作用〔13〕。本研究结果说明FA具有保护OA软骨细胞的功能。IGF-1作为软骨细胞合成因子,在促进细胞生存代谢过程中起着重要作用,其分泌减少和OA发生密切相关。PGE2是骨关节炎促炎症因子和分解代谢介质,文献报道〔14,15〕称其能够促进MMPs的合成,MMP13是由软骨细胞合成分泌的一种胶原酶,主要溶解Ⅱ型胶原蛋白,发生OA时,细胞碎片上调MMP13的表达,阻碍Ⅱ型胶原蛋白的表达,加速骨蛋白的多糖的流失,使软骨细胞遭受损害。本研究结果说明FA能够抑制MMP13表达和PGE2水平来保护骨关节软骨基质。细胞Bax作为促凋亡基因,主要通过与线粒体结合,促进其释放促凋亡蛋白诱导凋亡,而Bcl-2则会阻止Bax与线粒体结合,从而抑制细胞凋亡〔16〕,本研究结果提示FA能够抑制软骨细胞的凋亡。
文献报道〔17〕称Wnt/β-catenin信号通路与骨细胞的移行、黏附、分化、骨关节正常生长、损伤修复过程有关,该信号通路激活会加重OA的发展,经典的β-catenin信号通路活化表现为β-catenin在细胞质中积累并移向细胞核,与T细胞核因子和淋巴增强因子共同作用,启动Wnt下游转录。研究表明〔18〕GSK-3β能够促进β-catenin的降解,在多种肿瘤模型中已经证实抑制GSK-3β能够促进β-catenin信号通路激活。研究人员〔19〕将新型没食子酸作用于软骨细胞,发现该没食子酸能激活Wnt/β-catenin通路,促进软骨细胞增殖。本研究结果显示大强度力竭运动构建OA模型后,Wnt2、β-catenin水平明显升高,且促进了GSK-3β的磷酸化,从而提示Wnt/β-catenin信号通路参与了OA的发生发展,采用FA处理后,Wnt2、β-catenin及p-GSK-3p水平明显降低,说明FA可能是通过抑制Wnt/β-catenin信号通路,起到保护软骨细胞的作用。
