保元汤活性成分4’,7,8-三羟基二氢黄酮抑制过氧化氢诱导人脐静脉内皮细胞损伤的作用机制研究
2022-02-11孟英心张子歆王凌潇马家乐靳凤玉王鑫玉赵一慕郑姣屠鹏飞
孟英心 张子歆 王凌潇 马家乐 靳凤玉 王鑫玉 赵一慕 郑姣 屠鹏飞
氧化应激损伤是多种心血管疾病的重要诱因,包括动脉粥样硬化、心肌缺血再灌注损伤、心力衰竭等[1]。心血管疾病发病过程中,血液中的氧自由基和氧化低密度脂蛋白通过激活血管内皮表面的细胞信号通路刺激活性氧(reactive oxygen species,ROS)的产生诱发血管内皮细胞的过氧化损伤,从而导致动脉粥样硬化,因此寻找安全有效的抗氧化先导化合物是目前药物研发的热点。保元汤最早记载于《博爱明鉴》,是根据李东垣的黄芪汤所更改得来,包含人参、黄芪、肉桂、甘草四味药材,在中医理论上具有大补元气、治一切元气虚弱之症的功效[2]。
近几年来保元汤在心血管疾病的临床应用上有着确切疗效[3]。本课题组前期对保元汤的化学成分做了系统的分离鉴定,共鉴定出皂苷类、黄酮类等236个化合物[4],其中甘草与黄芪中的大量黄酮类成分可能是保元汤抗氧化的药效物质。通过前期筛选发现4',7,8-三羟基二氢黄酮(4',7,8-trihydroxydihydroflavonoid,TF)具有较强的抗氧化作用,因此本研究对TF改善人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的过氧化损伤进行了系统的研究,以期阐明保元汤抗氧化的药效物质和作用机制,为其治疗心血管疾病的临床应用提供理论基础。
1 材料与方法
1.1 保元汤处方与饮片
保元汤由黄芪(Astragalusmembranaceus(Fisch.)Bge.),人参(PanaxginsengC. A. Mey.),甘草(GlycyrrhizauralensisFisch.)和肉桂(CinnamomumcassiaPresl)以6∶2∶2∶1的比例混合而成。原料药材于河北省安国药材市场购买,由屠鹏飞教授鉴定。TF从保元汤总提物中分离得到(图1),纯度大于98%。
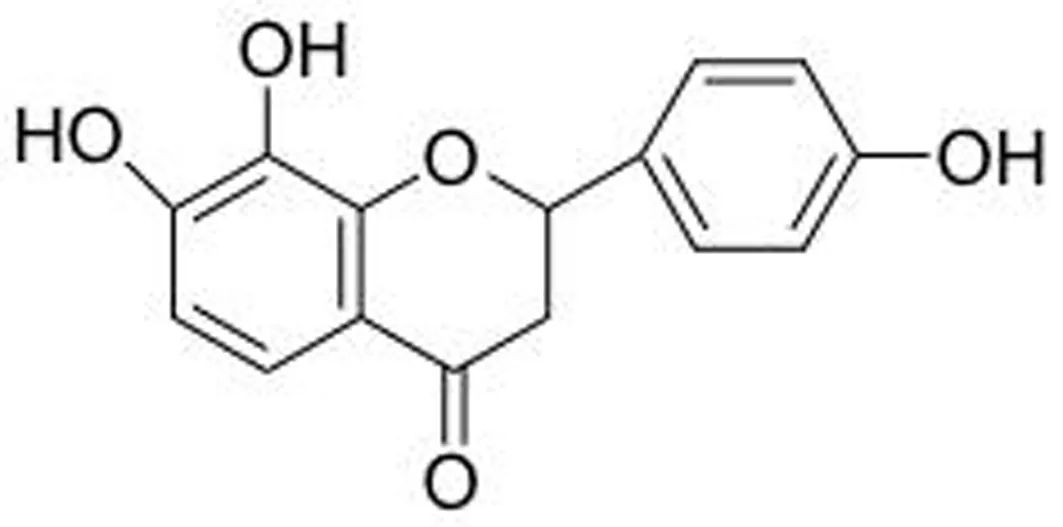
图1 4’,7,8-三羟基二氢黄酮的化学结构式
1.2 TF的提取与分离
取黄芪饮片30 kg,人参药材10 kg,炙甘草饮片10 kg,肉桂药材5 kg,混合,以10倍量去离子水煎煮三次,每次2小时,过滤,合并滤液,减压浓缩保元汤至密度约为1.10 kg/L,离心得保元汤提取液。保元汤提取液经AB-8型大孔吸附树脂纯化,依次用3倍柱体积的水和不同浓度的乙醇(15%、30%、50%和95%乙醇)洗脱,收集50%乙醇洗脱液,减压浓缩,干燥,即得50%乙醇洗脱部位(623.4 g)。50%乙醇洗脱部位经硅胶(100~200目)柱色谱分离,氯仿-甲醇-水(95∶5∶0.5,90∶10∶1,85∶15∶1.5,80∶20∶2,70∶30∶3)梯度洗脱,TLC检测,合并得10个流分(A-J)。G(2.5 g)再经硅胶柱色谱分离,氯仿-甲醇-水(85∶15∶1.5)洗脱,TLC检测,合并得3个流分(G1-G3)。G3(729 mg)经反相柱色谱分离,甲醇-水(5∶95→70∶30)梯度洗脱,得到化合物TF(10 mg)。保元汤活性化合物的分离,以及4’,7,8 -三羟基二氢黄酮的结构鉴定由北京大学药学院研究生马晓丽完成。
1.3 主要试剂与仪器
DMEM培养基(批号:11965092)、青霉素-链霉素(批号:15140163)、胎牛血清(批号:12483020)、磷酸盐缓冲液(phosphate buffer saline,PBS)(批号:20012050)、胰酶(批号:25200072)均购自美国Gibco公司;维生素C(批号:B21293)购自上海源叶生物科技有限公司;CCK-8试剂盒(批号:BN15201)购自北京拜尔迪生物技术有限公司;活性氧检测试剂盒(批号:S0033S)、总抗氧化能力检测试剂盒(ABTS法)(批号:S0119)、RIPA裂解液(批号:P0013B)均购自上海碧云天生物技术有限公司;PARP(批号:60004-1-Ig)、β-actin(批号:60004-1-Ig)、GAPDH(批号:60004-1-Ig)、P-Akt(批号:66444-1-Ig)、Bcl-2(批号:60178-1-Ig)均购自美国Proteintech公司。
多功能酶标仪(美国PerkinElmer公司);冷冻离心机(美国Eppendorf公司);CriterionTM型电泳槽(美国Bio-Rad公司);DYY-6D型电泳仪(北京六一仪器厂);细胞培养箱(日本SANYO公司);倒置荧光显微镜(德国Leica公司)
1.4 细胞培养
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)由北京大学曾克武教授赠予。HUVEC采用含10%灭活胎牛血清,1%的青霉素-链霉素双抗的DMEM培养基,置于37℃,5% CO2细胞培养箱中培养,隔天更换1次培养基,取对数生长期的细胞后,取1 mL胰酶于培养箱中消化细胞1分钟左右;终止消化后收集细胞,800 r/min离心5分钟,弃上清,加入完全培养液,适当比例传于培养瓶中继续培养。
1.5 H2O2诱导的HUVEC氧化损伤模型建立
实验分为对照组和H2O2处理组(给予不同浓度的H2O2),每组每浓度设置六个复孔。HUVEC细胞以5×103个/孔均匀接种于96孔板,生长24小时后,对照组用完全培养基正常培养HUVEC细胞;H2O2处理组每孔加入DMEM培养基和终浓度分别为10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L、60 μmol/L的H2O2,孵育1小时。取出以CCK-8试剂稀释10倍,每孔加入100 μL,置于37℃含5% CO2的培养箱中培养2小时后,利用酶标仪在490 nm波长处测定各孔OD值。
1.6 TF对H2O2损伤HUVEC存活率的影响
取对数生长期HUVEC细胞以5×103个/孔均匀接种于96孔板,生长24小时后,设置对照组、模型组、TF低、中、高剂量组(终浓度分别为5 μmol/L、10 μmol/L、20 μmol/L),每组设置六个复孔。对照组加入完全培养基,不做任何处理。TF低、中、高剂量组处理细胞6小时后,再分别用终浓度为15 μmol/L、30 μmol/L的H2O2刺激细胞1小时。细胞加入CCK-8试剂并置于37℃含5% CO2的培养箱中培养2小时后,利用酶标仪在490 nm波长处测定各孔OD值。
按照以上分组方法,TF预处理细胞6小时后,对模型组与TF低、中、高剂量组以终浓度为20 μmol/L的H2O2处理细胞1小时,置于显微镜下观察HUVEC细胞的数量及形态学变化。
1.7 检测指标
1.7.1 检测细胞内ROS 按照1.6项下方法接种细胞、分组、造模及给药。根据DCF-DA试剂盒操作方法测定ROS。
1.7.2 TF对DPPH自由基体外清除的测定 根据文献报道的方法[5]测定TF对DPPH自由基的清除活性。取2 mL 0.16 mmol/L DPPH自由基溶液分别加入到2 mL不同浓度的TF溶液中(10 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L),每组设置六个复孔。在室温下避光30分钟后。在517 nm下测量反应混合物的OD值,溶液褪色程度与药物清除自由基活性呈正相关,并以天然抗氧化剂维生素C用作阳性对照。
1.7.3 蛋白免疫印迹法(Western Blot)检测细胞凋亡相关蛋白表达情况 HUVEC细胞按常规方法培养,取对数生长期细胞以5×103个/孔均匀接种于12孔板,设置对照组、模型组、TF低、中、高剂量组(终浓度分别为5 μmol/L、10 μmol/L、20 μmol/L)。对照组加入完全培养基,不做任何处理。TF低、中、高剂量组处理细胞6小时后,再以终浓度为20 μmol/L的H2O2处理1小时。收集细胞,加入4℃预冷的SDS细胞裂解液100 μL充分裂解后离心制备蛋白样品。在10% SDS-聚丙烯酰胺凝胶上电泳分离蛋白质样品并转移到PVDF膜上。用TBST配制的5%脱脂乳封闭2小时后,将膜与一抗在4℃下孵育过夜,洗涤印迹并与二抗在室温下孵育2小时,将膜再次用TBST洗涤3次,使用ECL试剂对蛋白质条带进行可视化,并用Image J软件进行定量。
1.8 数据处理
2 结果
2.1 H2O2对HUVEC细胞存活率的影响
通过CCK-8实验来检测H2O2浓度对HUVEC细胞损伤的影响,结果显示与对照组比较,H2O2处理组细胞的存活率明显降低(P<0.05),IC50=(19.86±0.98)μmol/L,因此本研究后续实验选择15 μmol/L和30 μmol/L浓度的H2O2损伤HUVEC细胞。见表1。
表1 CCK-8法检测不同浓度的H2O2对HUVEC细胞存活率的影响
2.2 TF对H2O2损伤HUVEC细胞存活率的影响
使用15 μmol/L的H2O2损伤HUVEC细胞后,与对照组相比,模型组HUVEC细胞存活率降低至(76.30±5.31)%(P<0.05),中、高剂量TF给药后均显著提高细胞存活率(P<0.01),分别提高(27.42±2.81)%和(42.30±1.41)%。见表2。
表2 TF对15 μmol/L H2O2诱导的HUVEC细胞存活率的影响
使用30 μmol/L H2O2损伤HUVEC细胞后,与对照组相比,模型组HUVEC细胞存活率降低至(23.90±0.59)%(P<0.05),中、高剂量TF给药后均显著提高细胞存活率(P<0.05),分别提高(63.72±12.01)%和(146.43±8.80)%。见表3。
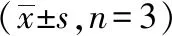
表3 TF对30 μmol/L H2O2诱导的HUVEC细胞存活率的影响
细胞形态学观察结果显示,终浓度为20 μmol/L的H2O2处理细胞后,细胞数量大量减少,胞体边缘模糊,折光性减弱,贴壁能力降低。20 μmol/L浓度TF给药后,HUVEC细胞数量较模型组显著上升,细胞折光性及贴壁功能恢复良好。综上得出,TF预处理能够抑制H2O2所致的HUVEC的氧化应激损伤。见图2。

注: A 对照组; B 模型组; C TF低剂量组; D TF中剂量组; E TF高剂量组
2.3 TF对H2O2损伤HUVEC细胞ROS水平的影响
DCFH-DA荧光探针可以在细胞内水解生成DCFH,进而被细胞内的ROS氧化,生成可以产生绿色荧光的DCF。当细胞受到氧化损伤,细胞内的ROS含量增加,荧光强度会增加。模型组用20 μmol/L的H2O2造模,与模型组相比较,TF低、中、高剂量组绿色荧光逐渐减弱,显示细胞内ROS水平减少,且呈剂量依赖性。综上,TF预处理能够降低HUVEC细胞ROS水平。见图3。
注: A 模型组; B TF低剂量组; C TF中剂量组; D TF高剂量组
2.4 TF对DPPH自由基的清除作用
通过DPPH自由基清除实验,验证TF对自由基的体外清除作用。实验结果发现,终浓度10 μmol/L的TF就可显著增加自由基的清除(P<0.05),终浓度达到100 μmol/L时自由基清除率可达到(93.69±1.06)%,与相同剂量阳性药维生素C的自由基清除效果相似,表明TF具有良好的自由基清除活性。见表4。
2.5 TF对HUVEC细胞凋亡相关蛋白表达的影响
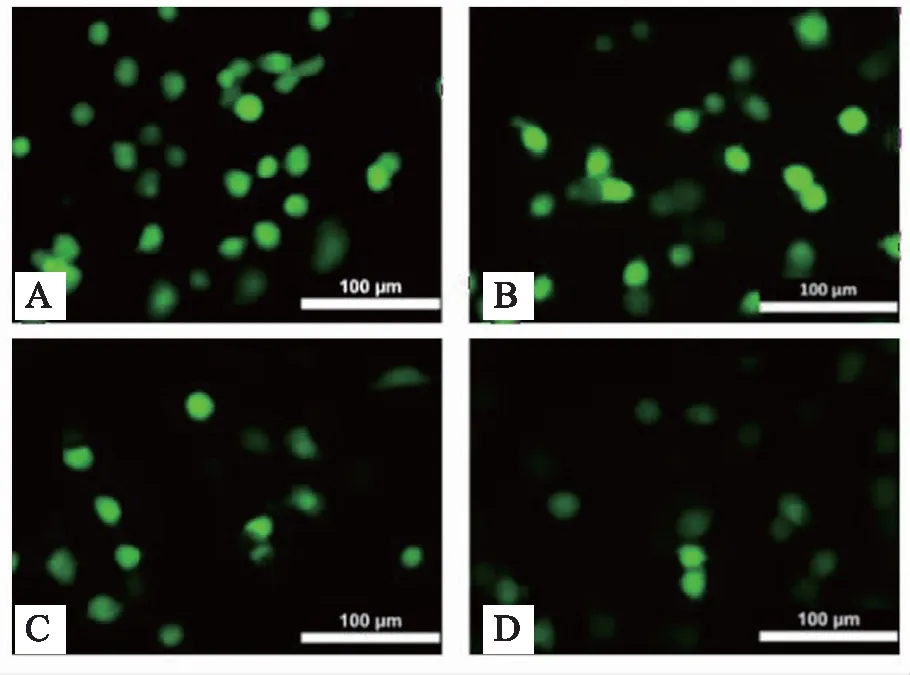
20 μmol/L剂量H2O2损伤细胞后,HUVEC细胞中磷酸化蛋白激酶B(phosphorylated protein kinase B,P-Akt)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)以及腺苷二磷酸核糖聚合酶(poly adenosinedip-hosphate-ribose polymerase,PARP)的含量显著降低(P<0.05) ,而Cleaved PARP的含量显著增加(P<0.05), 表明细胞凋亡程度增强。 TF给药后,能剂量依赖地增加P-Akt和Bcl-2的含量,抑制PARP蛋白的裂解,较模型组具有显著性差异(P<0.05)。结果证实TF通过P-Akt调控PARP的裂解,从而改善HUVEC细胞凋亡。结果见图4,表5。
表4 TF对H2O2诱导的HUVEC细胞DPPH自由基清除的影响
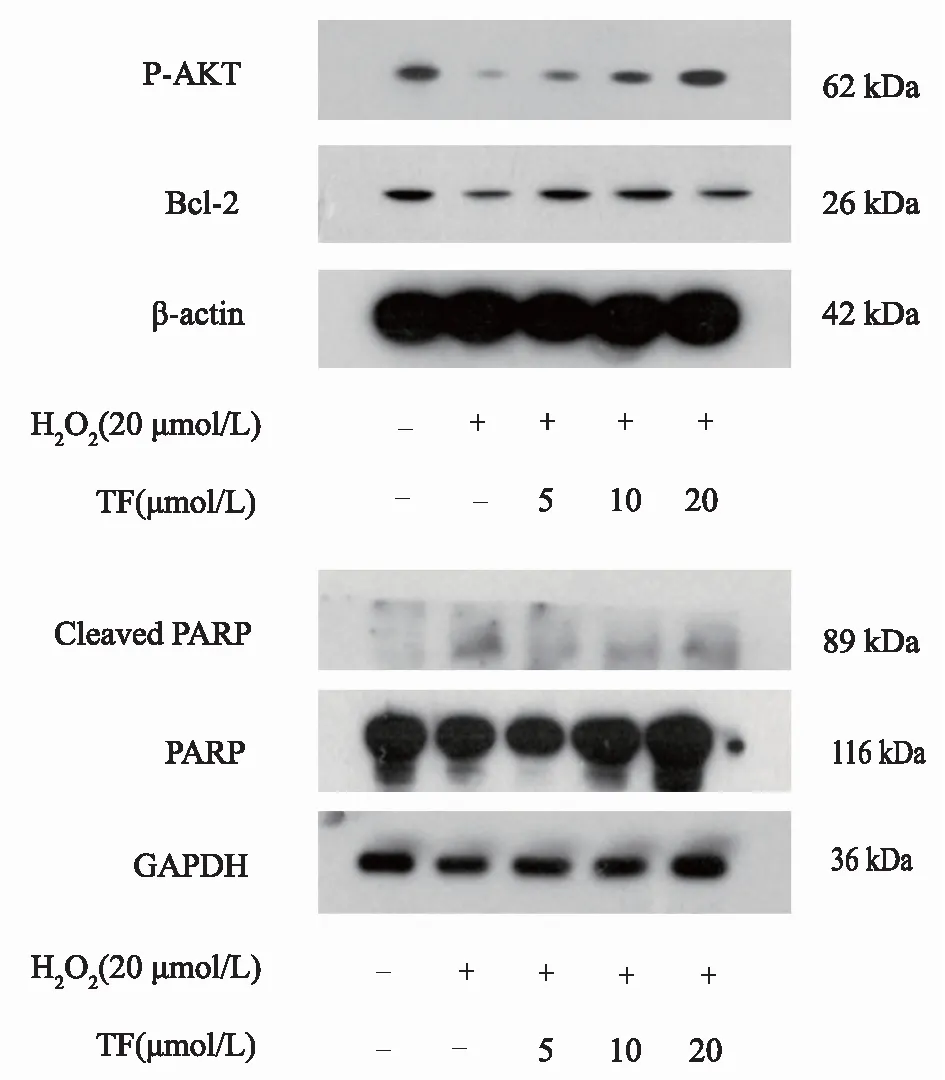
图4 TF对H2O2诱导后的HUVEC细胞中凋亡相关蛋白表达的影响
表5 TF对H2O2诱导后的HUVEC细胞中P-Akt、Bcl-2、Cleaved PARP、PARP表达的影响
3 讨论
血管内皮细胞功能障碍是心血管疾病最重要的病理改变之一,可导致包括动脉粥样硬化在内的心血管疾病的形成和发展[6]。因此,从中草药中筛选出具有内皮细胞保护作用的活性先导化合物具有重要的临床意义[7]。根据记载保元汤可保守真元之气,提高免疫,延缓衰老,且已被证明有抗氧化作用[8-9],本课题组前期筛选了保元汤中的药物,实验结果显示TF的抗氧化性最佳,因此选择该药物进行进一步的实验。
氧化应激是指活性氮自由基或ROS等高活性酶的过量产生,导致蛋白质变性、生物膜脂质过氧化、DNA损伤、细胞凋亡或坏死。H2O2已被广泛用于刺激不同细胞类型的氧化应激[10]。这种非自由基氧化剂和可扩散分子已被认为是内皮细胞中促凋亡和促坏死的氧化介质,不同浓度和孵育时间已经用于评估不同研究中的H2O2细胞毒性[11-12],CCK-8法检测显示,用15 μmol/L和30 μmol/L的H2O2处理HUVEC细胞1小时,HUVEC细胞存活率明显降低至45%~55%,并具有一定的剂量依赖性,造模条件稳定,因此确定此条件进行后续实验研究。本研究通过CCK-8法检测HUVEC细胞存活率,发现TF给药后,细胞存活率呈浓度依赖性提高,提示TF对H2O2诱导的氧化损伤有良好的保护作用。在本研究中,本课题组发现H2O2显著诱导HUVEC中ROS的形成,而TF实验组逆转了H2O2对ROS形成的促进作用,说明TF可能通过抑制ROS的形成来发挥其抗氧化作用。
本文进一步研究了TF对DPPH自由基的清除作用,发现TF可以通过清除自由基DPPH发挥抗氧化作用。为了继续探究TF抑制H2O2诱导HUVEC细胞损伤的作用机制,本课题组评估了TF对HUVEC细胞凋亡相关蛋白表达的影响。Akt是一种丝氨酸/苏氨酸蛋白激酶,在细胞凋亡的过程中起到着重要的作用,当磷脂酰肌醇-3激酶被激活时,Akt会被细胞外因子激活,发生构象改变,暴露其磷酸化位点,形成P-Akt[13]。P-Akt被激活后,线粒体途径的Bcl-2也会被激活。Bcl-2属于抗凋亡蛋白,过量表达可以改变线粒体膜的通透性,抑制巨孔形成,防止细胞色素c从线粒体中释放,抑制细胞凋亡[14]。PARP是一种DNA修复酶,对DNA的损伤修复以及细胞凋亡起着重要的作用,受到上游P-Akt与Bcl-2的调控[15]。为了进一步探讨TF对H2O2所致的HUVEC损伤细胞的保护作用,本实验通过Western Blot法观察了不同处理后P-Akt、Bcl-2以及PARP表达量,结果表明TF预处理可以显著改善H2O2所致的HUVEC细胞内P-Akt、Bcl-2以及PARP的表达异常。综上所述保元汤中的单体化合物TF可以通过调控P-Akt/PARP/Bcl-2通路抑制HUVEC细胞的凋亡,从而改善血管内皮细胞的过氧化损伤,因此,TF可能是一种很有前景的抗氧化损伤和氧化应激相关心血管疾病的药物。
保元汤是治疗元气虚弱的经典名方,临床上应用于心血管疾病的治疗,疗效确切,安全性好。在前期的研究中,研究人员更加集中于其临床疗效的探索,而缺乏物质基础跟药理学方面的研究。本研究在前期对分离鉴定出的保元汤的化学成分活性筛选的基础上,发现保元汤中的化学成分TF具有较强的抗氧化作用,通过血管内皮细胞HUVEC的过氧化损伤模型,明确了TF改善血管内皮细胞过氧化损伤的作用机制,发现了保元汤保护血管内皮细胞的药效物质,为其临床应用提供理论依据。
